Bac Physique chimie 1er groupe S1, S1A, S3 2020
Exercice 1 (04 points)
L'objectif de l'exercice est l'étude de la réaction des ions éthanoate avec l'eau d'une part et avec l'acide méthanoïque d'autre part.
Données :
$-\ $La masse molaire de l'éthanoate de sodium $M(CH_{3}COONa)=82\;g\cdot mol^{-1}$
$-\ $Le produit ionique de l’eau à $25\;^{\circ}C$ est : $Ke=1.0\cdot10^{-14}$
$-\ $La constante d’acidité du couple $CH_{3}COOH/CH_{3}COO^{-}\ $ à $\ 25\;^{\circ}C$ est $K_{a_{1}}=1.78\cdot10^{-5}$
$-\ $Toutes les mesures sont faites à la température $25\;^{\circ}C.$
1.1 $-\ $Etude de la réaction des ions éthanoate avec l’eau.
Des cristaux d’éthanoate de sodium de masse $m=410\;mg$ sont dissous dans $V=500\;mL$ d'eau distillée pour obtenir une solution $S_{1}$ de concentration molaire volumique $C_{1}.$
La mesure du $pH$ de la solution $S_{1}$ donne $pH=8.4$
1.1.1$-\ $Ecrire l’équation-bilan de la réaction entre les ions éthanoate et l’eau. (0.25 point)
1.1.2$-\ $En négligeant l’autoprotolyse de l’eau, exprimer le coefficient de transformation des ions éthanoate dans l'eau $\alpha_{1}=\dfrac{[OH^{−}]}{C_{1}}$ en fonction de $pKe\;,\ C_1\ $ et $\ pH.$
Calculer $\alpha_{1}$. (0.5 point)
1.1.3$-\ $Etablir la relation liant la constante de réaction réduite $K_r$, associée à l’équation écrite à la question
1.1.1 en fonction de $C_1\ $ et $\ \alpha_{1}$ puis vérifier que $K_{r}=6.3\cdot10^{-10}$. (0.75 point)
1.2$-\ $Etude de la réaction des ions éthanoate avec l’acide méthanoïque.
Un volume $V_{1}=50.0\;mL$ d'une solution aqueuse d’éthanoate de sodium de concentration $C=1.00\cdot10^{-2}\;mol\cdot L-^{1}$ est mélangé avec un même volume d’une solution aqueuse d’acide méthanoïque de même concentration $C.$
1.2.1$-\ $Ecrire l'équation-bilan de la réaction entre les ions éthanoate et l'acide méthanoïque (0.5 point)
1.2.2$-\ $La valeur de la constante de réactionassociée à l’équation de la réaction est $K=10.$
a$-\ $La réaction est-elle totale ?
Justifier. (0.5 point)
b$-\ $En déduire la valeur de la constante d’acidité $Ka_{2}$ du couple $HCOOH/HCOO_{-}$. (0.5 point)
Exercice 2 (3 points)
L’éthanoate d’éthyle est un ester qui peut être utilisé comme solvant.
A la date $t=0\;s$, il effectue un mélange équimolaire d’ester et d’hydroxyde de sodium, de volume $V=1\;L$, contenant $n_{\text{ester}}=5\cdot10^{-2}\;mol\ $ et $\ n_{\text{soude}}= 5\cdot10^{-2}\;mol.$
Le mélange est maintenu à une température constante.
Toutes les quatre minutes, le groupe d’élèves prélève $5\;mL$ du mélange qu’il dilue avant de doser l’hydroxyde de sodium restant par une solution d’acide chlorhydrique de concentration molaire $Ca=10^{-2}\;mol/L.$
On désigne par aVle volume d’acide versé.
Les résultats sont consignés dans le tableauindiqué ci-après.
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|c|c|c|}
\hline
t(min)&0&4&8&12&16&20&24&28&32&36&40&44\\
V_{a}(mL)&25,0&22,0&19,
8&18.0&16.5&15.0&13.8&12.8&12.0&11.5&11.0&10.5\\ \hline
[\text{ester}]\text{ en }mol.L^{-1}&&&&&&&&&&&&\\
\hline
\end{array}$$
2.1. Définir la saponification et rappeler ses caractéristiques. (0.5 point)
2.2.$-\ $Quel est l’intérêt de la dilution avant le dosage ? (0.25 point)
2.3.$-\ $L’équation bilan complète de la réaction de saponification s’écrit :
$CH_{3}-COO-C_{2}H_{5}+(Na^{+}+ OH^{-})\rightarrow(CH_{3}-COO-+Na^{+}) +C_{2}H_{5}OH_{2}.$
2.3.1. $-\ $Montrer que la concentration de l’ester contenu dans chaque prélèvement est donnée parla relation : $[\text{ester}]= \dfrac{0.01\cdot V_{a}}{5}$ en $mol/L$ avec $V_{a}$ en $mL.$ (0.25 point)
2.3.2. Recopier le tableau ci-dessus et le compléter en calculant la concentration de l’ester pour chaque prélèvement. (0.5 point)
2.3.3$-\ $Tracer la courbe représentative de la concentration de l’ester en fonction du temps : $[\text{ester}]=f(t).$ (0.5 point)
Echelles : $1\;cm$ pour $4\;min$ ; $1\;cm$ pour $0.5\cdot10^{-2}\;mol\cdot L^{-1}$
2.4$-\ $Le groupe d’élèves s’intéresse à la vitesse de la réaction.
2.4.1$-\ $Déterminer graphiquement la vitesse moyenne de disparition de l’ester entre les instants $t_{1}=10\;min\ $ et $\ t_{2}=30\;min.$ (0.5 point)
2.4.2$-\ $Donner la relation définissant la vitesse instantanée de disparition de l’ester.
Déterminer graphiquement la valeur de cette vitesse à $t_{0}=0\;min\ $ et à $\ t_{3}=20\;min.$
Dans quel sens évolue la vitesse instantanée ?
Justifier cette évolution. (0.5 point)
Exercice 3 (05 points)
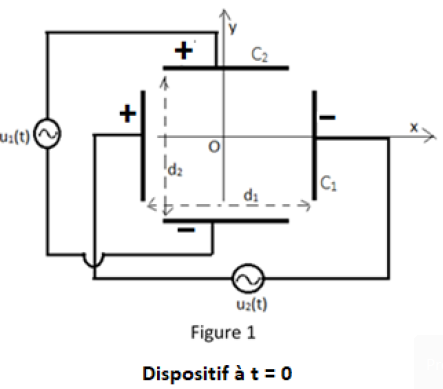
Desélectrons produits au centre $O$, par un dispositif non représenté, sont déviésdans un système constitué de deux condensateurs $C_{1}\ $ et $\ C_{2}$ placés perpendiculairement (voir figure 1).
Entre les plaques des condensateurs règneun vide poussé.
Les condensateurs $C_{1}\ $ et $\ C_{2}$ sont alimentés respectivement par les tensions $u_{1}(t)=u_{01}\cos(\omega t)\ $ et $\ u_{2}(t)=u_{02}\cos(\omega t+\varphi)$ ; $u_{01}\ $ et $\ u_{02}$ sont les amplitudes des tensions $u_{1}(t)\ $ et $\ u_{2}(t).$
Les distances entre les armatures des condensateurs $C_{1}\ $ et $\ C_{2}$ sont respectivement $d_{1}\ $ et $\ d_{2}.$
On notera $e$ la charge élémentaire.
3.1.On considère le dispositif à l’instant $t=0.$
Sur la figure $1$, onmontre la polarité des armatures des condensateurs $C_{1}\ $ et $\ C_{2}$ à cette date $t=0.$
On prendra $\varphi=0.$
Reproduire la figure 1 et y représenter les vecteurs champs électriques $\overrightarrow{E}_{1}\ $ et $\ \overrightarrow{E}_{2}$ régnant respectivement dans $C_{1}\ $ et $\ C_{2}$ au point $O.$ (1 point)
3.2. Les expressions vectorielles des champs $\overrightarrow{E}_{1}\ $ et $\ \overrightarrow{E}_{2}$, à l’instant $t$, s’écrivent :
$$\overrightarrow{E}_{1}=\vec{i}\dfrac{u_{01}}{d_{1}}\cos(\omega t)\ \text{ et }\ \overrightarrow{E}_{2}=-\vec{j}\dfrac{u_{02}}{d_{2}}\cos(\omega t)$$
Un système de réglage permet de visualiser les tensions $u_{1}(t)\ $ et $\ u_{2}(t)$ en ayant la base de temps suivant l’axe $Ox$ et la tension suivant l’axe $Oy$ ; avec $u_{01}>u_{02}.$
3.2.1. Pour une même sensibilité verticale, esquisser l'allure des courbes visualisées sur l'écran de l'oscilloscope bicourbe (1 point)
3.2.2. Préciser le signal correspondant à chaque tension. (0.5 point)
3.3. Les électrons sont émis au centre $O$ sans vitesse initiale.
On visualise maintenant diverses formes de courbes obtenues en supprimant la base de temps.
3.3.1. En appliquant la relation fondamentale de la dynamique, montrer queles coordonnées de l’accélération d’un électron de masse $m$ et de charge $q=-e$ peuvent se mettre sous la forme $\left\lbrace\begin{array}{lcl} \ddot{x}&=&A\cos(\omega t)\\ \ddot{y}&=&B\cos(\omega t+\varphi) \end{array}\right.$ où $A$ et $B$ sont des constantes à exprimer en fonction de $m$, $e$, $u_{01}$, $u_{02}$, $d_{1}$ et $d_{2}.$ (01 point)
3.3.2. En déduireles expressions des coordonnées de la vitesse et de la position
3.3.3. Écrire l'équation de la trajectoire des électrons en précisant la nature de cette trajectoire dans les cas suivants :
a) Pour $\varphi=0$, $d_{1}=d_{2}=d$ et $u_{01}=u_{02}=u_{0}.$ (0.5 point)
b) Pour $\varphi=\dfrac{\pi}{2}$; $d_{1}=d_{2}=d$ et $u_{01}=u_{02}=u_{0}.$
Exercice 4 (05 point)
Le solide $S_{2}$ est lui même relié à un ressort horizontal, de masse négligeable et de constante de raideur $k.$
L'autre extrémité du ressort est fixe en $O.$
La piste comporte une rampe $AB$ de longueur $L$ inclinée d'un angle $\alpha$ sur l'horizontale.
Un trou $T$ placé sur l'horizontal permet de recevoir le solide $S_{1}$ (voir figure).
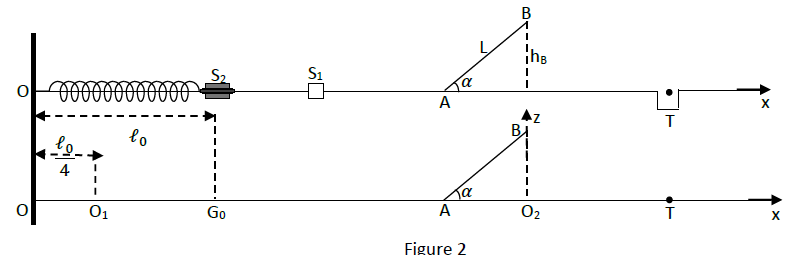
Tous les frottements sont négligés.
4.1.$-\ $Un joueur comprime le ressort : la nouvelle position du centre d'inertie $G_{2}$ du solide $S_{2}$ devient $O_{1}$ telle que $OO_{1}=0.25\ell_{0}.$
Puis ce même joueur le lâche sans vitesse initiale à un instant pris comme origine des dates.
4.1.1$-\ $Montrer que l'équation différentielle du mouvement du centre d'inertie du palet $S_{2}$ s'écrit : $\ddot{x}+\dfrac{k}{m_{2}}x=0$ où $x$ est l'abscisse de $S_{2}$ à un instant $t$ sur l'axe $(Ox)$ dont l'origine est $G_{0}.$ (0.75 point)
4.1.2$-\ $L'éqution horaire du mouvement de $S_{2}$ peut s'écrire sous la forme de : $x(t)=Q\sin (\omega_{0}t+\varphi)$ où $x$ et l'abscisse de $S_{2}$ à l'instant t sur l'axe $(Ox)$. (0.5 point)
4.1.2.1$-\ $Indiquer la nature du mouvement de $S_{2}$ ? (0.5 point)
4.1.2.2$-\ $Établir l'expression littérale de la période $T_{0}$ du mouvement.
Calculer $T_{0}.$ (0.5 point)
On prendra $m_{2}=200g$ et $k=20\;N/m4.$
1.2.3$-\ $Déterminer les valeurs des constantes $Q$ et $\varphi$ et en déduire numériquement l'équation horaire $x(t).$ (0.75 point)
4.2$-\ $Le choc entre les palets a lieu lorsque le centre d'inertie $G_{2}$ du solide $S_{2}$ passe en $G_{0}.$
Le solide $S_{1}$ acquiert alors une certaine vitesse qui lui permet d'aborder la rampe $AB$ avec un vecteur-vitesse $\overrightarrow{v}_{1}$ colinéaire et de même sens que $AB$ et de valeur $V_{1}=3.6m/s.$
4.2.1$-\ $Calculer la vitesse $V_{B}$ du solide $S_{1}$ au passage au sommet de la rampe, sachant que $B$ est situé à une hauteur $h_{B}=25\;cm$ au-dessus du plan horizontal passant par $A.$ (0.5 point)
4.2.2$-\ $On se propose d'étudier la trajectoire du centre d'inertie $G_{1}$ du solide $S_{1}$ au-delà du point $B$
L'origine des dates est choisie à l'instant où le solide $S_{1}$ quitte le point $B$ avec la vitesse $\overrightarrow{v}_{B}$
On suppose que le solide $S_{1}$ n'est soumis qu'à son poids.
4.2.2.1$-\ $Établir l'équation de la trajectoire du centre d'inertie $G_{1}$ du solide $S_{1}$ au-de là de $B$, dans le repère $(O_{2}xz).$ (0.5 point)
4.2.2.2$-\ $Établir l'expression littérale, puis numérique, de la vitesse du solide $S_{1}$ au sol. (0.5 point)
4.2.2.3$-\ $A quelle distance du point $O_{2}$ faut-il placer le trou $T$ ? (0.5 point)
Données :
$m_{2}=200\;g$ ; $k=20\;N/m$ ;$l_{0}=24cm$ ; $g=10\;m/s^2$ ; $\alpha=30^{\circ}.$
Excercice 5 (04 point)
Les photons sont assimilés à des « paquets » d'énergie élémentaire, ou quanta d'énergie qui sont échangés lors de l'absorption ou l'émission de la lumière par la matière.
Le photon est considéré comme une particule de masse nulle et d'énergie $E=hv.$
5.1. Excitation et désexcitation de l'atome d'hydrogène.
L'énergie d'un niveau $n$ de l'atome d'hydrogène est donnée par la relation $E_{n}=−\dfrac{E_{0}}{n^{2}}$ avec $E_{0}=13.6eV.$
Le diagramme ci-dessous donne des transitions possibles de l'électron de l'atome d'hydrogène (figure 3)
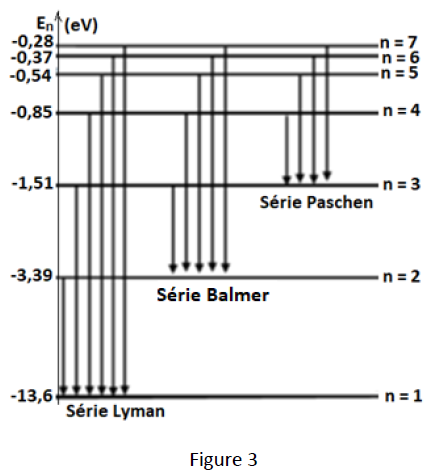
5.1.1$-\ $Dans lequel des deux tubes peut-on avoir une absorption des photons ?
Justifier. (0.75 point)
5.1.2$-\ $Calculer la longueur d'onde $\lambda_{1}$ du rayonnement émis lors de la transition de l'électron du niveau d'énergie $n=2$ au niveau d'énergie $n=1.$ (0.5 point)
5.1.3$-\ $La longueur d'onde $\lambda_{2}$ du rayonnement émis lors de la transition du niveau énergétique $p$ au niveau énergétique $n=2$ est $\lambda_{2}=489\;nm.$
Déterminer $p.$ (0.75 point)
5.2$-\ $Interaction entre la lumière et le zinc
5.2.1$-\ $Les radiations précédentes de longueur d'onde $\lambda_1\ $ et $\ \lambda_2$ sont utilisées pour éclairer la cathode en zinc d'une cellule photoémissive.
Le travail d'extraction d'un électron du métal zinc est $W_{0}=3.3\;eV.$
a) Calculer la fréquence seuil et la longueur d'onde seuil du métal zinc.(0.75 point)
b) Calculer l'énergie cinétique maximale d'éjection des électrons et leur vitesse. (0.75 point)
5.2.2$-\ $On éclaire la cathode en zinc par la lumière blanche.
Un effet photoélectrique est-t-il observé ? (0.5 point)
Justifier.
Données Pour la lumière blancheon a $400\;nm\leq\lambda\leq 800\;nm.$
Constante de Planck $h=6.63\cdot10^{-34} Js$ ;
célérité de la lumière dans le vide $C=3\cdot10^{8}\;m\cdot s^{-1}$ ;
$1eV=1.602\cdot10^{-19}\;J$ ;
masse de l’électron : $m=9.1\cdot10^{-31}\;kg.$
$$\text{Fin du sujet}$$

Ajouter un commentaire