Cinétique chimique - Ts
Classe:
Terminale
En chimie le plus souvent, on se contente d'écrire l'équation-bilan d'une réaction ; cette équation ne renseigne pas sur le caractère lent ou rapide d'une réaction.
Une réaction chimique peut être rapide, lente ou très lente ; sa durée dépend étroitement des conditions expérimentales.
La cinétique chimique est l'étude de l'évolution d'une réaction chimique, possible, au cours du temps.
I. Étude qualitative
1. Réactions rapides
Une réaction rapide se fait quasi-instantanément, dès que les réactifs sont en contact
Exemples :
$-\ $ Réaction entre $I_{2}$ et $S_{2}O_{3}^{2-}$
$-\ $ Réaction entre $H_{2}O_{2}$ et $MnO_{4}^{-}$ en milieu acide
2. Réactions lentes
Une réaction lente peut durer quelques minutes à plusieurs heures
Les produits ne se forment que progressivement
Exemple :
réaction entre $I^{-}$ et $S_{2}O_{3}^{2-}$
Il se forme $I_{2}$ qui colore le mélange réactionnel en jaune puis en brun de plus en plus foncé, au fur et à mesure que le temps passe
3. Réactions très lentes
Le système chimique ne semble pas évoluer au cours du temps.
La réaction peut durer plusieurs mois ou plusieurs années
Exemple :
formation de la rouille
II. Étude quantitative
1. Vitesse de formation ou disparition d'un corps
Dans le cas des réactions lentes, il est possible de suivre l'évolution des réactifs ou des produits au cours du temps
Considérons une réaction du type :
$aA\ +\ bB\ \longrightarrow\ cC\ +\ dD$
Pour suivre l'évolution de cette réaction, on peut :
$-\ $ soit mesurer la quantité des produit $C$ ou $D$ qui apparait en fonction du temps
$-\ $ soit mesurer la quantité des réactifs $A$ ou $B$ qui reste en fonction du temps
$A$ volume constant, on peut suivre expérimentalement la variation de la concentration de $A$ ou $B$ et $C$ ou $D$
1.1 Vitesse moyenne de formation ou de disparition du corps
1.1.1 Vitesse moyenne de formation d'un corps
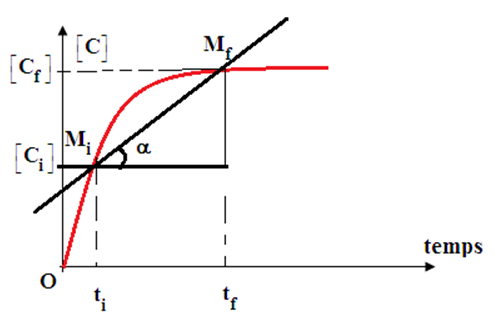
Soient $\left[C_{i}\right]$ et $\left[C_{f}\right]$ les concentrations molaires du produit $C$ aux instants $t_{i}$ et $t_{f}$
Par définition, la vitesse de formation de $C$ entre les instants $t_{i}$ et $t_{f}$ est :
$$V_{moy}(C)=\dfrac{\left[C_{f}\right]-\left[C_{i}\right]}{t_{f}-t_{i}}=\dfrac{\Delta[C]}{\Delta\,t}=\tan\alpha$$
Cette vitesse moyenne est représentée par le coefficient directeur de la droite $\left(M_{i}M_{f}\right)$ joignant les points $M_{i}$, $M_{f}$ de la courbe d'abscisses $t_{i}$ et $t_{f}$
La vitesse exprime en moles par litre et par seconde $\left(mol\cdot L^{-1}\cdot S^{-1}\right)$
1.1.2 Vitesse moyenne de disparition d'un corps
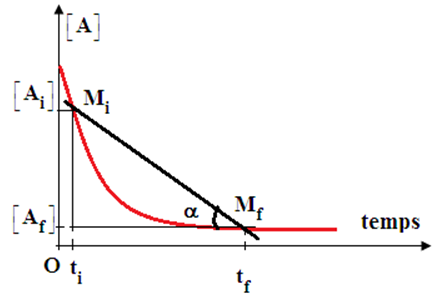
La vitesse moyenne de disparition du réactif $A$ entre les instants $t_{i}$ et $t_{f}$ caractérise la quantité moyenne de $A$ disparu par unité de temps dans cet intervalle
Elle vaut : $V_{moy}(A)=\dfrac{\left[A_{f}\right]-\left[A_{i}\right]}{t_{f}-t_{i}}=\dfrac{\Delta[A]}{\Delta\,t}=\tan\alpha$
Le signe moins $(-)$ s'explique par le fait $\Delta[A]<0$ alors que la vitesse est toujours positive
2. Vitesse instantanée de formation ou de disparition du corps
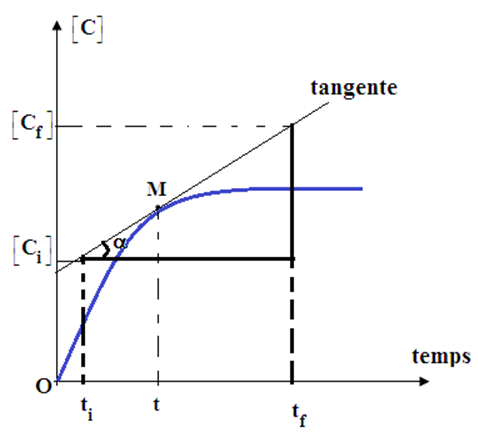
2.1 Vitesse instantanée de formation du corps
a) Définition
La vitesse instantanée de formation d'un produit $(C$ ou $D)$ est la dérivée par rapport au temps de sa concentration
$$V_{C}=\dfrac{d[C]}{\mathrm{d}\,t}\ ;\ V_{D}=\dfrac{d[D]}{\mathrm{d}\,t}$$
b) Traduction graphique
La vitesse instantanée de formation du produit $C$ ou $D$ à l'instant $t$ est donnée par le coefficient directeur de la tangente à la courbe au temps $t$ considérée
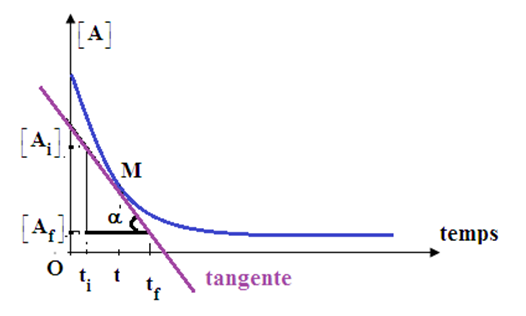
2.2 Vitesse instantanée de disparition d'un corps
a) Définition
La vitesse instantanée de disparition du réactif $A$ ou $B$ est l'opposé de la dérivée par rapport au temps de sa concentration
$$V_{A}=\dfrac{d[A]}{\mathrm{d}\,t}\ ;\ V_{B}=\dfrac{d[B]}{\mathrm{d}\,t}$$
b) Traduction graphique
La vitesse instantanée de disparition du réactif $A$ ou $B$ à l'instant $t$ est donnée par l'opposé du coefficient directeur de la tangente à la courbe au temps $t$ considéré
Remarque :
Pour une réaction donnée, il est possible de définir une vitesse unique dont la valeur indépendante de l'espèce considéré
Si l'équation-bilan de la réaction s'écrit :
$\boxed{aA\ +\ bB\ \longrightarrow\ cC\ +\ dD}$
La vitesse de réaction est définie par :
$\begin{array}{lcl} V&=&\dfrac{l}{c}\dfrac{d[C]}{\mathrm{d}\,t}\\&=&\dfrac{l}{d}\dfrac{d[D]}{\mathrm{d}\,t}\\&=&\dfrac{l}{a}\dfrac{d[A]}{\mathrm{d}\,t}\\&=&-\dfrac{l}{b}\dfrac{d[B]}{\mathrm{d}\,t}\\&\Rightarrow& V=\dfrac{V_{C}}{c}\\&=&\dfrac{V_{D}}{d}\\&=&\dfrac{V_{A}}{a}\\&=&\dfrac{V_{B}}{b} \end{array}$
3. Temps de demi-réaction
On caractérise souvent la rapidité avec laquelle la réaction se déroule par le temps de demi-réaction
Considérons la réaction d'équation
$$aA\ +\ bB\ \longrightarrow\ cC\ +\ dD$$
Le temps de demi-réaction est la durée nécessaire pour consommer la moitié du réactif limitant initialement présent
$-\ $ Si $A$ est le réactif limitant alors $n_{A}=\dfrac{1}{2}n_{iA}$ pour $t_{1/2}$
$-\ $ Si on opère en milieu liquide ou gazeux à volume constant alors $[A]=\dfrac{1}{2}[A_{i}]$ pour $t_{1/2}$
III. Facteurs cinétiques
Ce sont des grandeurs qui permettent d'influer sur les vitesses de réaction
1. Concentration des réactifs
Il faut un contact entre les réactifs pour que la réaction se fasse
En augmentant leur concentration, on augmente leur chance de se rencontrer : la réaction est plus rapide
$\bullet\ $ La vitesse volumique de réaction augmente quand la concentration des réactifs augmente
$\bullet\ $ Le temps de demi-réaction diminue quand la concentration en réactifs initiale augmente
Application :
$-\ $ Pour stopper une réaction qui a lieu en solution, on ajoute un solvant (l'eau par exemple) pour diluer les réactifs
$-\ $ Au fur et à mesure le temps passe, la concentration des réactifs diminue, donc la vitesse volumique de réaction diminue
2. La température
Quand la température augmente, l'énergie cinétique des réactifs augmente, les chocs entre eux sont plus violents, plus efficaces : la réaction plus rapide
$\bullet\ $ La vitesse volumique de réaction augmente quand la température augmente
$\bullet\ $ Le temps de demi-réaction diminue quand la température augmente
Application :
$-\ $ Pour bloquer une réaction, on ajoute de la glace pour arrêter brutalement le mélange réactionnel : c'est la trempe (opération qui consiste à bloquer une réaction en ajoutant de la glace pour refroidir brutalement le mélange réactionnel)
$-\ $ Pour déclencher une réaction, on utilise une allumette enflammée, une étincelle.
$-\ $ Pour cuire des aliments plus rapidement, on utilise une cocotte-minute $($la température d'ébullition de l'eau est de $120^{\circ}C)$
3. Surface de contact
Si l'un des réactifs est solide, la réaction est plus rapide si on augmente la surface de contact entre le solide et les autres réactifs en solution : on utilise des poudres au lieu de gros morceaux pour augmenter la vitesse volumique d'une réaction
4. Le catalyseur
4.1 Définition
Un catalyseur est une entité chimique, utilisée en faible proportion, capable d'augmenter la vitesse d'une réaction possible spontanément en son absence et sans apparaitre dans l'équation-bilan de la réaction
Remarque :
Lorsqu'une réaction chimique est catalysée par l'un des produits cette réaction ; elle est dite autocatalysée.
Il s'agit d'une autocatalyse
4.2 Caractères généraux de la catalyse
$\bullet\ $ Le catalyseur se trouve inaltérée à la fin de la réaction (puisqu'il n'entre pas dans l'équation-bilan)
$\bullet\ $ Une faible quantité de catalyseur permet, en général, la transformation de quantités importantes de réactifs
$\bullet\ $ Un catalyseur peut avoir une action orientatrice du fait de sa sélectivité
$\bullet\ $ Un catalyseur ne permet, en aucun cas, réaliser des réactions théoriquement impossibles
$\bullet\ $ Un catalyseur ne déplacer un équilibre chimique : il permet de l'atteindre rapidement
Autre définition du catalyseur
Un catalyseur est une espèce chimique qui diminue la durée d'une transformation : il participe à la réaction mais est régénéré en fin de réaction.
Il n'apparaît pas dans l'équation de la réaction

Commentaires
ACHY (non vérifié)
ven, 03/04/2022 - 01:36
Permalien
Téléchargement du cour
Zeyna dia (non vérifié)
mar, 03/22/2022 - 22:47
Permalien
Bac
Anonyme (non vérifié)
mar, 04/04/2023 - 02:26
Permalien
Bien
Hamady (non vérifié)
ven, 10/27/2023 - 02:57
Permalien
De pouvoir réaliser les activités
Diambodji Camara (non vérifié)
sam, 12/23/2023 - 23:54
Permalien
Besoin d'aide
Diambodji Camara (non vérifié)
sam, 12/23/2023 - 23:54
Permalien
Besoin d'aide
Diambodji Camara (non vérifié)
sam, 12/23/2023 - 23:56
Permalien
Besoin d'aide
Ajouter un commentaire