Solution des exercices : Les solutions 3e
Classe:
Troisième
Exercice 1
Exercice 2
Trouvons la molarité de chacune des solutions suivantes :
1) $0.3\;mol$ de $NaOH$ dans $4\;L$ d'eau.
On a : $c=\dfrac{n}{V}$
A.N : $c=\dfrac{0.3}{4}=0.075$
Donc, $\boxed{c=0.075\;mol/l}$
2) $29.25\;g$ de $NaCl$ dans $250\;mL$ d'eau.
On a : $c=\dfrac{n}{V}\ $ or, $n=\dfrac{m}{M}$
Donc, $c=\dfrac{m}{MV}\ $ avec, $M_{NaCl}=23+35.5=58.5\;g\cdot mol^{-1}$
A.N : $c=\dfrac{29.25}{58.5\times 250\;10^{-3}}=2$
Donc, $\boxed{c=2\;mol.l^{-1}}$
3) $56\;mL$ de gaz chlorhydrique dans les conditions normales dans $10\;L$ d'eau.
On a : $c=\dfrac{n}{V_{s}}\ $ or, $n=\dfrac{V}{V_{M}}\ $ avec, $V_{s}$ volume solution
Donc, $c=\dfrac{V}{V_{M}\times V_{s}}$
A.N : $c=\dfrac{56\;10^{-3}}{22.4\times 10}=0.00025$
Donc, $\boxed{c=2.5\;10^{-4}\;mol.l^{-1}}$
Exercice 3
Calculons la masse de $NaOH$ nécessaire.
On a : $c=\dfrac{n}{V}\ $ or, $n=\dfrac{m}{M}$
Donc, $c=\dfrac{m}{MV}\ \Rightarrow\ m=c\times V\times M$
On a : $M=M_{NaOH}=23+16+1=40\;g.mol^{-1}$
A.N : $m=0.5\times 250\;10^{-3}\times 40=5$
Donc, $\boxed{m=5\;g}$
Exercice 4
Trouvons la concentration massique de la solution.
On a : $c_{m}=\dfrac{m}{V}$
A.N : $c_{m}=\dfrac{100}{500\;10^{-3}}=200$
Donc, $\boxed{c_{m}=200\;g.l^{-1}}$
Déduisons sa molarité
On a : $c=\dfrac{n}{V}\ $ or, $n=\dfrac{m}{M}$
Donc, $c=\dfrac{m}{MV}\ $ or, $\dfrac{m}{V}=c_{m}.$
Ainsi, $c=\dfrac{c_{m}}{M}\ $ avec, $M=M_{CaCl_{2}}=40+2\times 35.5=111\;g.mol^{-1}$
A.N : $c=\dfrac{200}{111}=1.8$
Donc, $\boxed{c=1.8\;mol.l^{-1}}$
Exercice 5
Trouver la molarité de la solution diluée.
On a : $c'=\dfrac{c}{5}$
En effet, $c=\dfrac{n}{V}\ $ or, on a dilué 5 fois le volume.
Donc, $V'=5V\ $ et $\ c'=\dfrac{n'}{V'}=\dfrac{n'}{5V}\ $ or, $n'=n$
Ainsi, $c'=\dfrac{n}{5V}=\dfrac{c}{5}$
A.N : $c'=\dfrac{5\;10^{-2}}{5}=0.01$
Donc, $\boxed{c'=0.01\;mol.l^{-1}}$
Exercice 6
Indiquons, l'opération et les quantités à prendre.
On a : $c=\dfrac{n}{V}=2\;mol.l^{-1}\ $ et $\ c'=\dfrac{n'}{V'}=0.1\;mol\cdot l^{-1}\ $ or, $n=n'$
Donc, $\dfrac{c}{c'}=\dfrac{\dfrac{n}{V}}{\dfrac{n}{V'}}=\dfrac{V'}{V}$
Ainsi, $V=\dfrac{V'\times c'}{c}$
A.N : $V=\dfrac{200\times 0.1}{2}$
Donc, $\boxed{V=10\;ml}$
On prend $10\;ml$ de la solution dimolaire qu'on verse dans un fiole jaugé de $200\;ml$ et on remplit jusqu'au trait de jauge. Alors la solution obtenu est une solution dimolaire.
Exercice 7
1) Concentration molaire de la solution $B$
On a : $c_{B}=\dfrac{n_{B}}{V_{B}}\ $ or, $n_{B}=n_{A}\ $ et $\ V_{B}=V_{A}+450\;ml$
Donc, $c_{B}=\dfrac{n_{A}}{V_{A}+450}\ $ avec, $n_{A}=c_{A}\times V_{A}$
Ainsi, $c_{B}=\dfrac{c_{A}V_{A}}{V_{A}+450}$
A.N : $c_{B}=\dfrac{0.1\times 50\;10^{-3}}{50\;10^{-3}+450\;10^{-3}}=0.01$
Donc, $\boxed{c_{B}=0.01\;mol\cdot l^{-1}}$
2) Molarité de la solution $C$
On a : $c_{C}=\dfrac{n_{C}}{V_{C}}\ $ or, $n_{C}=n_{B}\ $ et $\ V_{C}=10V_{B}$
Donc, $c_{C}=\dfrac{n_{B}}{10V_{B}}\ $ or, on sait que $\dfrac{n_{B}}{V_{B}}=c_{B}$
Ainsi, $c_{C}=\dfrac{c_{B}}{10}$
A.N : $c_{C}=\dfrac{0.01}{10}=0.001$
Donc, $\boxed{c_{C}=0.001\;mol\cdot l^{-1}}$
Exercice 8
1) La masse d'hydroxyde de sodium a-t-on utilisée
On a \begin{eqnarray} c=\dfrac{n}{V}\ \text{ or }\ n=\dfrac{m}{M}&\Rightarrow&c=\dfrac{m}{V\times M}\nonumber \\ &\Rightarrow&m=c\times V\times M\ \text{ avec }\ M_{NaOH}=23+16+1=40\nonumber \end{eqnarray}
A.N : $m=0.01\times 200\;10^{-3}\times 40=0.08$
Donc, $\boxed{m=0.08\;g}$
2) Trouvons la molarité de la solution diluée obtenue.
Soit $c'$ la concentration de la solution diluée
On a : $c'=\dfrac{n'}{V'}\ $ or, $n'=n$ et $V'=V+450$
Donc, $c'=\dfrac{n}{V+450}\ $ avec, $n=c\times V$
Ainsi, $c'=\dfrac{cV}{V+450}$
A.N : $c'=\dfrac{0.01\times 50}{50+450}=0.001$
Donc, $\boxed{c'=0.001\;mol\cdot l^{-1}}$
Exercice 9
1) Calculons la concentration molaire de cette solution d'acide chlorhydrique.
On a : $c=\dfrac{n}{V}\ $ or, $\ n=\dfrac{m}{M}$ donc, $c=\dfrac{m}{V\times M}$
De plus, comme $p=\dfrac{m}{m_{s}}\times 100$ alors, $m=\dfrac{p\times m_{s}}{100}$ avec, $m_{s}$ la masse du solide
Ainsi,
$\begin{array}{rcl} c&=&\dfrac{p\times m_{s}}{M\times V\times 100}\quad\text{ or, }\ m_{s}=\mu\times V\\ \\&=&\dfrac{p\times\mu\times V}{M\times V\times 100}\\ \\&=&\dfrac{p\times\mu}{M\times 100}\end{array}$
Donc, $\dfrac{p\times\mu}{M\times 100}$
A.N : $c=\dfrac{37\times 1190}{36.5\times 100}=12.063$
D'où, $\boxed{c=12.063\;mol.l^{-1}}$
2) Trouvons la concentration molaire de la solution diluée.
Soit $c'$ la concentration de la solution diluée
On a : $c'=\dfrac{n'}{V'}\ $ or, $n'=n$
Donc, $c'=\dfrac{n}{V'}\ $ avec, $n=c\times V$
Ainsi, $c'=\dfrac{cV}{V'}$
A.N : $c'=\dfrac{12.063\times 1}{500}=0.024$
Donc, $\boxed{c'=0.024\;mol.l^{-1}}$
Autre méthode
On prélève $1\;ml$ et on dilue pour obtenir $500\;ml$ de solution, alors on a dilué 500 fois le volume prélevé.
Donc, $c'=\dfrac{c}{500}=\dfrac{12.063}{500}=0.024\;mol.l^{-1}$
Exercice 10
1) Calculons la concentration massique de la solution $B$
Soit $c_{m}$ cette concentration massique, alors on a :
$c_{m}=\dfrac{m}{V}$
A.N : $c_{m}=\dfrac{60}{500\;10^{-3}}=120$
Donc, $\boxed{c_{m}=120\;g.l^{-1}}$
Déduisons sa concentration molaire.
On a : $c_{m}=\dfrac{m}{V}\ $ or, $\ m=n\times M$
Donc, $c_{m}=\dfrac{n\times M}{V}=\dfrac{n}{V}\times M$
Comme $\dfrac{n}{V}=c$ alors, $c_{m}=c\times M$
Par suite, $c=\dfrac{c_{m}}{M}$ avec, $M_{NaOH}=40\;g.mol^{-1}$
A.N : $c=\dfrac{120}{40}=3$
D'où, $\boxed{c=3\;mol.l^{-1}}$
2) On a obtenu cette solution $C$ par dilution.
Trouvons sa molarité.
On a : $c_{C}=\dfrac{n_{C}}{V_{C}}\ $ or, $n_{C}=n_{B}\ $ et $\ V_{C}=V_{B}+300$
Donc, $c_{C}=\dfrac{n_{B}}{V_{B}+300}$
Mais, comme $n_{B}=c_{B}\times V_{B}$ alors, on obtient :
$$c_{C}=\dfrac{c_{B}\times V_{B}}{V_{B}+300}$$
A.N : $c_{C}=\dfrac{3\times 500}{500+300}=1.875$
Ainsi, $\boxed{c_{C}=1.875\;mol.l^{-1}}$
Exercice 11
1) Trouvons la concentration molaire de cette eau salée.
On a : $c=\dfrac{n}{V}\ $ or, $n=\dfrac{m}{M}$
Par suite,
$\begin{array}{rcl} c&=&\dfrac{m}{V\times M}\quad\text{or, }\ \dfrac{m}{V}=c_{m}\\ \\ &=&\dfrac{c_{m}}{M}\quad\text{avec, }\ M_{NaCl}=23+35.5=58.5\;g.mol^{-1}\end{array}$
Ainsi, $c=\dfrac{c_{m}}{M}$
A.N : $c=\dfrac{23.25}{58.5}=0.397$
Donc, $\boxed{c=0.397\;mol.l^{-1}}$
2) Trouvons la concentration molaire de la nouvelle solution salée obtenue.
Soit $c'$ la nouvelle concentration et $V'$ le nouveau volume.
On a : $c'=\dfrac{n'}{V'}\ $ or, $n'=n\ $ et $\ V'=V-\dfrac{20}{100}V$
Donc,
$\begin{array}{rcl} c'&=&\dfrac{n}{V-\dfrac{20}{100}V}\\ \\&=&\dfrac{n}{V\left(1-\dfrac{20}{100}\right)}\\ \\&=&\dfrac{n}{V\left(\dfrac{100-20}{100}\right)}\\ \\&=&\dfrac{100n}{V\left(100-20\right)}\\ \\&=&\dfrac{100n}{80V}\quad\text{or, }\ n=c\times V\\ \\&=&\dfrac{100cV}{80V}\\ \\&=&\dfrac{100c}{80}\end{array}$
Ainsi, $c'=\dfrac{100\times c}{80}$
A.N : $c'=\dfrac{100\times 0.397}{80}=0.496$
D'où, $\boxed{c'=0.496\;mol.l^{-1}}$
Exercice 12
1) $C(mol.L^{-1})$ représente la concentration molaire.
$C_{m}(g.L^{-1})$ représente la concentration massique.
$M(g.mol^{-1})$ représente la masse molaire moléculaire.
2) Relation entre ces différentes grandeurs.
On a : $c=\dfrac{n}{V}\ $ or, $n=\dfrac{m}{M}$
Donc, $c=\dfrac{m}{V\times M}$ mais, comme $\dfrac{m}{V}=c_{m}$ alors,
$$\boxed{c=\dfrac{c_{m}}{M}}$$
3) Complétons le tableau
$$\begin{array}{|c|c|c|}\hline C(mol.L^{-1})&C_{m}(g.L^{-1})&M(g.mol^{-1}) \\ \hline 5&200&40 \\ \hline 0.547&20&36.5 \\ \hline\end{array}$$
Justification
$c=\dfrac{c_{m}}{M}\ \Rightarrow\ c_{m}=c\times M$
A.N : $c_{m}=5\times 40=200$
Donc, $\boxed{c_{m}=200\;g.l^{-1}}$
$c=\dfrac{c_{m}}{M}$
A.N : $c=\dfrac{20}{36.5}=0.547$
D'où, $\boxed{c=0.547\;mol.l^{-1}}$
Activité
Fatou veut préparer $50\;mL$ d'une solution aqueuse de saccharose de concentration massique $C_{m}=90\;g\cdot L^{-1}$ par dissolution de saccharose (sucre du commerce) de formule $C_{12}H_{22}O_{11}$
1) Calculons la masse de saccharose que Fatou doit peser.
On a : $C_{m}=\dfrac{m}{v}$
D'où, $m=C_{m}\times v$
A.N : $m=90\times50\cdot10^{-3}=4.5$
Ainsi, $\boxed{m=4.5\;g}$
2) Elle dispose du matériel suivant : balance de précision, cuillère, coupelle, entonnoir, fiole jaugée de $50\,mL$, pissette, eau.
Décrivons alors le mode opératoire pour préparer cette solution.
Poser la coupelle sur la balance de précision. Puis à l'aide de la cuillère, prendre du saccharose et déposé dans la coupelle jusqu'à ce que la balance indique $4.5\,g$. Mettre le saccharose pesé dans la fiole jaugée de $50\,ml$ à l'aide de l'entonnoir. A l'aide de la pissette, remplir la fiole avec de l'eau jusqu'au trait de jauge.
Exercice 13
Recopions et complétons les phrases avec les mots ou groupes de mots suivants :
solvant ; solution ; dissout ; masse ; concentration ; sucre ; saturée ; quantité de matière ; soluté ; eau.
1) La concentration molaire d'une solution est la quantité de matière de soluté par litre de solution.
2) La concentration massique d'une solution est la masse de soluté par litre de solution.
3) Une solution saturée est une solution pour laquelle le solvant ne peut plus dissoudre le soluté à une température donnée.
4) Le soluté est le corps qui se dissout dans la solution.
5) Dans une solution aqueuse de sucre, le soluté est sucre le solvant est eau.
6) Augmenter le volume du solvant d'une solution, c'est faire une dilution ; dans ce cas la concentration de la solution diminue.
Exercice 14
Choisissons la lettre correspondant à la bonne réponse.
La relation entre la concentration molaire $C$ et la concentration massique $Cm$ et la masse molaire $M$ est :
$\boxed{\text{a) }}\ \ C=\dfrac{C_{m}}{M}$
b) $C=\dfrac{M}{C_{m}}$
c) $C=C_{m}\times M$
Exercice 15
Une solution est obtenue en dissolvant une masse $m=14.2\;g$ de sulfate de sodium $\left(Na_{2}SO_{4}\right)$ dans de l'eau et en complétant le volume à $500\;ml.$
1) Calculons la concentration massique $C_{m}$ de cette solution :
Soit : $C_{m}=\dfrac{m}{V}$
A.N : $C_{m}=\dfrac{14.2}{500\cdot 10^{-3}}=28.4$
Donc, $\boxed{C_{m}=28.4\;g\cdot l^{-1}}$
2) Calculons de deux façons différentes la concentration molaire $C$ de cette solution.
$-\ \ 1^{\text{ère}}$ méthode
Soit : $C=\dfrac{n_{(Na_{2}SO_{4})}}{V}\ $ or, $n_{(Na_{2}SO_{4})}=\dfrac{m}{M_{(Na_{2}SO_{4})}}$
Donc, $n_{(Na_{2}SO_{4})}=\dfrac{\dfrac{m}{M_{(Na_{2}SO_{4})}}}{V}=\dfrac{m}{M_{(Na_{2}SO_{4})}\times V}\ $
avec,
$\begin{array}{rcl} M_{(Na_{2}SO_{4})}&=&2\times M_{(N_{a})}+M_{(S)}+4\times M_{(O)}\\ \\&=&2\times 23+32+4\times 16\\ \\&=&142\;g\cdot mol^{-1}\end{array}$
Par suite, $C=\dfrac{14.2}{142\times 500\cdot 10^{-3}}=0.2$
D'où, $\boxed{C=0.2\;mol\cdot l^{-1}}$
$-\ \ 2^{\text{ième}}$ méthode
On a : $C_{m}=C\times M_{(Na_{2}SO_{4})}$
Ce qui donne : $C=\dfrac{C_{m}}{M_{(Na_{2}SO_{4})}}$
A.N : $C=\dfrac{28.4}{142}=0.2$
Ainsi, $\boxed{C=0.2\;mol\cdot l^{-1}}$
Exercice 16
Dans un volume $V=500\;ml$ d'eau distillée, on dissout un volume $v_{(HCl)}=0.12\;L$ de chlorure d'hydrogène $HCl.$
1) Calculons la concentration molaire de la solution obtenue.
Soit : $C=\dfrac{n_{(HCl)}}{V}\ $ or, $n_{(HCl)}=\dfrac{v_{(HCl)}}{V_{m}}$
Par suite, $C=\dfrac{v}{V\times V_{m}}$
A.N : $C=\dfrac{0.12}{500\cdot 10^{-3}\times 24}=0.01$
Ainsi, $\boxed{C=0.01\;mol\cdot l^{-1}}$
2) La quantité de matière de chlorure d'hydrogène contenue dans un prélèvement de $20\;cm^{3}$ de cette solution est de :
$$n_{(HCl)}=C\times V'$$
où, $V'$ est le volume prélevé : $V'=20\;cm^{3}=20\cdot 10^{-3}\;L$
A.N : $n_{(HCl)}=0.01\times 20\cdot 10^{-3}=0.0002$
Donc, $\boxed{n_{(HCl)}= 0.0002\;mol}$
Exercice 17
Une solution est obtenue par dissolution de $24\;g$ d'un soluté dans $1.2\;L$ d'eau pure.
La dissolution se fait par ailleurs sans changement de volume.
1) Calculons la concentration massique de la solution
Soit : $C_{m}=\dfrac{m}{V}$
A.N : $C_{m}=\dfrac{24}{1.2}=20$
D'où, $\boxed{C_{m}=20\;g\cdot l^{-1}}$
2) En déduisons la masse molaire du soluté sachant que la concentration molaire volumique de la solution est $C=0.5\,mol\cdot l^{-1}$
$M$ est donnée par :
$$M=\dfrac{C_{m}}{C}$$
A.N : $M=\dfrac{20}{0.5}$
Ainsi, $\boxed{M=40\;g\cdot mol^{-1}}$
Exercice 18
Un élève a perdu les étiquettes de deux flacons d'eau salée.
Il sait seulement que l'eau se trouvant dans un des flacons est plus concentrée en sel (plus salée) que l'autre.
Identifions la solution la moins concentrée par un raisonnement rigoureux et scientifique :
Effet, nous savons que la température d'ébullition d'une solution est plus élevée d'autant que celle-ci est plus concentrée.
Dans notre cas, les deux solutions sont identiques en constituants.
Par conséquent, celle qui a la plus faible concentration se portera, en premier, à ébullition, pour une augmentation de température.
Exercice 19
On dispose d'une solution aqueuse $S$ de chlorure de sodium de concentration molaire $C=0.4\;mol\cdot l^{-1}.$
La réalisation de $50\;ml$ d'une solution $S_{1}$ est obtenue par dilution de $5.0\;ml$ de la solution $S$
1) Déterminons la concentration molaire de $S_{1}$
On a : $C_{1}=\dfrac{n_{1}}{V_{1}}\ $ or, $n_{1}=n$
Donc, $C_{1}=\dfrac{n}{V_{1}}$
Mais comme $n=C\times V_{\text{prélevé}}\ $ alors, $$C_{1}=\dfrac{C\times V_{\text{prélevé}}}{V_{1}}$$
A.N : $C_{1}=\dfrac{0.4\times 5\cdot 10^{-3}}{50\cdot 10^{-3}}=0.04$
Ainsi, $\boxed{C_{1}=0.04\;mol\cdot l^{-1}}$
2) Calculons le volume de $S$ qu'il faut diluer pour préparer $500\;ml$ de solution $S_{2}$ de concentration molaire $C_{2}=0.016\;mol\cdot l^{-1}$
Soit : $V=\dfrac{n}{C}\ $ or, $n=n_{2}=C_{2}\times V_{2}$
Par suite, $V=\dfrac{C_{2}\times V_{2}}{C}$
A.N : $V=\dfrac{0.016\times 0.5}{0.4}=0.02$
Donc, $\boxed{V=0.02\;l=20\;ml}$
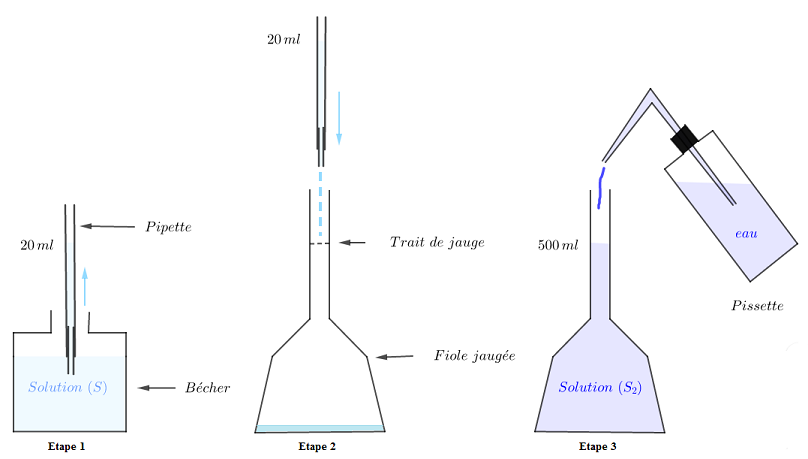
3) Décrivons les différentes étapes de la préparation de $S_{2}\ :$
Étape 1 : Prendre $20\;ml$ de la solution $S$ à l'aide d'une pipette.
Étape 2 : Verser dans une fiole jaugée de $500\;ml.$
Étape 3 : Compléter avec de l'eau jusqu'au trait de jauge à l'aide d'une pissette.

Exercice 20
Une solution $S_{1}$ est réalisée par dissolution de $0.3$ mole de chlorure de sodium solide dans $200\;mL$ d'eau.
On prélève à l'aide d'une pipette $10\;mL$ de la solution $S_{1}$ et on l'introduit dans une fiole de $250\;mL.$
En complétant avec de l'eau jusqu'au trait jauge de la fiole, on obtient une solution $S_{2}.$
1) Calculons la concentration molaire $C_{2}$ de cette nouvelle solution.
Soit : $C_{2}=\dfrac{n_{2}}{V_{2}}\ $ avec, $n_{2}=n_{\text{prélevé}}$
On a : $n_{\text{prélevé}}=C_{1}\times V_{\text{prélevé}}\ $ or, $C_{1}=\dfrac{n_{1}}{V_{1}}$
Donc, en remplaçant étape par étape chaque expression, on obtient :
$\begin{array}{rcl} C_{2}&=&\dfrac{n_{2}}{V_{2}}\\ \\&=&\dfrac{n_{\text{prélevé}}}{V_{2}}\\ \\&=&\dfrac{C_{1}\times V_{\text{prélevé}}}{V_{2}}\\ \\&=&\dfrac{\dfrac{n_{1}}{V_{1}}\times V_{\text{prélevé}}}{V_{2}}\\ \\&=&\dfrac{\dfrac{n_{1}\times V_{\text{prélevé}}}{V_{1}}}{V_{2}}\\ \\&=&\dfrac{n_{1}\times V_{\text{prélevé}}}{V_{1}\times V_{2}}\end{array}$
Ainsi, $$C_{2}=\dfrac{n_{1}\times V_{\text{prélevé}}}{V_{1}\times V_{2}}$$
A.N : $C_{2}=\dfrac{0.3\times 10\cdot 10^{-3}}{200\cdot 10^{-3}\times 250\cdot 10^{-3}}$
D'où, $\boxed{C_{2}=0.06\;mol\cdot l^{-1}}$
2) Calculons le volume d'eau ajouté
$V_{\text{ajouté}}=V_{2}-V_{\text{prélevé}}$
A.N : $V_{aj}=250-10=240$
Ainsi, $\boxed{V_{\text{ajouté}}=240\;mL}$

Commentaires
Babacar diouf (non vérifié)
mar, 05/21/2019 - 18:39
Permalien
Vive le timonier
LO (non vérifié)
ven, 05/08/2020 - 14:51
Permalien
vive le timonier
diouf (non vérifié)
mer, 10/02/2019 - 18:53
Permalien
telechargement
diouf (non vérifié)
mer, 10/02/2019 - 18:55
Permalien
Tres interessant
Anonyme (non vérifié)
lun, 02/01/2021 - 13:05
Permalien
comment on telecharger les
Mamadou Baldé (non vérifié)
mer, 11/06/2019 - 18:04
Permalien
Bfem “rekk”
bamba (non vérifié)
lun, 11/11/2019 - 18:53
Permalien
ndiayer
Fatou gueye (non vérifié)
ven, 11/15/2019 - 21:58
Permalien
Bfem
Anonyme (non vérifié)
lun, 12/09/2019 - 21:44
Permalien
Les autres exercises
Babacar DIOUF (non vérifié)
mer, 01/01/2020 - 21:54
Permalien
REUSSIRE LE BFEM
Babacar DIOUF (non vérifié)
mer, 01/01/2020 - 21:54
Permalien
REUSSIRE LE BFEM
Babacar DIOUF (non vérifié)
mer, 01/01/2020 - 21:54
Permalien
REUSSIRE LE BFEM
Anonyme (non vérifié)
ven, 08/14/2020 - 01:47
Permalien
Excellent
Moustapha Seydi (non vérifié)
mer, 02/17/2021 - 04:47
Permalien
Réussir
Ibrahima (non vérifié)
ven, 04/09/2021 - 21:50
Permalien
Réussir
Anonyme (non vérifié)
mar, 06/22/2021 - 12:15
Permalien
Je besoin de fair un exerce
Aaaaa (non vérifié)
mar, 10/25/2022 - 21:20
Permalien
Solution aqueuse
Aaaaa (non vérifié)
mar, 10/25/2022 - 21:20
Permalien
Solution aqueuse
Aaaaa (non vérifié)
mar, 10/25/2022 - 21:20
Permalien
Solution aqueuse
Anonyme (non vérifié)
lun, 12/20/2021 - 20:56
Permalien
C intéressant
Kn (non vérifié)
lun, 12/20/2021 - 21:03
Permalien
Cool
Mayé (non vérifié)
dim, 12/04/2022 - 12:09
Permalien
Élèves
Loumeyma (non vérifié)
ven, 07/07/2023 - 11:38
Permalien
Remerciement
Ameth Ndour (non vérifié)
dim, 11/26/2023 - 12:11
Permalien
Exercice numéro 7et8
Anonyme (non vérifié)
mer, 12/06/2023 - 22:19
Permalien
Merci beaucoup pour les
BFEM « ri incha... (non vérifié)
jeu, 12/07/2023 - 21:57
Permalien
Je suis content de vous de
Gora Wade (non vérifié)
mar, 01/16/2024 - 18:09
Permalien
Pour être un élève parfait en sciences
Ajouter un commentaire