Une solution acide fait virer $\ldots\ldots$ au jaune. Le $BBT$ reste $\ldots\ldots$ dans une solution neutre. Le vert est la $\ldots\ldots\ldots$ du $BBT$. Une solution est $\ldots\ldots$ quand elle fait virer le $BBT$ au bleu.
Dans une réaction acido-basique, l'élévation de la $\ldots\ldots$ notée par le thermomètre montre que la réaction est $\ldots\ldots$.La réaction entre un $\ldots\ldots$. et une base donne du $\ldots\ldots$ et de l'eau. La $\ldots\ldots\ldots$ permet d'obtenir une solution neutre ; elle se produit quand le $\ldots\ldots$ de moles de base est $\ldots\ldots$ à celui de l'acide. A ce moment précis, l'indicateur coloré $\ldots\ldots$ de coloration, le $\ldots\ldots$ est atteint. Le dosage ou titrage d'une solution est la détermination de la $\ldots\ldots$ (titre) inconnue d'une solution à partir de celle (titre) $\ldots\ldots$ d'une autre solution : c'est une application de la $\ldots\ldots$. Dans un dosage, la $\ldots\ldots\ldots$ est dans la burette ; sa concentration est $\ldots\ldots$ alors que la solution $\ldots\ldots$ dont la concentration est inconnue est dans le bécher.
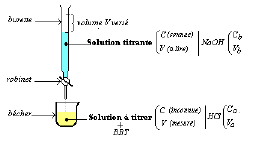
Au laboratoire, on dose souvent une solution acide (ou basique) par une solution basique (ou acide) en présence d'un indicateur coloré.
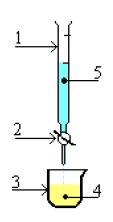
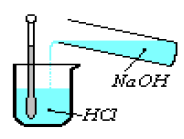
le schéma ci-dessous est celui d'un montage expérimental.
2) Compléter le tableau expérimental joint.
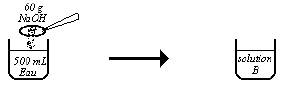
Quelle masse d'hydroxyde de sodium $NaOH$ faut-il dissoudre dans $500\;mL$ d'une solution d'acide chlorhydrique décimolaire pour la neutraliser.
Pour doser une solution d'acide chlorhydrique, $30\;mL$ de soude de concentration $0.25\;mol/L$ ont été versés pour neutraliser $20\;cm^{3}$ de cet acide.
1) Faites le schéma annoté de l'expérience.
2) Trouver la concentration molaire de l'acide et en déduire sa concentration massique.
3) Calculer la masse de sel et d'eau produit par ce dosage.
Une solution de soude de concentration inconnue est dosée par une solution d'acide chlorhydrique de concentration $0.10\;molL^{-1}$. Pour une prise d'essai de $10.0\;cm^{3}$ de la solution basique, il faut verser $8.2\;cm^{3}$ de la solution d'acide pour le virage du $BBT$. Trouver la concentration de la solution de soude en $mol/L$ et en $g/L$..
Dans un bécher, on met $100\;mL$ d'eau pure dans lesquelles on dissout $2\;g$ d'hydroxyde de sodium $NaOH$.
1) Calculer la molarité de la solution obtenue.
2) Cette solution basique est neutralisée exactement par $50\;mL$ d'acide chlorhydrique.
2-1) Trouver la masse de chacun des produits obtenus.
2-2) Quelle était la concentration molaire de cette solution acide.
Un bécher contient $30\;mL$ d'une solution d'hydroxyde de sodium de concentration molaire $C_{B}$. On y ajoute quelques gouttes de bleu de bromothymol $(B.B.T.)$. Cette solution est dosée par une solution d'acide chlorhydrique de concentration $C_{A}=1.5\;mol\cdot L^{-1}$. On obtient le point d'équivalence après avoir versé $20\;mL$ de la solution acide dans le bécher. Calculer :
1) La concentration massique de la solution acide.
2) La concentration molaire $C_{B}$ de la solution basique.
3) On ajoute $10\;mL$ d'acide dans le bécher. La nouvelle solution vire au jaune.
3-2) Calculer sa concentration molaire.
Activité
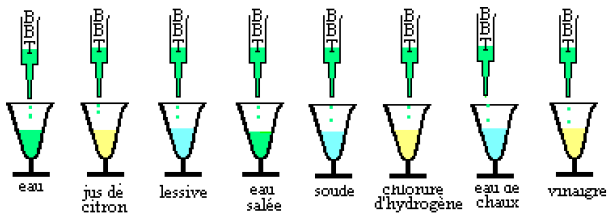
1) On verse une goutte de $BBT$ dans chacune des solutions et on note la teinte correspondante (voir tableau ci-dessous)
Compléter le tableau en précisant la nature acide, basique ou neutre de chaque solution.
$$\begin{array}{|c|c|c|} \hline \text{Solution}&\text{Teinte}&\text{Nature}\\ \hline \text{Jus d'orange}&\text{Jaune}&\\ \hline \text{Eau pure}&\text{Verte}&\\ \hline \text{Eau savonneuse}&\text{Bleue}&\\ \hline \text{Jus de tomate}&\text{Jaune}&\\ \hline \text{Jus de pamplemousse}&\text{Jaune}&\\ \hline \text{Eau de mer}&\text{Bleue}&\\ \hline \text{Lait}&\text{Jaune}&\\ \hline \text{Solution de cendre}&\text{Bleue}&\\ \hline \end{array}$$
2) Schématiser un montage électrique qui permet de tester le caractère conducteur d'une solution acide ou d'une solution basique.
Exercice 9 Maitrise de connaissances
Recopier et compléter le texte suivant en ajoutant les mots ou groupe de mots manquants.
Une solution acide donne une coloration ............ en présence de $BBT$, tandis qu'une solution basique donnera une coloration ...............
Une solution dans laquelle le $BBT$ vire au vert est ...............
Une solution d'acide contient toujours des ions ............, tandis qu'une solution basique contient toujours des ions ...............
Exercice 10 Recherche de la nature d'un sol
L'acidité du sol joue un rôle important dans l'agriculture.
Propose une méthode expérimentale permettant de vérifier le caractère acide ou basique d'un sol.
Exercice 11 Nature d'une solution
Après avoir préparé diverses solutions, on verse dans chacune d'elles quelques gouttes de $BBT.$
1) Rappelle la couleur de cet indicateur en milieu acide, basique et neutre.
2) Recopie et remplis le tableau ci-dessous.
$$\begin{array}{|c|c|c|} \hline \text{Solution}&\text{Teinte}&\text{Nature}\\ \hline \text{Jus de tamarin}&\text{Jaune}&\\ \hline \text{Liquide vaisselle}&\text{bleu}&\\ \hline \text{Jus de citron}&\text{jaune}&\\ \hline \text{vinaigre}&\text{Jaune}&\\ \hline \text{Eau de mer}&\text{bleu}&\\ \hline \text{Chlorure de sodium}&\text{verte}&\\ \hline \end{array}$$
Exercice 12 Mélange d'un acide et d'une base
On mélange un volume $V_{a}=25\,cm^{3}$ de solution d'acide chlorhydrique de concentration $C_{a}=10^{-1}mol\cdot L^{-1}$ et un volume $V_{b}=20\,cm^{3}$ d'une solution d'hydroxyde de sodium de concentration $C_{b}=1.5\cdot 10^{-1}mol\cdot L^{-1}.$
1) Le mélange est-il acide ou basique ?
Justifier.
2) Quel volume d'acide ou de base faut-il ajouter pour neutraliser la solution ?
Exercice 13 Dosage
Un laborantin dispose d'une solution d'acide chlorhydrique de concentration molaire $C_{a}$ inconnue.
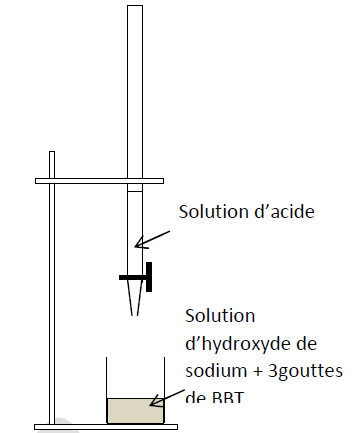
Il prélève un volume $V_{a}=10\,mL$ de la solution d'acide qu'il met dans un bécher contenant quelques gouttes de bleu de bromothymol $(BBT).$
A l'aide d'une burette il dose l'acide par une solution d'hydroxyde de sodium de concentration molaire $C_{b}=0.05\,mol\cdot L^{-1}.$
Le volume de base versé à l'équivalence est $V_{b}=20\,mL.$
1) Donne le schéma annoté du dispositif expérimental
2) Écris l'équation globale de la réaction de dosage.
3) Quelle est la couleur prise par le $BBT$ à l'équivalence ?
Justifier
4) Déterminer la concentration $C_{a}$ de la solution d'acide
5) Quelle couleur prendrait la solution si l'on continuait à verser la soude.
Justifier
Exercice 14 Extrait d'un compte rendu de TP (d'après le guide d'exercices de la DEMSG)
Dosage de l'acide chlorhydrique par de la soude de concentration $C_{b}=0.10\,mol\cdot L^{-1}.$
$-\ \ $ Volume de soude dans le bécher : $V_{b}=20\,mL.$
$-\ \ $ Volume d'acide versé pour atteindre l'équivalence : $V_{a}=10\,mL$
On en déduit la concentration $C_{a}$ de l'acide chlorhydrique :
$\dfrac{C_{a}}{V_{a}}=\dfrac{C_{b}}{V_{b}}\Rightarrow\,C_{a}=\dfrac{V_{a}\times C_{b}}{V_{b}}=\boxed{\dfrac{(10\times 0.010)}{20}}$
Rectifie les erreurs de cet élève de $3^{ième}.$
Exercice 15 Test
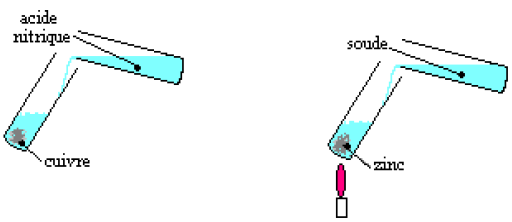
Lors d'une séance de travaux pratiques, un groupe d'élèves, a préparé dans des erlenmeyers $30\,mL$ de solution d'hydroxyde de sodium, $30\,mL$ d'acide chlorhydrique et $30\,mL$ de chlorure de sodium ayant chacune une concentration de $1\,mol\cdot L^{-1}.$
Ces élèves se trouvent ensuite dans l'impossibilité de distinguer les trois solutions.
1) Quel(s) test(s) peuvent-ils effectuer pour les reconnaitre ?
2) Quel conseil leur donneriez-vous pour éviter à l'avenir une telle mésaventure ?
Exercice 16 Dosage
On donne les masses molaires atomiques en $g\cdot mol^{-1}$
$M(C)=12$ ; $M(H)=1$ ; $M(O)=16$ ; $M(Na)=23$
On prélève $100\,mL$ de solution d'hydroxyde de sodium ou soude $\left(Na^{+}+OH^{-}\right)$ de concentration molaire $0.5\,mol\cdot L^{-1}$
1) Calcule la quantité de matière de soluté $NaOH$ dissoute dans cette solution.
2) Calcule la concentration massique de cette solution de soude.
3) Cette solution est utilisée pour doser une solution d'acide chlorhydrique $\left(H^{+}+Cl^{-}\right)$ de volume $10\,mL.$
a) Écris l'équation bilan de la réaction de dosage.
b) Sachant qu'il a fallu $15\,mL$ de la solution de base pour atteindre l'équivalence, calcule la concentration molaire de l'acide chlorhydrique.
Exercice 17
Pour préparer une solution $S$ d'hydroxyde de sodium $\left(Na^{+}+OH^{-}\right)$ de concentration $C_{b}=5\cdot10^{-2}mol\cdot L^{-1}$, on pèse une masse $m$ d'hydroxyde de sodium que l'on fait dissoudre dans un volume $V=1200\,mL$ d'eau pure.
On considère que la dissolution a lieu sans variation de volume.
1) Calculer la concentration massique de la solution $S.$
En déduire la valeur de la masse $m$
2) On répartit la solution $S$ en trois parties $A$, $B$ et $C$ de volumes $V_{A}=400\,mL$, $V_{B}=300\,mL$ et $V_{C}=500\,mL.$
a) Déterminer la quantité de matière d'hydroxyde de sodium présente dans chaque partie.
b) Dans chaque partie, on ajoute $200\,mL$ d'une solution d'acide chlorhydrique de concentration $1\cdot10^{-2}mol\cdot L^{-1}.$
Indiquer le caractère acide, basique ou neutre de ces solutions.
On donne :
Les masses molaires atomiques : $C=12\,g\cdot mol^{-1}$ ; $H=1\,g\cdot mol^{-1}$ ; $O=16\,g\cdot mol^{-1}$ ; $Na=23\,g\cdot mol^{-1}$
Exercice supplémentaire La pollution par ces pluies, créée par l'homme......
Les pluies acides sont dues à la dissolution dans les gouttes d'eau :
$-\ \ $ du dioxyde de soufre provenant de la combustion du pétrole et du charbon ;
$-\ \ $ des oxydes d'azote rejetés essentiellement par les gaz d'échappement des automobiles ;
$-\ \ $ du chlorure d'hydrogène produit lors de l'incinération des emballages en $PVC.$
1) Les pluies acides attaquent les arbres qui perdent leurs feuilles, augmentent l'acidité des eaux des lacs, détériorent les bâtiments en endommageant les pierres calcaires.
a) Identifie les gaz responsables des pluies acides.
b) Indique le test qu'on effectue pour confirmer le caractère acide de ces pluies.
c) Identifie, parmi ces gaz, celui qui permet d'avoir une solution d'acide chlorhydrique.
d) Écris l'équation-bilan traduisant la réaction qui se produit entre l'acide chlorhydrique $\left(H^{+}+Cl^{-}\right)$ et le calcaire $\left(CaCO_{3}\right)$ sachant qu'il se forme du chlorure de calcium $\left(Ca^{2+}+2Cl^{-}\right)$ ; de l'eau $(H_{2}O)$ et du dioxyde de carbone $(CO2).$
2) Lorsque l'eau d'un lac devient trop acide, on y déverse le calcaire pour réduire les effets des pluies acides.
A l'aide de la réaction précédente (question 4), explique l'épandage du calcaire sur l'eau des lacs pour limiter les effets des pluies acides.




 dans un solvant.
dans un solvant.
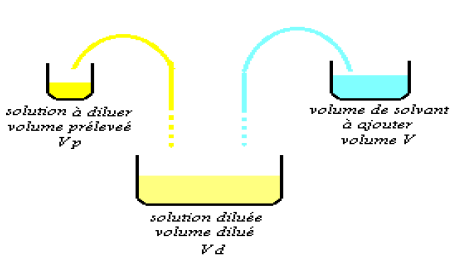 diminue alors sa concentration.
diminue alors sa concentration.