Bac Physique Chimie 1er Groupe S1 S3 2015
Exercice 1 (03 points)
Le péroxyde d'hydrogène $H_{2}O_{2}$ connu sous le nom d'eau oxygénée est un agent de blanchiment et de désinfection dans l'industrie pharmaceutique.
En solution aqueuse, l'eau oxygénée se décompose lentement suivant la réaction totale d'équation :
$$H_{2}O_{2}\quad\rightarrow\quad H_{2}O\quad+\quad\dfrac{1}{2}O_{2}(g)$$
Pour étudier la cinétique de cette réaction, on effectue sur une solution de péroxyde d'hydrogène des prélèvements de volume $V_{0}=10\;mL$ échelonnés dans le temps et on dose immédiatement l'eau oxygénée restant à l'aide d'une solution acidifiée de permanganate de potassium $\left(K^{+}+MnO_{4}^{-}\right)$ de concentration $C_{1}=2.0\cdot10^{-2}mol\cdot L^{-1}.$
On désigne par $C$ la concentration molaire volumique en $H_{2}O_{2}$ à un instant $t$ et $C_{0}$ sa concentration initiale...
1.1 La réaction support du dosage est :
$2MnO_{4}^{-}+6H_{3}O^{+}+5H_{2}O_{2}\rightarrow 5O_{2}+2Mn^{2+}+14H_{2}O.$
Montrer que la concentration $C$ en $H_{2}O_{2}$ à un instant $t$ et le volume $V_{1}$ de la solution de permanganate de potassium versé à l'équivalence sont liés par : $(0.75\;pt)$
1.2 Le graphe ci-dessous donne les valeurs du volume $V_{1}$ de la solution de permanganate de potassium versé à différentes dates pour atteindre l'équivalence (figure 1).
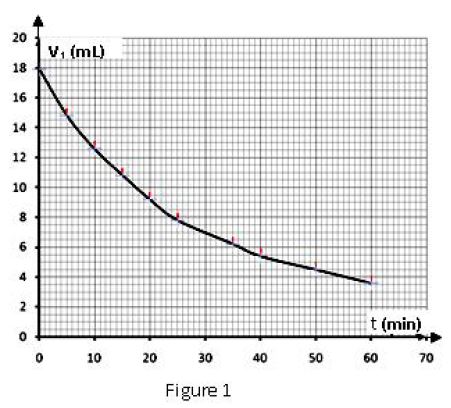
1.2.1 Définir la vitesse volumique de disparition $v(t)$ de l'eau oxygénée à l'instant $t$ puis l'exprimer en fonction de $V_{0}$, $V_{1}$ et $C_{1}.$ $(0.5\;pt)$
1.2.2 Déterminer, à l'aide de l'expression établie à la question précédente et du graphe, la vitesse de disparition de l'eau oxygénée aux instants $t_{0}=0$ et $t_{1}=25s.$
Justifier le sens de l'évolution de cette vitesse. $(0.75\;pt)$
1.2.3 On admet que la vitesse $v(t)$ est de la forme $v(t)=k\cdot C(t)$, relation où $k$ est une constante positive.
Montrer que la concentration en péroxyde d'hydrogène varie en fonction du temps selon l'expression :
$C(t)=C_{0}\cdot\mathrm{e^{-kt}}$ $(0.25\;pt)$
1.2.4 Déduire de la courbe la valeur de la constante $k.$ $(0.25\;pt)$
1.2.5 Déterminer le temps de demi-réaction $t_{\frac{1}{2}}$ de la décomposition du péroxyde d'hydrogène $(0.5\;pt)$
NB :
le graphe n'est pas à rendre avec la feuille de copie ; toutefois on expliquera succinctement l'exploitation qui en est faite pour répondre aux questions.
Exercice 2 (03 points)
La tyrosine est l'un des composés organiques participant à la biosynthèse des protéines.
Elle intervient dans la synthèse de la mélanine, le pigment naturel de la peau et des cheveux.
Elle est considérée comme un antioxydant et a aussi une action sur la dépression ou l'anxiété.
Dans ce qui suit, on se propose de retrouver la formule brute de la tyrosine que l'on peut noter $C_{x}H_{y}O_{z}N_{t}$ et d'étudier quelques unes de ses propriétés chimiques.
2.1 La combustion de $648\;mg$ de tyrosine donne $1.42\;g$ de dioxyde de carbone et $354\;mg$ d'eau.
On suppose que l'hydrogène du composé est complètement oxydé en eau et le carbone en dioxyde de carbone.
A partir des résultats de cette combustion, calculer les pourcentages massiques de carbone et d'hydrogène dans la tyrosine.
En déduire la formule brute de la tyrosine sachant que sa molécule contient un seul atome d'azote et que sa masse molaire est de $181\;g\cdot mol^{-1}$ $(0.5\;pt).$
2.2 La formule semi-développée de la tyrosine est écrite ci-dessous :
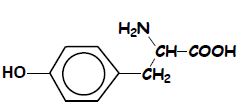
Recopier la formule et encadrer le groupe fonctionnel caractéristique des acides $\alpha$aminés présent dans la molécule de tyrosine. $(0.5\;pt).$
2.3 Dans la suite, on adopte pour la formule semi-développée de la tyrosine l'écriture simplifiée $\mathcal{R}-CH_{2}-CHNH_{2}-COOH$ et on suppose que le groupement $\mathcal{R}$ ne participe à aucune réaction.
2.3.1 Montrer que la molécule de tyrosine est chirale puis donner les représentations de Fischer des configurations $L$ et $D$ de la tyrosine. $(0.75\;pt).$
2.3.2 En solution aqueuse, la tyrosine existe sous la forme d'un amphion.
Écrire la formule semi-développée de l'amphion et indiquer les couples acide/base qui lui correspondent. $(0.25\;pt).$
2.3.3 En solution aqueuse, il existe une valeur de $pH$ appelé $pH$ du point isoélectrique, notée $pH_{i}$, pour laquelle la concentration de l'amphion est maximale.
Les $pk_{a}$ des couples acide/base associés à l'amphion ont les valeurs $pK_{a1}=2.2$ et $pk_{a2}=9.1.$
Établir la relation entre $pH_{i}$, $pK_{a1}$ et $pk_{a2}.$
En déduire la valeur de $pH_{i}$ pour la tyrosine. $(01\;pt).$
On donne les masses molaires en $g\cdot mol^{-1}$ : $M(O)=16$ ; $M(N)=14$ ; $M(C)=12$ ; $M(H)=1$
Exercice 3 (04 points)
3.1 Un canon lance un projectile de masse $m$, supposé ponctuel, avec une vitesse initiale $\overrightarrow{v_{0}}$ faisant un angle $\alpha$ avec l'horizontale à partir d'un point $M_{0}$ situé à la hauteur $H$ au-dessus du niveau de la mer.
Le mouvement du projectile est étudié dans le repère $(OX\;,\ OY)$ de plan vertical, d'origine O et de vecteurs unitaires $\vec{i}$ et $\vec{j}$ (figure 2 ).
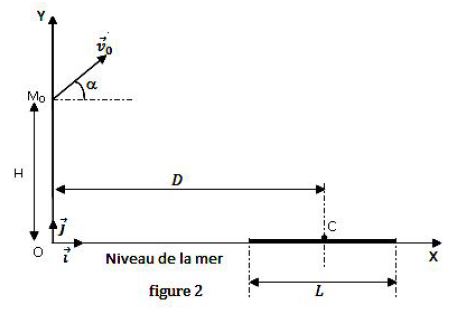
L'axe horizontal $OX$ est pris sur le niveau de la mer.
Dans toute la suite on néglige l'action de l'air.
3.1.1 Faire le bilan des forces appliquées au projectile puis déterminer les composantes de l'accélération du mouvement. $(0.5\;pt)$
3.1.2 En déduire les composantes du vecteur vitesse $\overrightarrow{v}$ du projectile et celles du vecteur position $\overrightarrow{OM}$ à chaque instant en fonction $v_{0}$ , $g$ et $H.$ $(0.5\;pt)$
3.1.3 Le projectile tombe en un point $C$ centre d'un bateau tel que $OC=D.$
a) Trouver l'expression du temps de vol $t_{1}$ mis par le projectile pour atteindre le point $C$ en fonction de $D$, $v_{0}$ et $\alpha.$ $(0.25\;pt)$
b) Donner, en fonction de $\alpha$, $g$, $H$ et $D$, l'expression de $v_{0}$ pour qu'il tombe effectivement au point $C.$
Faire l'application numérique. $(0.25\;pt)$
c) Établir l'expression de la hauteur maximale $h_{m}$ atteinte par le projectile par rapport au niveau de la mer en fonction de $D$, $H$ et $\alpha.$ $(0.5\;pt)$
3.2 Le projectile est maintenant lancé à partir du point $O$ origine du repère avec un vecteur-vitesse $\overrightarrow{v'_{0}}$.
Le bateau a une longueur $L$ et de même direction que $OX.$
Le projectile tombe à une distance $d_{1}=\dfrac{L}{2}$ en deçà de la cible $C$ quand le vecteur vitesse $\overrightarrow{v'_{0}}$, fait un angle $\alpha_{2}$ avec l'horizontale.
Il tombe à une distance $d_{2}=\dfrac{L}{2}$ au-delà de la cible $C$ quand $\overrightarrow{v'_{0}}$ fait un angle $\alpha_{2}$ avec l'horizontale.
Le bateau est supposé immobile pendant toute la durée des tirs.
3.2.1 Exprimer la distance $d_{1}$ puis $d_{2}$ en fonction de $D$, $g$, $v'_{0}$ et l'angle de tir $(\alpha_{1}$ ou $\alpha_{2}$). $(0.75\;pt)$
3.2.2 En déduire la relation $$D=\dfrac{v'^{2}_{0}\left(\sin 2\alpha_{1}+\sin 2\alpha_{2}\right)}{2g}$$
3.2.3 Déterminer en fonction de $\alpha_{1}$ et $\alpha_{2}$ l'angle $\theta$ pour que le projectile atteigne la cible puis calculer sa valeur. $(0.75\;pt)$
On donne :
$g=10\;m\cdot s^{-2}$; $H=80\;m$ ; $D=1km$ et $\alpha=30^{\circ}$ ; $\alpha_{1}=30^{\circ}$ et $\alpha_{2}=45^{\circ}$
NB :
Il n'est pas demandé de rendre la figure 2 avec la feuille de copie.
Exercice 4 (06 points)
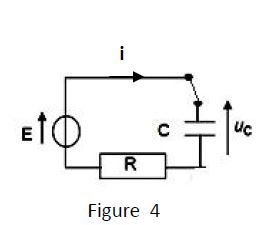
Afin de protéger la porte de sa chambre un passionné d'électronique astucieux a imaginé le dispositif d'alarme représenté par le schéma ci-dessous (figure 3).
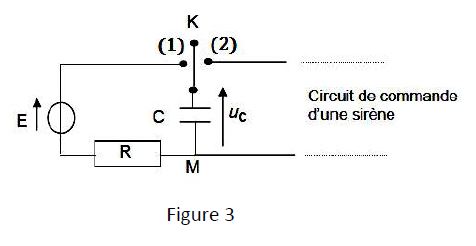
Lorsque la porte est fermée, l'interrupteur $K$ est en position $(1)$, le condensateur de capacité $C$ se charge.
Dès l'ouverture de la porte, l'interrupteur bascule en position $(2)$ et le condensateur se décharge dans le circuit de commande de la sirène.
La particularité du condensateur est qu'il ne peut pas se vider complètement :
il présente une tension à vide $U_{0}=3V.$
4.1 Étude du circuit de charge.
Le circuit de charge du condensateur est constitué d'une alimentation assimilable à un générateur de $f\cdot e\cdot m$ $E=18V$, de résistance négligeable, d'un résistor de résistance $R=47k\Omega$ et du condensateur de capacité $C.$
L'interrupteur $K$ bascule en position $(1)$ à l'instant $t=0$ de la fermeture de la porte.
4.1.1 Établir l'expression de l'intensité $i(t)$ du courant parcourant ce circuit de charge, en fonction de la tension $u_{c}(t)$ aux bornes du condensateur ; le sens arbitraire du courant est choisi comme indiqué sur la figure 4. $(0.25\;pt)$
4.1.2 Montrer que l'équation différentielle vérifiée par la tension $u_{c}(t)$ aux bornes du condensateur est de la forme :
$$\dfrac{\mathrm{d}u_{c}}{\mathrm{d}t}+\dfrac{u_{c}}{R\cdot C}=\dfrac{E}{R\cdot C}\qquad(0.5\;pt)$$
4.1.3 La solution de l'équation différentielle est de la forme :
$u_{c}(t)A\mathrm{e^{-\alpha t}}+B$
Préciser l'expression de chacune des constantes $A$, $B$ et $\alpha$ en fonction des caractéristiques des composants du circuit en tenant compte des conditions aux limites $u_{c}(0)=U_{0}$ et $u_{c}(\infty)=E.$ $(0.5\;pt)$
4.1.4 Quelles sont les valeurs de l'intensité du courant $i(t)$ et de la tension $u_{c}(t)$ en régime permanent ? $(0.5\;pt)$
4.1.5 Quelle est la valeur de la capacité $C$ du condensateur qui permet d'avoir une tension $u_{c}$ égale aux trois quarts de sa valeur en régime permanent en $0.20s$ ? $(0.25\;pt)$
4.2 Déclenchement de la sirène, le condensateur étant chargé.
4.2.1 On modélisera simplement le circuit de commande de la sirène par un résistor de résistance $R_{1}=4.70M\Omega$ et on prendra $C=3.5\mu F.$
A la fin de la charge, l'interrupteur $K$ a basculé en position $(2)$, à un instant pris comme nouvelle origine des temps $t=0.$
4.2.1.1 Représenter le schéma du circuit et indiquer par une flèche la tension $u_{c}(t)$ aux bornes du condensateur de manière à ce qu'elle soit positive. $(0.5\;pt)$
4.2.1.2 Établir l'équation différentielle vérifiée par la tension $u_{c}(t).$ $(0.5\;pt)$
4.2.1.3 Montrer que l'expression $u_{c}(t)=A'\mathrm{e^{-\alpha't}}+B'$ est solution de l'équation différentielle.
Préciser les expressions de $A'$, $B'$ et $\alpha'.$ $(0.75\;pt)$
4.2.1.4 La sirène ne se déclenche que si la tension aux bornes de son circuit de commande est supérieure à $U_{min}=9V.$
Pendant combien de temps après l'ouverture de la porte, fonctionnera la sirène ? $(0.5\;pt)$
4.2.2 Le circuit de commande de la sirène est maintenant remplacé par un dipôle constitué d'une bobine d'inductance $L=10mH$ de résistance négligeable et d'un résistor de résistance $R_{d}$, montés en série (figure 5).
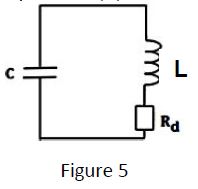
A la fin de la charge, comme en 4.2.1, on bascule l'interrupteur en position $(2)$ à un instant pris comme origine des temps $t=0.$
On désigne par $u_{c}(t)$ la tension aux bornes du condensateur à chaque instant $t.$
4.2.2.1 On suppose, dans un premier temps, la résistance $R_{d}$ négligeable et $u_{c}(0)=E.$
Établir l'équation différentielle relative à $u_{c}(t)$ puis montrer que
$u_{c}(t)=k\cos\left(\dfrac{2\pi}{T_{0}}t+\varphi\right)$ est solution de cette équation différentielle où $K$, $T_{0}$ et $\varphi$ sont des constantes à préciser. $(0.75\;pt)$
4.2.2.2 On considère cette fois-ci que la résistance $R_{d}=500\Omega$ et $u_{c}(0)=E.$
a) Montrer que l'équation différentielle à laquelle obéit $u_{c}(t)$ peut se mettre sous la forme
$$\dfrac{\mathrm{d}u_{c}(t)}{\mathrm{d}t}+2\delta\cdot\dfrac{\mathrm{d}u_{c}(t)}{\mathrm{d}t}+\dfrac{4\pi^{2}\cdot u_{c}(t)}{T_{0}^{2}}=0\text{ avec }\sigma\text{ une constante à préciser}.\qquad(0.5\;pt)$$
b) Si le discriminant réduit de cette équation différentielle est négative, on parle de régime pseudopériodique et la pseudo-période $T$ peut s'exprimer comme suit :
$T=\dfrac{2\pi}{\sqrt{\dfrac{1}{LC}-\dfrac{R^{2}_{d}}{4L}}}$
Calculer $T$ puis la comparer à $T_{0}.$ $(0.5\;pt)$
Exercice 5 (04 points)
5.1 Pour interpréter les spectres d'émission et d'absorption de l'atome d'hydrogène, Bohr a proposé l'existence dans l'atome d'hydrogène de niveaux d'énergie exprimés par la relation :
$E_{n}=\dfrac{E_{0}}{n^{2}}$ où $n$ est entier naturel positif et $E_{0}=13.6eV.$
Les radiations émises ou absorbées par l'hydrogène sont dues aux transitions d'un niveau d'énergie à un autre.
5.1.1 Montrer que la longueur d'onde $\lambda$ d'une radiation correspondant à une transition électronique d'un niveau $n$ à un niveau inférieur $p$ est donnée par la relation
$\dfrac{1}{\lambda}=R_{H}\left(\dfrac{1}{p^{2}}-\dfrac{1}{n^{2}}\right)$ où $R_{H}$ est une constante dont on précisera l'expression. $(0.5\;pt)$
5.1.2 $R_{H}$ est la constante de Rydberg.
Calculer sa valeur dans le système International $(0.5\;pt)$
5.1.3 Calculer la longueur d'onde la plus petite des radiations que peut émettre l'atome d'hydrogène et la fréquence correspondante. $(0.5\;pt)$
5.1.4 Calculer en électronvolts, l'énergie d'ionisation d'un atome d'Hydrogène dans son état fondamental. $(0.5\;pt)$
5.2 Le spectre d'émission d'une lampe à hydrogène présente une série de radiations situées dans le visible et parmi lesquelles les radiations de longueur d'onde $\lambda_{1}=486.1nm$ et $\lambda_{2}=434.1nm$
5.2.1 Cette série de radiations correspond à des transitions décroissantes arrivant sur le même niveau inférieur $p=2.$
Déterminer les niveaux d'énergie de départ pour les transitions correspondant respectivement à $\lambda_{1}$ et à $\lambda_{2}.$ $(0.5\;pt)$
5.2.2 Calculer la longueur d'onde la plus petite pour cette série de radiations. $(0.5\;pt)$
5.3 Dans un gaz, les atomes d'hydrogène sont à l'état fondamental.
5.3.1 Parmi les photons de longueurs $\lambda_{3}=102.6nm$ et à $\lambda_{4}=100.9nm$ lequel est susceptible d'être absorbé par les atomes d'hydrogène ?
Justifier la réponse. $(0.5\;pt)$
5.3.2 On envoie des photons d'énergie $14.9eV.$
Que va-t-il se produire ?
Justifier. $(0.5\;pt)$
Données :
Célérité de la lumière dans le vide : $c=3.0\cdot 10^{8}m\cdot s^{-1}$ ;
Charge élémentaire : $e=1.6\cdot10^{-19}C$ ;
Constante de Planck : $h=6.62\cdot10^{-34}J\cdot s$ ;
$1eV=1.6\cdot10^{-19} J.$

Ajouter un commentaire