Solutions aqueuses acides - 2nd S
Classe:
Seconde
I. Classification des solutions
1. Expérience
Prélevons une petite partie de la solution à tester et plaçons-la dans un tube à essais.
Puis ajoutons dans ce tube à essais quelques gouttes de Bleu de Bromothymol $(B.B.T.)$
2. Observations
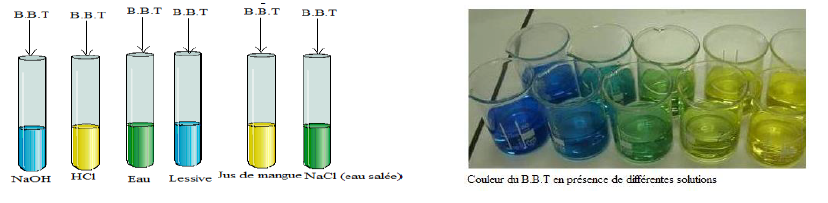
On constate :
$-\ $ Certaines solutions, en présence du $B.B.T$, prennent la teinte jaune
$-\ $ D'autres virent au bleu en présence de $B.B.T$
$-\ $ Le reste des solutions se colorent en vert suite à l'ajout du $B.B.T$
3. Interprétation
Les solutions ne donnent pas la même coloration avec le $B.B.T.$
Elles sont donc de natures différentes.
Le $B.B.T$ est donc une substance qui change de couleur suivant la nature de la solution
4. Conclusion
$-\ $ Les solutions qui font virer le $B.B.T$ au jaune sont appelées solutions acides
Exemples :
L'acide chlorhydrique $HCl$, le jus de mangue
$-\ $ Les solutions basiques sont des solutions qui prennent la chloration bleue en présence de $B.B.T$
Exemples :
La solution d'hydroxyde de sodium $NaOH$, la lessive
$-\ $ Les solutions neutres virent en vert en présence de $B.B.T$
Exemples :
Le chlorure de sodium $NaCl$, l'eau $HCl$
II. Chlorure d'hydrogène
1. Structure du chlorure d'hydrogène
Le chlorure d'hydrogène $HCl$ est constituée d'un atome d'hydrogène $H$ et d'un atome de chlore $Cl$, liés par une liaison simple.
Le chlore étant nettement plus électronégatif que l'hydrogène, la liaison est polarisé
Comme tous les composés gazeux, le chlorure d'hydrogène a une structure moléculaire
Le liquide obtenu par liquéfaction du gaz ne conduit pas le courant électrique.
Il a également une structure moléculaire
2. Propriétés physiques
Le chlorure d'hydrogène anhydre est un gaz incolore, d'odeur âcre et irritante, facilement liquéfiable $($sous pression atmosphérique, il se liquéfie entre $-94$ et $-85^{\circ}C.)$
Il est très soluble dans l'eau ; $20^{\circ}C$ et à la pression atmosphérique, un litre d'eau peut dissoudre environ $450$ litres de ce gaz
Cette grande solubilité du chlorure d'hydrogène peut être mise en évidence grâce l'expérience du jet d'eau

La dissolution s'accompagne d'un très grand dégagement de chaleur.
Il est également soluble dans de nombreux solvants organiques (méthanol, éthanol, propanol...etc)
III. Acide chlorhydrique
1. Propriétés conductrices de la solution aqueuse d'acide chlorhydrique
1.1 Expérience
Considérons le circuit électrique ci-dessous
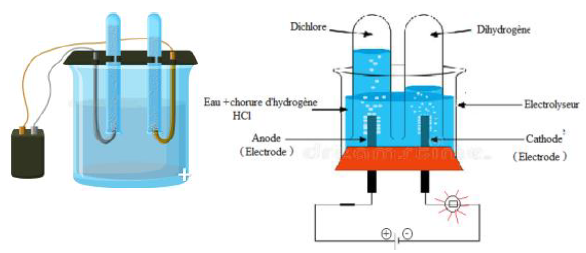
Plaçons de l'eau distillée dans l'électrolyseur et fermons l'interrupteur.
La lampe ne brille pas.
Remplaçons l'eau distillée par une solution aqueuse de chlorure d'hydrogène et fermons l'interrupteur.
La lampe brille et on observe des dégagements gazeux au niveau des électrodes :
$-\ $ à la cathode, du dihydrogène, qui produit une faible détonation en présence de la flamme d'une allumette ;
$-\ $ à l'anode du dichlore, qui se dissout en partie dans l'eau et déclore l'indigo
1.2 Interprétation
La solution aqueuse d'acide chlorhydrique est conductrice : elle est un électrolyte.
Elle contient donc des ions
Ces ions apparaissent lors de la dissolution du chlorure d'hydrogène dans l'eau
L'équation-bilan de la réaction s'écrit :
$$HCl\ +\ H_{2}O\ \longrightarrow\ H_{3}O^{+}\ +\ Cl^{-}$$
Au cours de la réaction, la molécule d'eau arrache un proton $H^{+}$ à la molécule du chlorure d'hydrogène $HCl$, donnant l'ion hydronium $H_{3}O^{+}.$
Il se forme un ion chlorure $Cl^{-}$
VI. Propriétés des solutions aqueuses de chlorure d'hydrogène
1. Propriétés liées à l'ion hydronium $H_{3}O^{+}$
1.1 Action sur les indicateurs colorés
Introduisons quelques gouttes d'indicateur coloré, dans deux tubes respectivement de l'eau distillée, une solution aqueuse chlorure de sodium (tubes témoins), d'autre part dans un tube contenant une solution aqueuse d'acide chlorhydrique
$$\begin{array}{|l|l|l|l|} \hline &\text{Eau distillée}&\text{solution chlorure}&\text{solution d’acide}\\& &\text{de sodium}&\text{de sodium}\\ \hline \text{Hélianthine}&\text{Orange}&\text{Orange}&\text{Rouge}\\ \hline \text{BBT}&\text{Vert}&\text{Vert}&\text{Jaune}\\ \hline\text{Phénolphtaléine}&\text{Rose}&\text{Rose}&\text{Incolore}\\ \hline \end{array}$$
On observe que les indicateurs colorés ont la même couleur dans une solution de chlorure de sodium que dans l'eau distillée.
Ce ne sont donc point les ions $Cl^{-}$ qui provoquent le changement de couleur des indicateurs
Le changement de couleur des indicateurs colorés est dû à la présence des ions hydroniums $H_{3}O^{+}$
Les solutions qui font virer les indicateurs colorés comme la solution le chlorure d'hydrogène sont appelées solutions acides
Le caractère acide de ces solutions est dû à la présence des ions $H_{3}O^{+}$
La solution aqueuse de chlorure d'hydrogène est une solution acide.
C'est pourquoi on appelle acide chlorhydrique $(H_{3}O^{+}+Cl^{-})$
Le chlorure d'hydrogène est totalement ionisé en solution.
C'est un acide fort
La concentration molaire en ion hydronium est égale à la concentration de l'acide chlorhydrique
$$C_{H_{3}O^{+}}=C_{HCl}$$
Remarque
La saveur acide des agrumes ou du vinaigre est due aux ions $H_{3}O^{+}$
Il ne faut pas s'amuser à gouter les acides utilisés au laboratoire qui sont très dangereux
1.2 Action sur certains métaux
L'ion $H_{3}O^{+}$ des solutions d'acide attaque certains métaux tels que le zinc, le fer et l'aluminium avec dégagement d'hydrogène
Les équation-bilan des réactions s'écrivent :
$Fe^{2+}\ +\ H_{3}O^{+}\ \longrightarrow\ Fe^{2+}\ +\ H_{2}\ +\ 2H_{2}O$
$Zn^{2+}\ +\ H_{3}O^{+}\ \longrightarrow\ Zn^{2+}\ +\ H_{2}\ +\ 2H_{2}O$
$Al^{3+}\ +\ H_{3}O^{+}\ \longrightarrow\ Al^{3+}\ +\ \dfrac{3}{2}H_{2}\ +\ 3H_{2}O$
1.3 Action sur les bases
L'ion hydronium des solutions aqueuses d'acides réagissent sur les bases pour donner de l'eau et du sel
2. Propriétés des ions chlorure $Cl^{-}$
Versons quelques gouttes d'une solution de nitrate d'argent $(Ag^{+}+3NO^{-})$ dans une solution de chlorure d'hydrogène $(H_{3}O^{+}+Cl^{-})$
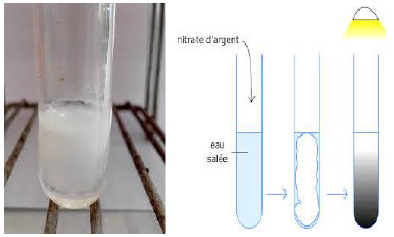
On observe aussitôt un précipité blanc qui noircit à la lumière
Il s'agit du chlorure d'argent qui apparait à l'état solide car il est insoluble dans l'eau
L'équation-bilan de la réaction s'écrit :
$$Ag\ +\ Cl^{-}\ \longrightarrow\ AgCl$$
V. Acides courants et produits naturels acides
1. Acides courants
Il existe de nombreuses solutions acides
Au laboratoire les acides les plus couramment utilisés sont :
$-\ $ L'acide sulfurique $H_{2}SO_{4}$ : il est totalement ionisé en solution, c'est un acide fort
L'équation-bilan de la réaction s'écrit :
$$H_{2}SO_{4}\ +\ 2H_{2}O\ \longrightarrow\ 2H_{3}O^{+}\ +\ SO_{4}^{2-}$$
L'acide sulfurique est un diacide.
Dilué, ses propriétés sont comparables à celles de l'acide chlorhydrique Concentré, il a des propriétés déshydratantes
$-\ $ L'acide nitrique $HNO_{3}$ : c'est un monoacide fort.
Son action sur l'eau se traduit par l'équation-bilan :
$$HNO_{3}\ +\ H_{2}O\ \longrightarrow\ H_{3}O^{+}\ +\ NO_{3}^{-}$$
Son action sur les métaux est différente de celle de l'acide chlorhydrique à cause des propriétés oxydantes des ions nitrate
$-\ $ L'acide éthanoïque : appelé couramment acide acétique, c'est le principal constituant du vinaigre.
Au cours de sa réaction sur l'eau, toutes les molécules ne sont pas transformées en ions. La réaction n'est pas totale
2. Produits naturels acides
Parmi les acides rencontrés dans les corps naturels, on citer :
$-\ $ L'acide citrique contenu dans les citrons et de nombreux fruits notamment les agrumes
$-\ $ L'acide lactique qui apparait lors de la fermentation du lait
$-\ $ Les acides aminés naturels qu'on trouve dans certains acides α-aminés

Ajouter un commentaire