Notion de pH : indicateurs colorés - 2nd S
Classe:
Seconde
L'acidité est une idée qui nous est familière car de nombreux aliments et boissons sont acides à des degrés variables : le vinaigre, le jus de citron, la tomate, les agrumes etc.
A l'opposé des solutions acides il existe des solutions basiques.
Il est difficile pour nous de comprendre ce qu'est une solution basique car les aliments et boissons ne le sont presque jamais.
On trouve plutôt des solutions basiques parmi les produits d'entretien comme l'eau de javel ou les détergents.
Le $pH$ est un nombre qui indique si une solution est acide ou basique et avec quel degré (faiblement ou fortement).
I. Notion de $pH$
1. Définition
Le $pH$ permet de mesurer l'acidité, la basicité ou la neutralité d'une solution.
Le $pH$ est lié à la concentration en ions oxonium $H_{3}O^{+}$ dans la solution par la relation :
$$\left[H_{3}O^{+}\right]=10^{-pH}$$
2. Mesure du $pH$
On mesure le $pH$ à l'aide d'un appareil appelé $pH$

Il s'agit d'un appareil constitué de deux parties : une électrode que l'on plonge dans la solution et un voltmètre électronique dont l'échelle est graduée directement en unités de $pH.$
Le $pH$ est une grandeur chimique qui n'a pas d'unité
Remarque
On peut utiliser un stylo$-pH$ pour mesurer le $pH$ d'une solution
3. Le produit ionique de l'eau
La réaction de dissociation est une réaction qui n'est pas totale.
Cette réaction partielle est caractérisé par une constante
$$Ke=\left[H_{3}O^{+}\right]\left[OH^{-}\right]$$
$Ke$ appelée produit ionique de l'eau $Ke$ augmente avec la température
$$Ke=10^{-14}\text{ à }25^{\circ}C$$
Remarque
La constante $Ke$ du produit ionique de l'eau est valable non seulement pour l'eau pure, mais aussi toute solution aqueuse
3. Caractères acido-basique d'une solution
Si on dissout un composé ionique dans l'eau, ses ions peuvent réagir avec les ions de l'eau, mais le produit ionique de l'eau reste constant
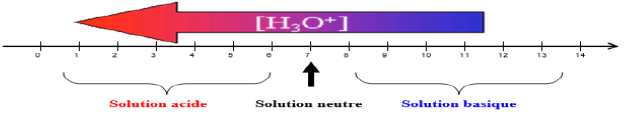
$-\ $ Si $pH<7$, la solution est acide
$-\ $ Si $pH>7$, la solution basique
$-\ $ Si $pH=7$, la solution est dite neutre
Échelle de $pH$ : Caractère d'une solution :
Sur l'échelle des $pH$, l'acidité ne varie donc que de $0$ à $14.$
3. Importance de la notion de $pH$
Les règnes, animal et végétal, sont régis par des équilibres biologiques la plupart du temps liés à leur $pH.$
En effet, les milieux vivants ont un $pH$ remarquablement constant grâce à des mécanismes régulateurs chimiques, commandés très souvent par voie hormonale
3.1 Importance du $pH$ en biologie
3.1.1 Le $pH$ du sang
Le $pH$ du sang humain doit être compris entre $7.3$ et $7.5$ (il est légèrement basique).
Pour un $pH$ inférieur à $7$, il risque de coma.
Pour un $pH$ supérieur à $7.9$, il y a risque de tétanisation des muscles, en particulier du cœur, et c'est la mort
3.1.2 Le $pH$ de l'intérieur de l'estomac
A l'intérieur de l'estomac, la digestion n'a lieu que si le $pH$ est égal, ou très voisin, de $1.5$ (peptase de l'estomac)
Des tels milieux biologiques, pour lesquels le $pH$ est constant, sont appelés des milieux tampons.
En effet, des régulateurs chimiques rendent ces milieux tamponnés insensibles à un apport d'acide ou de base en quantité modérée
3.2 Importance du $pH$ dans l'agriculture
Le $pH$ en agriculture revêt une importance pour le type de culture à implanter.
C'est ainsi qu'on parle de sols acides et de sols basiques selon la nature de la roche et du revêtement végétal qui sont à l'origine de couche arable
$-\ $ Un sol riche en silicium est acide $(3<pH<6)$, il est, par ailleurs, pauvre en calcium.
S'il est perméable à l'air, la végétation qui y pousse sera très pauvre
$-\ $ Les sols basiques $(pH=8)$ sont riches en calcium et pauvres en silicium.
Ils sont meubles et perméables à l'air et à l'eau.
Ce sont des sols calcaires
$-\ $ Toutes les cultures sont possibles sur des sols peu acides et peu basiques $(6.5<pH<7.5)$, mais le $pH$ détermine, entre autre, la culture la plus adaptée.
Pour la plupart des plantes le rendement maximal n'est obtenu que si le $pH$ est compris dans un domaine caractéristique pour chaque végétal
$-\ $ Si le $pH$ du sol ne convient pas au type de culture envisagé, il est toujours possible de le modifier par des apports de produits chimiques :
$-\ $ apport de soufre ou d'humus pour baisser le $pH$ d'un sol trop basique
$-\ $ apport de chaux pour élever le $pH$ d'un sol trop acide
II.Indicateurs colorés : zone de virage
1. Définition
Les indicateurs colorés sont des substances qui passent progressivement, quand le $pH$ croit, d'une couleur à une autre dans un petit domaine de $pH$ appelé zone de virage de cet indicateur
2. Exemples d'indicateurs colorés
2.1 Quelques indicateurs courants
Le tableau ci-dessous présente une liste non exhaustive des principaux indicateurs utilisés en chimie ou en biologie.
Les valeurs des transitions et les teintes peuvent varier légèrement en fonction des conditions d'utilisation (solvants, température, pression, etc...).
$$\begin{array}{|l|l|l|l|} \hline \text{Indicateur}&\text{Couleur (acide)}&\text{Transition}&\text{Couleur (base)}\\&&\text{(approximativement)}&\\ \hline \text{Bleu de bromothymol, BBT (1er transition)}&\text{rose-rouge}&\approx 0.0&\text{jaune}\\ \hline \text{Rouge de crésol (acide - 1er transition)}&\text{rouge}&0.0-1.0&\text{jaune}\\ \hline \text{Méthyl violet}&\text{jaune}&0.0-1.6&\text{bleu-violet}\\ \hline \text{Vert malachite (acide - 1er transition)}&\text{jaune}&0.2-1.8&\text{bleu-vert}\\ \hline \text{Bleu de thymol (acide - 1er transition)}&\text{rouge}&1.2-2.8&\text{jaune}\\ \hline \text{Jaune de méthyle}&\text{rouge}&2.9-4.0&\text{jaune}\\ \hline \text{Bleu de bromophénol (BBP)}& \text{jaune}&3.0-4.6&\text{violet}\\ \hline \text{Rouge congo}&\text{bleu}&3.0-5.2&\text{rouge}\\ \hline \text{Méthyl orange (Hélianthine)}&\text{rouge}&3.1-4.4&\text{jaune}\\ \hline \text{Méthyl orange en solution dans le xylène cyanole}&\text{pourpre}&3.2-4.2&\text{vert}\\ \hline \text{Vert de bromocrésol}&\text{jaune}&3.8-5.4&\text{bleu}\\ \hline \text{Rouge de méthyle}&\text{rouge}&4.2-6.3&\text{jaune}\\ \hline \text{Papier de tournesol (Azolitmine)}&\text{rouge}&4.5-8.3&\text{bleu}\\ \hline \text{Pourpre de bromocrésol}&\text{jaune}&5.2-6.8&\text{violet}\\ \hline \text{Bleu de bromothymol, BBT (2e transition)}&\text{jaune}&6.0-7.6&\text{bleu}\\ \hline \text{Rouge de phénol (Phénolsulfonephtaléine)}&\text{jaune}&6.6-8.0&\text{rouge}\\ \hline \text{Rouge neutre}&\text{rouge}&6.8-8.0&\text{jaune orangé}\\ \hline \text{Rouge de crésol (base - 2e transition)}&\text{jaune}&7.2-8.8&\text{rouge}\\ \hline \text{Bleu de thymol (base - 2e transition)}&\text{jaune}&8.0-9.6&\text{bleu}\\ \hline \text{Phénolphtaléine}&\text{incolore}&8.2-10.0&\text{rose}\\ \hline \text{Thymolphtaléine}&\text{incolore}&9.4-10.6&\text{bleu}\\ \hline \text{Jaune d'alizarine R}&\text{jaune}&10.1-12.0&\text{orange-rouge}\\ \hline \text{Alizarine}&\text{rouge}&11.0-12.4&\text{violet}\\ \hline \text{Carmin d'indigo}&\text{bleu}&11.4-13.0&\text{jaune}\\ \hline \text{Vert malachite (base - 2e transition)}&\text{bleu-vert}&11.5-13.2&\text{incolore}\\ \hline \end{array}$$
2.1 Indicateurs naturels de $pH$
Contrairement aux indicateurs chimiques purs, les indicateurs naturels contiennent plusieurs composés chimiques qui influent sur la couleur.
Les zones de virage différents donc selon la nature du composé utilisé.
Par exemple, le jus de chou rouge peut ne pas virer au jaunes avant un $pH>14$ s'il date de plusieurs jours.
De même, la transition de jus de carotte, par exemple, est difficilement observable.
L'avantage majeur des indicateurs natures sur leurs équivalents de synthèse est leur très faible coût.
On les trouve souvent directement dans la nature où ils ne coûtent pratiquement rien.
$$\begin{array}{|l|l|l|l|} \hline \text{Indicateur}&\text{Couleur (acide)}&\text{Transition} &\text{Couleur (base)}\\& &\text{(approximativement)}\\ \hline \text{Chou rouge (acide - 1er transition)}&\text{rouge}&\text{environ }2.0-3.0&\text{rose}\\ \hline \text{Chou rouge (acide - 2e transition)}&\text{rose}&\text{environ }3.0-4.0&\text{violet}\\ \hline \text{Thé}&\text{jaune}&\text{environ }6.0-7.0&\text{brun}\\ \hline \text{Chou rouge (base - 3e transition)}&\text{violet}&\text{environ }6.0-7.0&\text{bleu}\\ \hline \text{Artichaut}&\text{incolore}&\text{environ }7.0-8.0&\text{jaune}\\ \hline \text{Curry}&\text{jaune}&7.4-8.6&\text{brun-orangé}\\ \hline \text{Curcuma}&\text{jaune}&7.4-8.6&\text{brun-orangé}\\ \hline \text{Chou rouge (base - 4e transition)}&\text{bleu}&\text{environ }8.0-9.0&\text{vert}\\ \hline \text{Betterave}&\text{rouge}&\text{environ }11.0-12.0&\text{jaune}\\ \hline \text{Chou rouge (base - 5e transition)}&\text{vert}&\text{environ }12.0-13.0&\text{jaune}\\ \hline \text{Thym}&\text{jaune}&\text{environ }12.0-13.0&\text{brun}\\ \hline \end{array}$$
3. Utilisation des indicateurs
L'utilisation des indicateurs colorés permet de déterminer une valeur approchée du $pH$ d'une solution.
On ajoute quelques gouttes de l'indicateur coloré dans la solution à étudier et on note la couleur obtenue.
4. Le papier $pH$
On peut aussi utiliser un papier $pH$
Il s'agit du papier préparé à l'aide d'un mélange d'indicateur colorés et qui prend une couleur bien déterminée lorsqu'il est en contact avec une solution de $pH$ étudiée.
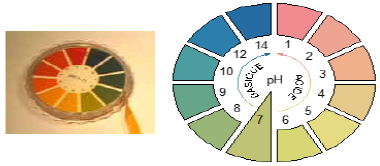
Il suffit donc de mettre ce papier en contact avec la solution et de comparer la teinte qu'il prend avec une des teintes donnant le $pH$
5. Indicateurs naturels
5.1 Définition
Un indicateur universel est en mélange d'indicateurs, il donne un changement graduel de couleur selon la valeur du $pH$, contrairement aux indicateurs classiques (Bleu de bromothymol, la phénolphtaléine ou l'Hélianthine) qui ne possèdent qu'un changement de couleur bien marqué.
5.2 principe de fabrication d'indicateurs universels et du papier $pH$
Certaines substances naturelles peuvent faire office d'indications colorés, le jus de chou rouge est l'une d'entre elles.
Pour l'obtenir il suffit de broyer des feuilles de chou rouge, de mélanger avec de l'eau puis filtrer.
Le jus de chou rouge comporte un mélange d'espèces chimiques sensible au $pH$.
Elle prennent une gamme de couleurs différentes en fonction des valeurs du $pH$ qui va du rouge au jaune en passant par le violet, bleu et le vert.

Le papier $pH$ est un papier absorbant imbibé d'un indicateur coloré universel qui permet de déterminer le $pH$ d'une solution instantanément en fonction de sa couleur.
6. Dosage d'une solution d'acide chlorhydrique par la soude
6.1 Expérience
A l'aide d'une pipette jaugée, on place dans un bécher un volume de $V_{A}$ d'acide chlorhydrique de concentration $C_{A}$ inconnue à déterminer
Ajoutons quelques gouttes de $BBT.$
Puis à l'aide d'une burette graduée place au-dessus du bécher, on verse petit à petit dans le bécher la solution d'hydroxyde de sodium de concentration $C_{B}$ connu
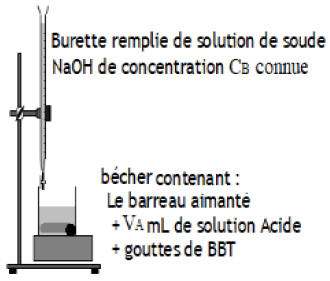
L'agitateur magnétique permet d'homogénéiser le mélange après ajout de la solution d'hydroxyde de sodium
Observations
Quand on mélange une solution d'acide chlorhydrique $HC1$ et de base $NaOH$, on constate :
$-\ $ une élévation de la température du milieu réactionnel
$-\ $ le virage de l'indicateur coloré $BBT$ : la couleur jaune du $BBT$ en milieu acide passe à la couleur verte.
Interprétation
Lors de la réaction acido-basique, on note un important dégagement de la chaleur.
La réaction est donc exothermique.
Le virage du $BBT$ de la couleur jaune à la couleur verte explique une diminution de la concentration des hydroniums $H_{3}O^{+}$ du milieu
On peut donc attribuer la diminution des ions hydroniums $H_{3}O^{+}$ de la solution à une réaction entre les ions $H_{3}O^{+}$ et les ions $OH^{-}.$
Il s'agit de la réaction acido-basique.
L'équation-bilan de la réaction s'écrit :
$$H_{3}O^{+}\ +\ OH^{-}\ \longrightarrow\ 2H_{2}O$$
Remarque
les ions $Na^{+}$ et $C1^{-}$ n'interviennent pas dans la réaction : ce sont des ions indifférents
6.2 Équivalence acido-basique
6.2.1. Définition
Il y a équivalence lorsque les réactif ont été mélangés dans les proportions stœchiométriques de la réaction de dosage
6.2.2 Détermination de la concentration $C_{A}$
La réaction étudiée ici pour équation :
$$H_{3}O^{+}\ +\ OH^{-}\ \longrightarrow\ 2H_{2}O$$
A l'équivalence :
$n_{H_{3}O^{+}}=n_{OH^{-}}$
$\Rightarrow\;C_{A}V_{A}=C_{B}V_{BE}$
$\Rightarrow\;C_{A}=C_{B}\dfrac{V_{BE}}{V_{A}}$

Commentaires
Ba (non vérifié)
dim, 03/29/2020 - 15:53
Permalien
Remerciement
Ajouter un commentaire