Généralisation de l'oxydoréduction en solution aqueuse - 1er s
Classe:
Première
I. Couples oxydant-réducteurs autres que ion métallique/métal
1. Exemples de couples
1.1 Le couple $Fe^{2+}/Fe$
L'élément fer existe en solution aqueuse sous la forme de $Fe^{2+}$ $($ion fer $II$ de couleur verdâtre$)$ et $Fe^{3+}$ $($ion fer $III$ de coloration brun orange$).$
Ces deux espèces forment un couple oxydant réduction $Fe^{2+}/Fe$
La demi-équation électronique s'écrit :
$$Fe^{3+}\ +\ e^{+}\ \leftrightarrows\ Fe^{2+}$$
1.2 La couple $MnO_{4}^{-}/Mn^{2+}$
L'ion permanganate $MnO_{4}^{-}$ (coloration violette) que l'on trouve dans le permanganate de potassium $(KMnO_{4})$ est un oxydant fort fréquemment utilisé dans l'industrie et au laboratoire.
Sa réduction donne l'ion manganèse $Mn^{2+}$ (incolore).
Ils forment un couple rédox $MnO_{4}^{-}/Mn^{2+}$
Pour écrire la demi-équation électronique relative à la transformation de $MnO_{4}^{-}$ à $Mn^{2+}$ on procède par étapes :
$-\ $ Équilibrer les éléments autres que les éléments oxygène et hydrogène
$$MnO_{4}^{-}\ \longrightarrow\ Mn^{2+}$$
$-\ $ Équilibrer l'élément oxygène en ajoutant des molécules d'eau $H_{2}O$
$$MnO_{4}^{-}\ \longrightarrow\ Mn^{2+}\ +\ 4H_{2}O$$
$-\ $ Équilibrer l'élément hydrogène en ajoutant des protons $H^{+}$
$$MnO_{4}^{-}\ +\ 8H^{+}\ \longrightarrow\ Mn^{2+}\ +\ 4H_{2}O$$
$-\ $ Équilibrer les charges ajoutant le nombre d'électrons nécessaires
$$MnO_{4}^{-}\ +\ 8H^{+}\ +\ 5e^{+}\ \longrightarrow\ Mn^{2+}\ +\ 4H_{2}O$$
1.2 le couple $Cr_{2}O_{7}^{2-}/Cr^{3+}$
Le permanganate de potassium est utilisé pour réaliser des titrages
Il sert également au traitement de l'eau puisqu'il permet d'oxyder le fer et le manganèse contenu dans les eaux souterraines.
La solution de permanganate de potassium par une solution de dichromate de potassium $K_{2}Cr_{2}O_{7}$ donne des ions $Cr_{2}O_{7}^{2-}$ (de couleur orange)
La demi-équation électronique s'écrit :
$$Cr_{2}O_{7}^{2-}\ +\ 14H^{+}\ +\ 6e^{-}\ \rightarrow\ 2Cr^{3+}\ +\ 7H_{2}O$$
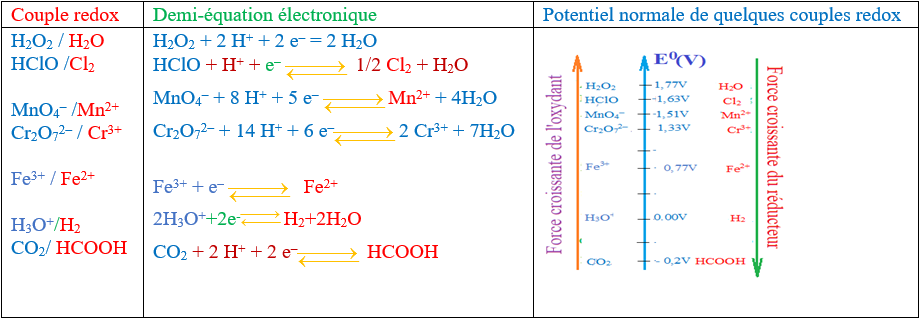
2. Généralisation
2.1 Quelques potentiels normaux

Ajouter un commentaire