Les alcanes - 1er L
Classe:
Première
Les hydrocarbures sont des composés organiques formés uniquement de carbone et d'hydrogène.
Leur formule générale s'écrit $C_{x}H_{y}.$
Les hydrocarbures les plus répandus et les plus importants au plan économique portent le nom d'alcanes ; constituants essentielles du gaz naturel et des pétroles.
I. Structures des alcanes
1. Rappel
$H$ : valence $1$ ;
$C$ : valence $4$
Une liaison covalente simple résulte la mise en commun entre deux atomes de deux électrons célibataires pour former un doublet d'électrons.
Pour satisfaire la règle de l'octet un atome de carbone doit engager ces quatre électrons célibataires dans des liaisons covalente on dit que l'atome de carbone est tétravalent.
L'atome d'hydrogène peut établir qu'une liaison de covalence, on dit que l'atome est monovalent.
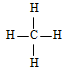
2. Exemple du méthane : $CH_{4}$
2.1. Formule développée plane
2.2. Structure de la molécule du méthane
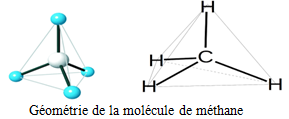
Les angles $HCH$ valent $109.28\,mn$ et les longueurs de liaison $CH$ valent $110\,pm$ $\left(pm\text{ (picomètre)}=10^{-12}m\right).$
Les $4$ atomes d'hydrogène sont disposés aux quatre sommets d'un tétraèdre au centre duquel se trouve l'atome de carbone.
La molécule du méthane est tétraédrique.
Autour du carbone il y a quatre liaisons de covalentes simple.
On dit que l'atome de carbone est tétragonal.
Les alcanes ne comportent que des carbones tétragonaux.
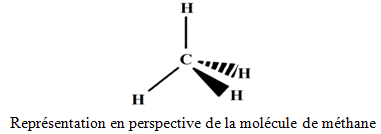
2.3. Représentation spatiale de la molécule
On adopte des conventions si après pour représenter perspective une structure tridimensionnelle telle que l'atome de carbone tétraédrique soit dans le plan

3. Exemple de l'éthane $C_{2}H_{6}$
3.1. Formule développée et semi-développée
L'éthane, de formule brute $C_{2}H_{6}$, est un alcane.
La structure de la molécule d'éthane fait apparaître :
$-\ $une liaison covalente simple entre les atomes de carbone tétragonaux ;
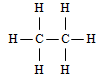
Formule développée de la molécule d'éthane
$-\ $des liaisons covalences simples entre les atomes de carbone et les atomes d'hydrogène
$CH_{3}-CH_{3}$
Formule semi-développée de la molécule d'éthane
3.2. Géométrie de la molécule
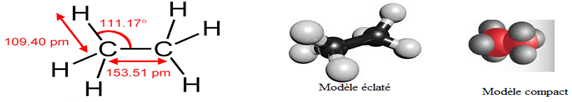
3.3. Représentation de Newman
La molécule est observée selon une liaison qui a été choisie.
Les atomes de la liaison considérée sont représentés par un cercle.
Les liaisons établies entre deux atomes et leur voisin sont projetés dans un plan perpendiculaire à la liaison choisie.
La libre rotation autour de la liaison carbone confère à la molécule une infinité de dispositions relatives des atomes d'hydrogène des deux groupes $CH_{3}$ (méthyle) chacune de ces dispositions constitue une conformation.
Parmi l'infinité des conformations possibles, deux d'entre-elles possèdent une géométrie remarquable :


4. Généralisation : la chaine des alcanes : isomérie de chaine
4.1. La chaine carbonée
A la formule brute $C_{4}H_{10}$ correspond deux formules développées et deux formules semi-développées.
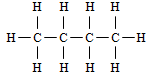
Formule développée du butane
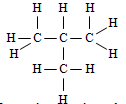
Formule développée duméthylpropane
$CH_{3}-CH_{2}-CH_{2}-CH_{3}$
Formule semi développée :
Formule semi développée : le méthylpropane
On voit donc apparaitre un enchainement d'atome de carbone.
On appelle chaîne carbonée ou squelette carboné l'enchaînement des atomes de carbone liés entre eux par des liaisons de covalence.
Dans l'exemple à la chaine carbonée est dite linéaire ou directe.
Les atomes de carbones du composé organique sont liés au plus à deux autres atomes de carbone, la chaine carbonée est dite ramifiée.
Une chaine carbonée est dite ramifiée si elle renferme au moins un atome de carbones lié lui-même à trois ou quatre atomes de carbone.
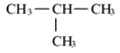
4.2. Isomérie de chaine
Les isomères de chaines sont des isomères de constitution qui diffèrent par l'enchainement des atomes de carbone.
Exemples
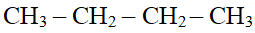 et
et 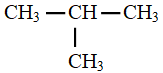
5. Le cas des Cyclanes
Il existe des hydrocarbures possédant des atomes carbone tétragonaux et dans lesquels toutes les liaisons carbones sont de liaison covalente simple, mais dont la chaine carbonée est fermée.
On les appelle des cyclanes ou cycloalcanes pour répondre à la formule générale $C_{n}H_{2n}$ avec $n\geq 3.$

Ajouter un commentaire