Niveaux d’énergie de l’atome
Exercice 1
Les énergies des différents niveaux, exprimés en électron-volt, sont données par la formule :
$E_{n}=\frac{13,6}{n^{2}}1$.Calculer les énergies correspondant à $n = 1, 2, 3$ et $\infty$ et représenter le diagramme
des niveaux d'énergie de l'atome d'hydrogène.
2. Quelle est l‟énergie minimale que l'on doit fournir à un atome d'hydrogène pour qu'il
passe de l'état fondamental à un état excité ? La transcrire sur le diagramme.
3. Cette énergie est apportée à l'atome par une radiation lumineuse monochromatique.
Calculer sa longueur d'onde.
4. Calculer la longueur d‟onde de la radiation susceptible d'ioniser l'atome d'hydrogène
Exercice 2
1 Rutherford a décrit l'atome d'hydrogène par le modèle planétaire : l'électron a un
mouvement circulaire, de rayon $r$, autour d‟un noyau constitué de proton.
La force électrique subie l‟électron est dirigée selon la droite proton-électron, attractive de
valeur $F={Ke^{2}}{r^{2}}$
La force gravitationnelle est négligeable devant cette force
a) Montrer que le mouvement de l'électron est uniforme
b) Etablir l'expression de la vitesse v en fonction de $k, e, r$ et $m$
c) Exprimer son énergie cinétique en fonction de ces mêmes paramètres.
d) Exprimer en énergie mécanique E en fonction de $k$, e et r sachant que son énergie
potentielle est : $E_{p}=\frac{ke^{2}}{r}$
Quelle est sa limite quand $r$ tend vers l'infini
2. Différents faits expérimentaux ontconduit Niels Bohr à formuler l'hypothèse suivante :
l'électron ne se déplacer que sur certains cercles dont les rayons $r_{n}$ obéissent à la loi :
$v_{n}r_{n}=\frac{nK}{m}$ ;
$K$ constante universelle :$ K= 1,054.10^{34}. K J s n$ : nombre entier $n\geq{1} ; v_{n}$ vitesse
de l'électron sur le cercle de rayon $ r_{n}$
a)Déterminer l'expression de $r_{n}$ en fonction des constantes $k, K, m, e$ et $n$. Exprimer $r_{n}$ en
fonction de $ r_{1}$ . Calculer $ r_{1}$
b) Déterminer l'expression de $E_{n}$ , énergie mécanique de l'électron sur le cercle de rayon $r_{n}$
, en fonction des mêmes paramètres Exprimer $E_{n}$ en fonction de $ E_{1}$
c) Calculer $ E_{1}$ et $ E_{2}$ en électronvolts. Quelle cause peut faire passer l'énergie de l'électron
de $ E_{1}$ à $ E_{2}$ . $m_{e} = 9,109.10^{-31}Kg ; e =1,602.10^{-19} ; k = 9,000.10^{9}SI$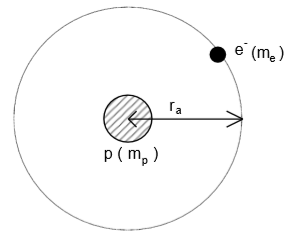
Exercice3 L’atomed’hydrogène
Diagramme d'énergie de l'atome d'hydrogène obtenu à partir de la formule : $E_{n} =\frac{13,6}{n^{2}} (en eV)$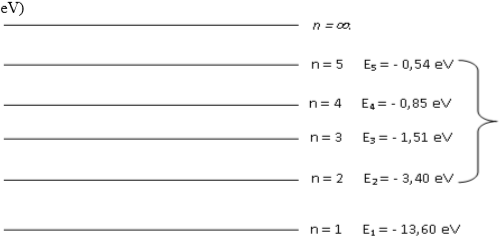
1) Quel est le nom du nombre noté $"n"$ qui apparaît dans le diagramme ?
2) Quand dit-on qu'un atome est dans son état fondamental ? Quel est l'état fondamental de
l'atome d'hydrogène ? Le noter sur le schéma.
3) Considérons une population d'atomes d'hydrogène au repos, sans apport d'énergie de la part de l'extérieur.
Dans quel état se trouvent les atomes (ou du moins l‟immense majorité) ?
4) Que représente le niveau noté : $n = ∞$ ? Noter son nom sur le schéma.
5) Quelle énergie minimale, en $eV$, faut-il fournir à un atome d'hydrogène pour l'ioniser
lorsqu'il est dans son état fondamental ?
6) Un atome d‟hydrogène a la configuration électronique telle que : $n = 3$
.Est-il dans son état fondamental ? Comment s'appelle un tel état ?
.Le représenter par un petit point sur le diagramme précédent.
7) L'atome d'hydrogène peut-il se trouver dans un état situé entre les niveaux $n = 1$ et $n = 2$ ?
8) L'atome d'hydrogène est excité sur le niveau : $n = 3$.
.Comment peut-on exciter cet atome ?
.Montrer qu'en se désexcitant vers le niveau $2$, il émet un photon de longueur d'onde : $\lambda= 656,1 nm$.
Cette radiation est-elle située dans les $X$, les $UV$, le visible ou l'IR ?
.Représenter par une flèche, sur le diagramme précédent, la transition correspondant à cette désexcitation.
9) Une radiation émise par l'atome d'hydrogène a une énergie égale à : $E = 2,54 eV$
Cette radiation émise par l'atome d'hydrogène fait partie de la série de Balmer (retour au niveau $n = 2$).
Déterminer la transition électronique correspondant à l'émission de cette
radiation. La noter sur le schéma.
. Calculer la longueur d'onde correspondante.
10) Une lampe à décharge à hydrogène émet-elle un spectre continu de radiations ou un spectre discontinu ?
Exercice 4
Données : célérité de la lumière dans le vide :$3 108 m/s$; constante de Planck : $h=6,62 10-34 Js$ ;
charge élémentaire : $e = 1,6 10^{-19} C$ ; masse de l'électron $m = 9 10^{-31} kg$.
La figure représente un diagramme très simplifié des niveaux
d'énergie de l'atome de lithium de numéro atomique $Z=3$, de formule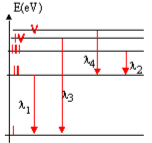
électronique $K^{2}L^{1}$.
On considère les quatre transitions représentées sur le diagramme.
Les longueurs d'ondes correspondantes sont $λ_{1} = 671 nm ; λ_{2} = 812
nm ; λ_{3} = 323 nm$ et $λ_{4} = 610 nm$.
1. Expliquer brièvement niveau d'énergie et spectres de raies.
2. Montrer qu'entre l'énergie $E(en eV)$ d'un photon et sa longueur
d'onde $λ$ il existe la relation $E= 1240 /λ. λ$ étant exprimé en $nm$ et $E$ en $eV$.
- Déterminer l'énergie $(eV)$ des photons émis lors de chacune des $4$ transitions.
3. L'énergie du niveau $I$ vaut $E_{1} = - 5,39 eV$. C'est l'énergie de l'électron externe dans son état
fondamental. Affecter l'énergie $E_{i} (eV)$ à chaque niveau du diagramme.
Pour quelle valeur de la longueur d'onde des radiations incidentes les atomes de lithium
subiront-ils une ionisation à partir de l'état fondamental ?
Exercice5 : Niveaux d’énergie de l’atome d’hydrogène
On s'intéresse dans ce qui suit aux niveaux d'énergie des atomes d'hydrogène et de sodium,
tous deux éléments de la première colonne du tableau de classification périodique.
1/ Les niveaux d'énergie de l'atome d'hydrogène sont donnés par la relation :$E_{n}=-13,6/n²$ où
En en $eV$ et $n$ un entier naturel non nul.
1-1 Déterminer l‟énergie minimale en $eV$, qu'il faut fournir à l'atome d'hydrogène pour
l'ioniser dans les cas suivants :
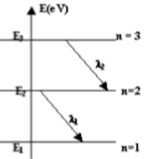 1-1.2 L'atome d'hydrogène est à l'état excité correspondant au niveau d'énergie $(n = 2)$.
1-1.2 L'atome d'hydrogène est à l'état excité correspondant au niveau d'énergie $(n = 2)$.1-2 Faire le schéma du diagramme des niveaux d'énergie de
l'atome d'hydrogène en utilisant l'échelle :
$1 cm$ pour $1 eV$. On ne représentera que les six premiers
niveaux.
2/ On donne ci-après le diagramme simplifié des niveaux d'énergie de l'a tome de sodium
(l'échelle n‟est pas respectée).
L'état fondamental correspond au niveau d'énergie $E_{1}$. Les niveaux d'énergie $E_{2}$ et $E_{3}$
correspondant à des états excités.
2-1 Lorsque l'atome passe de $E_{2}$ à $E_{1}$ il émet une radiation de longueur d'onde $λ_{1}=589 nm$;
lorsqu'il passe de $E_{3}$ à $E_{2}$, il émet une radiation de longueur d'onde $λ_{2}=568,8nm$.
En expliquant le raisonnement, calculer la différence d‟énergie $(E_{3}-E_{1})$ en $eV$.
2-2 Lorsque l'atome, initialement dans son état fondamental, est éclairé par un faisceau
monochromatique de longueur d'onde $λ$ convenable, il peut directement passer du niveau
d'énergie $E_{1}$ au niveau d‟énergie $E_{3}$.
Exprimer la longueur d'‟onde $λ$ de ce faisceau en fonction des longueurs d'onde $λ_{1}$ et $λ_{2}$.
Faire l'application numérique
Exercice 6
La mécanique quantique montre que l'état fondamental de l'atome d'hydrogène est caractérisé
par une énergie $E_{1} =-13,6ev$ et chaque niveau excité $n >1$ est définie par une énergie
$E_{n}=\frac{E_{0}}{n^{2}} (n$ est un entier naturel positif) avec $E_{0} = 13,6ev$.
1-/A quoi correspond l'énergie $E_{0}$ ?
2-/ Quelle relation simple existe entre l'énergie de transition$ \Delta{E}$ d'un niveau $n$ à un niveau $p$ et
la longueur d'onde du photon émis ou absorbé. (Traiter chaque cas à part)
3-/a-/ Montrer que pour une transition d'un niveau $p$ à un niveau $n$ tel que $p > n$, on peut écrire
la relation $\frac{1}{\lambda}=R_{H}(\frac{1}{n^{2}}-\frac{1}{P^{2}})$.
b-/ Vérifier que RH (appelée constante de Rydberg) vaut $RH = 1,10.10^{+7}m^{-1}$
c--/Dans la série de Balmer (le retour au niveau $n = 2$) l'atome $H$ émet $1$ spectre contenant $4$
raies visibles, on se propose de calculer deux longueurs d'ondes de $2$ raies de ce spectre
correspondant à $p=3 ( \lambda{3,2})$ et $p =4 ( \lambda{4,2})$. Sans faire de calcul, et en utilisant $\lambda{E}$, comparer
$\lambda{3,2}$ et $\lambda{4,2}$ puis calculer leurs valeurs.
4-/ L'atome $H$ est dans son état fondamental $(n=1)$, on l'excite à l'aide d'un photon incident
d'énergie $W=13,8 e$v. Que se passe-t-il ? Calculer ( en $ev$) l'énergie cinétique $Ec$ de l'électron de
$H$ éjecté.
5/ si l'atome entre en choc inélastique avec un électron ayant une énergie cinétique égale
$11 ev$, que se passe-t-il ?
Exercice7
|
Données : charge élémentaire : $e = 1,6.10^{-19} C$ Constante de Planck : $h = 6,62.10^{-34} J.s$ célérité de la lumière dans le vide : $c = 3.10^{8} m.s^{-1} 1eV = 1,6.10^{-19} J 1nm = 10^{-9} m$ |
Le spectre de l'atome d‟hydrogène est obtenu par décharge électrique dans un tube contenant
du dihydrogène sous faible pression. Deux électrodes situées à chaque extrémité du tube
permettent d'appliquer une différence de potentiel.
Lorsque les paramètres ($d.d.p$, température, pression) sont correctement fixés, on observe
l'émission de lumière dont l'analyse est faite à l'aide d'un spectroscope.
Le spectre obtenu est constitué, dans sa partie visible, de quatre raies notées $ H_{\alpha} H_{\beta}H_{\gamma}H_{\delta}$
de longueurs d'onde respectives dans le vide : $656,27 nm ; 486,13 nm ; 434,05 nm ; 410,17 nm$.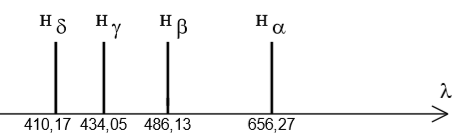
Spectre d'émission de l'atome d'hydrogène
1. Sachant que les couleurs des raies émises sont bleue, indigo, rouge et violette, restituer à
chaqueradiationsa couleur.
2. En $1885$, le physicien suisse Balmer, remarque que les longueurs d'onde $\lambda$ de ces quatre
radiations satisfont à une relation empirique :
| $\lambda=\lambda_{0}\frac{n^{2}}{n^{2}-4}$ |
$\lambda_{0} = 367,7 nm,n$ est un nombre entier naturel non nul ($n\ne{N*}$)
2.1. Indiquer la plus petite valeur possible de $n$. En déduire la longueur d'onde de la raie correspondante.
2.2. Quelles valeurs doit prendre $n$ pour retrouver les autres raies visibles du spectre ?
3. Les niveaux d'énergie quantifiés de l'atome d'hydrogène sont donnés par la relation :
$E_{n}=-\frac{E^{0}}{n^{2}}(eV)$
Pour $n = 1$ l'énergie de l'atome est minimale, l'atome est dans son état fondamental.
Pour toutes les autres valeurs de $n (n\geq{2} )$, l'atome est dans un état excité.
3.1. Expliquer brièvement le terme “ niveau d'énergie quantifié ”.
Que représente $E_{0}$ pour l'atome d'hydrogène ?
3.2. Etablir, en fonction de $n$, la fréquence $2 ,V_{n,2}$ (exprimée en $Hz$) des radiations émises
lorsque cet atome passe d'un état excité $n> 2$ à l'état excité $n = 2$.
3.3. Retrouver l'expression empirique de Balmer : $\lambda=\lambda_{0}\frac{n^{2}}{n^{2}-4},
\lambda$ étant exprimée en $nm$.
$A$ quelle transition correspond l'émission de la radiation de longueur d'onde $\lambda_{0}$ ? Justifier la
réponse.
3.4. Tracer le diagramme représentant les transitions entre les différents niveaux d'énergie de
l'atome d'hydrogène pour les quatre raies $ H_{\alpha} ,H_{\beta},H_{\gamma},H_{\delta}$de la série de Balmer.
4.1. Quelle est l'énergie cinétique minimale d'un électron projectile capable de provoquer par
choc l'excitation d'un atome d'hydrogène de son état fondamental à son deuxième état excité ?
4.2. Sous quelle tension minimale cet électron projectile, initialement au repos, a-t-il été accéléré ?
4.3. L'atome d'hydrogène précédemment excité revient à son état fondamental avec émission de deux photons.
Déterminer les longueurs d'onde de ces deux photons.
Exercice 8 :Données :$h = 6,62\times{10^{-34}} J.s ; c = 3,00\times{10^{8}} m.s^{-1}$ et $e = 1,60\times{10^{-19}}C$
Les lampes à vapeur de lithium contiennent de la vapeur de lithium à très faible pression.
Cette vapeur est excitée par un faisceau d‟électrons qui traverse le tube. Les atomes de lithium
absorbent l'énergie des électrons. L'énergie est restituée lors du retour à l'état fondamental
sous forme de radiations lumineuses.
On représente le diagramme des niveaux d'énergie de l'atome de lithium (figure 1) de
numéro atomique $Z=3$. L'analyse du spectre d'émission d'une lampe à vapeur de lithium
révèle la présence de raies de longueur d'onde $\lambda$ bien définie.
On donne le spectre d'émission et le spectre d'absorption de l'atome de lithium (figure 2).
1- Préciser le spectre d‟émission de l'atome de lithium et le spectre d‟absorption.
2- Représenter le schéma du montage qui permet d'obtenir le spectre d'émission.
3- A l'aide du spectre d'émission, interpréter la quantification de l'énergie de l'atome de lithium.
4- L'énergie du l'état fondamental vaut $E_{1} = -5.39 eV$. (C'est l'énergie de l'électron de la
couche externe dans son état fondamental).
a- Prélever les valeurs des longueurs d'onde $\lambda_{1} ; \lambda_{2}$ et $\lambda_{3}$.
b- Montrer que la longueur d'onde $\lambda$ du photon émis lors d'une transition du niveau $n$ au
niveau $p (n>p)$ est $\lambda= \frac{1241}{ En - Ep}$ avec $\lambda$ en $nm$ et $En – Ep$ en $ev$.
c- trouver les valeurs d'énergie des autres niveaux sachant que la longueur d'onde du photon
émis lors d'une transition du niveau :
.3 au niveau est égale à $812 nm$.
.4 au niveau est égale à $323 nm$.
5- définir l'énergie d'ionisation de l'atome de lithium. Donner sa valeur.
6- L'atome de sodium, considéré maintenant à l'état fondamental, reçoit une radiation
lumineuse dont le quantum d'énergie a une longueur d‟onde $\lambda$ égale à :
a- $220 nm$.
$b- 300nm$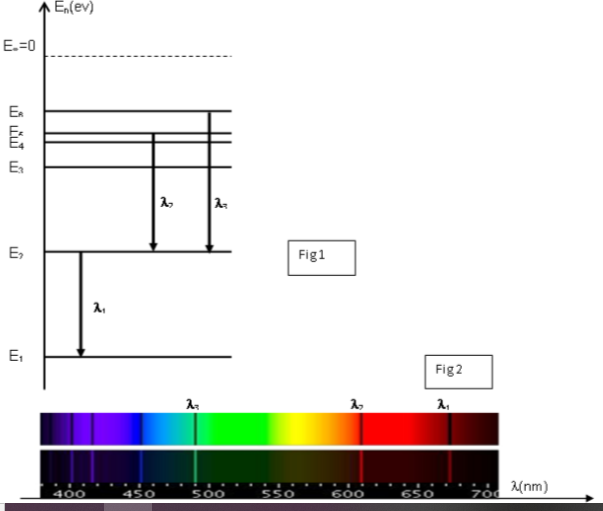
Exercice 9
Dans le spectre d'émission de l'atome d'hydrogène on trouve
les quatre raies suivantes, caractérisées par leur longueur
d'onde :
$\lambda_{1}=410 nm$ (violet),$ \lambda_{2}=434,1 nm$ (indigo),$ \lambda_{3}=486,1 nm$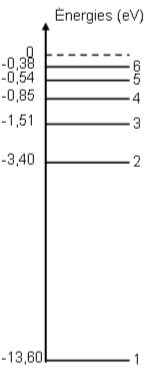
(bleu) et$ \lambda_{4}=656,3 nm$ (rouge). On donne le diagramme des
niveaux d'énergie de l'atome d'hydrogène.
1) Justifier la discontinuité du spectre d‟émission.
a- Que signifie l'état fondamental de l'atome ?
b-Définir l'énergie d'ionisation de l'atome d'hydrogène.
Donner sa valeur.
2) a-Calculer la longueur d'onde maximale $\lambda_{max}$
correspondant à la transition de l'électron d‟un niveau $n>2$
au niveau $2$. Déduire que $\lambda_{max} = \lambda_{4}$.
b-A quelle transition correspond chacune des radiations de
longueur d'onde $\lambda_{1}, \lambda_{2}$ et $\lambda_{3}$.
3) a- L'atome 'hydrogène est dans son niveau d'énergie$ E_{2}
(n=2)$, reçoit un photon incident de longueur d‟onde $\lambda=486.1
nm$. Ce photon est-il absorbé ? justifier sans calcul.
b-L'atome d'hydrogène est dans son état fondamental, reçoit :
. Un photon d‟énergie $11 ev$.
. Un électron incident d'énergie cinétique $11 ev$.
. Un photon d‟énergie $14,3 ev$.
Dire, en le justifiant ce qui se passe dans chaque cas (dans le cas où l'atome est ionisé donner
l'énergie cinétique de l'électron émis).
Exercice 10
Etoile Vega et son spectre L'étoile Véga se trouve dans la constellation de la Lyre. Elle émet de la lumière que l'on
peut décomposer. On obtient un spectre dont voici sa représentation :
La première raie à $x = 0 cm$ correspond à la longueur d'onde $λ=400nm$ et la dernière raie
correspondant à $x=8,5 cm$ est la longueur d'onde $λ=700nm$.
A chaque raie correspond une abscisse $x$ sur l‟axe orienté. La longueur d'onde $λ$ est fonction
affine de $x$ de la forme $λ = ax +b$.
1°/Quelle est la nature du spectre ?
2°/En déduire si l'étoile possède une atmosphère.
3°/Tracer, rapidement, avec seulement $2$ points, $λ$ en fonction de $x$.
4°/En déduire le coefficient directeur de la droite ainsi que son ordonnée à l'origine.
Donner alors l'équation numérique de $λ = ax +b$
5°/A l'aide de l'équation numérique trouver les valeurs des longueurs d'onde émises par l'étoile.
6°/Y-a-t-il de l'hydrogène ou de l'hélium dans l'étoile Véga ? Conclure. Données :
-longueurs d'onde en nm émise par l'élément $H : 398 – 410 – 434-486$
-longueurs d'onde en $nm$ émise par l'élément $He : 380 – 403 – 414-447$
Exercice 11
On donne les spectres de deux éléments, le titane et le nickel, ainsi que le spectre d'une étoile.
Ces spectres ont été réalisés dans les mêmes conditions et les réglages du spectroscope étaient les mêmes.
1) Quel nom donne-t-on aux spectres des deux éléments ?
2) Expliquer l'allure du spectre de l'étoile en utilisant les mots ou les expressions suivantes :
spectre (ou fond) continu ; raies d'absorption.
3) La comparaison du spectre de l'étoile et des spectres de chaque élément permet de faire
uneaffirmation relative à la composition chimique de l'étoile. Laquelle ?

Ajouter un commentaire