Solution des exercices : Électrolyse,bilan quantitatif
Exercice 1
1. Schéma annoté du montage
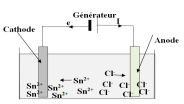
2. Montrons que le bilan est celui d'une oxydoréduction non spontanée.
Le réducteur Cl-du couple $Cl_{2}/Cl^{-}$ de potentiel électrochimique plus élevé ne réagir avec l'oxydant $Sn^{2+}$ le plus faible.
Le bilan est donc est celui d'une oxydoréduction non spontanée.
3. Il y a l'électrolyse lorsque la tension du générateur est supérieure à :
$\begin{array}{rcl} E&=&E^{\circ}\left(Cl_{2}/Cl^{-}\right)-E^{\circ}\left(Sn^{2+}/Sn\right)\\&=&1.36\,V-(-0.14V)\\&=&1.50\,V\end{array}$
4. Réactions aux électrodes :
4.1. Équation de la réaction ayant lieu à l'anode.
$2Cl^{-}\longrightarrow Cl_{2}+2e$
4.2. Équation de la réaction ayant lieu à la cathode.
$Sn^{2+}+2e\longrightarrow Sn$
5. C'est le phénomène de surtension qui « déplace » les couples et conduit à « remplacer » la réduction de l'ion hydrogène $H$ (la réaction prévue) par la réduction de l'ion étain $(II)$
Exercice 2
1. Équations-bilans des réactions possibles aux électrodes
A l'anode il y a oxydation :
$2H_{2}O\longrightarrow O_{2}+4H^{+}+4e$
A la cathode il y a réduction :
$Ag^{+}+e\longrightarrow Ag$
$2H^{+}+2e\longrightarrow H_{2}$
$NO_{3}^{1}+4H+3e\longrightarrow NO+2H_{2}O$
Les réactions qui devraient se produire sont :
$2H_{2}O\longrightarrow O_{2}+4H^{+}+4e$
$NO_{3}^{+}+4H^{+}3e\longrightarrow NO+2H_{2}O$
2. Ce métal se dépose l'électrode appelée cathode
3. Équation-bilan de cette électrolyse.
$\begin{array}{rcl} 4\left(Ag^{+}+e\longrightarrow Ag\right)\\&\Rightarrow& 4Ag^{+}+2H_{2}O\longrightarrow 4Ag+O_{2}+4H^{+}\\ 2H_{2}O\longrightarrow O_{2}+4H^{+}+4e \end{array}$
4. A partir d'une tension $E=E^{\circ}\left(O_{2}/H_{2}O\right)-E^{o}\left(Ag^{+}/Ag\right)=1.23V-0.80V-0.43V$ aux bornes de l'électrolyseur, l'électrolyse se produit
5.1. La quantité de matière d'argent déposé sur une des électrodes
$\begin{array}{rcl} n&=&n_{e}\\&\text{ or }n_{e}F\\&=&It\\&\Rightarrow&n\\&=&\dfrac{It}{F}\\&=&\dfrac{0.80\times 21.0\times 60}{96500}\\&\Rightarrow&n\\&=&0.0104\,mol \end{array}$
5.2. Masse d'argent formée
$\begin{array}{rcl} m&=&nM\\&=&0.0104\times 108\\&\Rightarrow&m\\&=&1.12\,g \end{array}$
6. Détermination le volume de gaz formé (dioxygène) sur l'autre électrode.
$\begin{array}{rcl} V_{o_{2}}&=&n_{o_{2}}V_{m}\\&=&\text{ or }n_{o_{2}}\\&=&\dfrac{n_{Ag}}{4}\\&\Rightarrow&V_{o_{2}}\\&=&\dfrac{n_{Ag}}{4}V_{m}\\&=&\dfrac{0.0104}{4}\times 25\\&\Rightarrow&V_{o_{2}}\\&=&6.5\,mL \end{array}$
Exercice 3
1. Écriture de toutes les réactions pouvant se produire aux électrodes.
$2H_{2}O\longrightarrow O_{2}+4H^{+}+4e$
$2Br^{-}\longrightarrow Br_{2}+2e$
$Na^{+}+e\longrightarrow Na$
2. La réaction la plus facile à réaliser est :
$\begin{array}{rcl} 2H_{2}O\longrightarrow O_{2}+4H^{+}+4e\\ &\Rightarrow& 2H_{2}O+4Na^{+}\longrightarrow O_{2}+4Na+4H^{+}\\ 4\left(Na^{+}+e\longrightarrow Na\right) \end{array}$
3. Écriture de toutes les réactions pouvant se produire aux électrodes
$2H_{2}O\longrightarrow O_{2}+4H^{+}+4e$
$Na^{+}+e\longrightarrow Na$
$SO_{4}^{2-}+4H^{+}+2e\longrightarrow SO_{2}+2H_{2}O$
Pour une solution de sulfate de sodium $\left(Na^{+}, SO_{4}^{2-}\right)$
$\begin{array}{rcl} 2H_{2}O\longrightarrow O_{2}+4H^{+}+4e\\ &\Rightarrow& 2H_{2}O+4Na^{+}\longrightarrow O_{2}+4Na+4H^{+}\\ 4\left(Na^{+}+e\longrightarrow Na\right) \end{array}$
4. Si les électrodes sont en cuivre.
Les demi-équations électroniques :
$2H_{2}O\longrightarrow O_{2}+4H^{+}+4e$
$Na^{+}+e\longrightarrow Na$
$SO_{4}^{2-}+4H^{+}+2e\longrightarrow SO_{2}+2H_{2}O$
$Cu\longrightarrow Cu^{2+}+2e$
Équation – bilan de la réaction :
$\begin{array}{rcl} 2\left(Na^{+}+e\longrightarrow Na\right)\\&\Rightarrow&Cu+2Na^{+}\longrightarrow Cu^{2+}+2Na\\ Cu\longrightarrow Cu^{2+}+2e \end{array}$
Exercice 4
1. Schéma du dispositif.
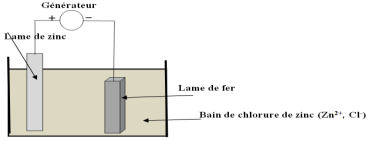
2. Réaction qui s'opère à chaque électrode
$-\ $Oxydation à l'anode $(+)$
$Zn\longrightarrow Zn^{2+}+2e$
$-\ $Réduction à la cathode $(-)$
3. Équation bilan de la réaction d'électrolyse.
$Zn+Zn^{2+}\longrightarrow Zn^{2+}+Zn$
4. La concentration molaire de $\left[Zn^{2+}\right]$ ne varie pas
5. a. Calcul de la masse de zinc correspondante.
$\begin{array}{rcl} m&=&\rho_{zn}V\\&=&\rho_{zn}LIh\\&=&7.14\times 7\times 2.5\times 0.2\\&\Rightarrow&m\\&=&25\,g \end{array}$
b. Calcul de la durée de l'électrolyse si on applique un courant électrique d'intensité $I=0.5\,A$
$\begin{array}{rcl} It&=&n_{e}F\\&\text{ or }n_{e}\\&=&2n\\&=&2\dfrac{m}{M}\\&\Rightarrow&It\\&=&2\dfrac{m}{M}F\\&\Rightarrow&t\\&=&\dfrac{2mF}{MI}\\&=&\dfrac{2\times 25\times 96500 }{65\times 0.5}\\&\Rightarrow&t\\&=&41h14mn \end{array}$
Exercice 5
1. Représentation du schéma du montage électrique de l'électrolyse et précision du sens du courant et du sens de circulation des électrons dans le circuit extérieur
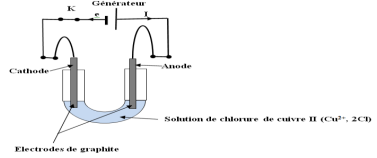
2.a. Demi- équations des transformations aux niveau des électrodes Oxydation à la cathode :
$2Cl^{-}\longrightarrow Cl_{2}+2e$
Réduction à l'anode :
$Cu^{2+}+2e\longrightarrow Cu$
Équation de la réaction bilan de l'électrolyse
$\begin{array}{rcl} Cu^{2+}+2e\longrightarrow Cu\\ 1\Rightarrow&Cu^{2+}+2CI^{-}\longrightarrow Cu+Cl_{2}\\
2Cl^{-}\longrightarrow Cl_{2}+2e \end{array}$
Précisons si cette réaction est spontanée ou imposée.
Cette réaction est une réaction imposée car elle est la réaction inverse de la réaction où l'oxydant du couple le plus fort réagit avec le réducteur le plus fort pour donner l'oxydant et le réducteur les plus faibles
b. L'électrode de droite représente $I'$ anode car c'est la borne positive du générateur .
3. L'électrolyse fonctionne pendant $\Delta t=10\,min$, tel que l'intensité du courant est constante de valeur $I=0.5\,A$
a. Détermination de la quantité d'électricité $Q$ échangée.
$\begin{array}{rcl} Q&=&It\\&=&0.5\times 10\times 60\\&\Rightarrow& Q\\&=&300C \end{array}$
b. Déduction de la quantité d'électricité $Q'$ équivalent à la charge transporté par $n$ moles d'électron qui a circule pendant cette durée (la quantité de matière d'électrons $n_{e})$
$\begin{array}{rcl} Q'&=&Q\\&=&300C \end{array}$
c. Détermination de la relation qui existe entre la quantité de matière du cuivre formé $n(Cu)$ et la quantité de matière ne d'électrons qui a circule pendant la même durée.
$n_{e}=2n_{cu}$
d. Déduction de la masse du cuivre déposée
$\begin{array}{rcl} n_{e}N_{A}e&=&Q'\\&\text{ or }n_{e}\\&=&2n_{cu}\\&=&2\dfrac{m_{Cu}}{M_{Cu}}\\&\Rightarrow&2\dfrac{m_{Cu}}{M_{Cu}}N_{A}e\\&=&Q'\\&\Rightarrow&m_{cu}\\&=&\dfrac{M_{Cu}Q'}{N_{A}e}\\&=&\dfrac{63.5\times 300}{6.02\cdot 10^{23}\times 1.6\cdot 10^{-19}}\\&\Rightarrow&m_{cu}\\&=&197\,mg
\end{array}$
Exercice 6 :
Nickelage d'un objet
Équation de la réaction entre les ions nickel $(II)$ et le cuivre
$\begin{array}{rcl} Ni^{2+}+2e\longrightarrow Ni\\&\Rightarrow&Ni^{2+}+Cu\longrightarrow Cu^{2+}+Ni\\
Cu\longrightarrow Cu^{2+}+2e \end{array}$
b. Cette réaction ne peut s'effectuer naturellement dans le sens direct (règle du « gamma » impossible)
c.1. Oxydations possibles à l'anode :
$2SO_{4}^{2-}\longrightarrow S_{2}O_{8}^{2-}+2e^{-}$
$H_{2O}\longrightarrow 1/2 O_{2}+2H^{+}+2e^{-}$
$Ni\longrightarrow Ni^{2+}+2e^{-}$
Réductions possibles à la cathode :
$2H^{+}+2e^{-}\longrightarrow H_{2}$
$Ni^{2+}+2e^{-}\longrightarrow Ni$
Remarque : l'objet en cuivre à la cathode ne peut pas réagir
c.2. L'électrolyse
la plus facile entre l'oxydant le plus fort $Ni^{2+}$ et le réducteur le plus fort Ni est donc $Ni^{2+}+Ni\longrightarrow Ni+Ni^{2+}$
Elle a lieu à partir d'une tension théorique de $0.00\,V$ imposée par le générateur
c.3. Tout se passe comme si le Nickel de l'anode était transporté sur la cathode.
L'anode va donc se dissoudre progressivement dans la solution et disparaître d'où son nom.
A la cathode où se trouve l'objet on observe la réduction suivante :
$Ni^{2+}+Ni\longrightarrow Ni+Ni^{2+}$ : l'objet va donc se recouvrir de Ni métal.
d. D'après l'équation-bilan, la concentration des ions en solution reste donc inchangée.
e.1. La quantité d'électricité doit traverser l'électrolyseur
$Ni^{2+}+2e\longrightarrow Ni$
$n_{e}=2n_{Cu}=2\dfrac{m}{M}$
$\begin{array}{rcl} Q&=&n_{e}F\\&=&2\dfrac{m}{M}F\\&=&2\times \dfrac{6.23}{58.7}\times 96500\\&\Rightarrow&Q\\&=&20.5\cdot 10^{3}C \end{array}$
e.2. Lla durée de l'électrolyse pour $I=2.0 A$
$\begin{array}{rcl} Q&=&It\\&\Rightarrow&t\\&=&\dfrac{Q}{I}\\&=&\dfrac{20.5\cdot 10^{3}}{2.0}\\&\Rightarrow&t\\&=&10250s\\&\Rightarrow&t\\&=&2h51min \end{array}$
f.f. Variation de masse de l'électrode en nickel
D'après l'équation-bilan, $n(Ni)$ disparue à l'anode $=n(Ni)$ déposée à la cathode d'où m(Ni) disparue à l'anode $=n(Ni)$ déposée à la cathode $=6.23\,g$
Exercice 7
1 -a-Il faut relier l'électrode en graphite à la cathode et l'électrode en cuivre à l'anode
b. La couleur de la solution de sulfate de cuivre est bleue
L'ion responsable de cette coloration l'ion cuivre $Cu^{2+}$
2-Schéma du montage puis indique sur celui-ci l'anode, la cathode
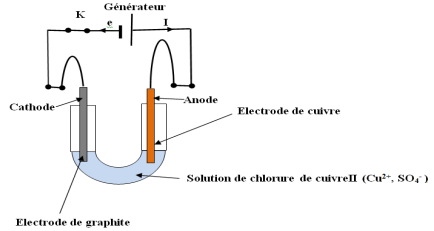
Un certain temps de fonctionnement, on observe :
$-\ $à l'anode, une diminution de masse de l'électrode de cuivre
$-\ $à la cathode, la formation de métal de cuivre sur l'électrode de graphite'
3-a. Il s'agit-il d'une augmentation car, il y a réduction des ions $Cu^{2+}$ en métal cuivre
b. Équation de la réaction qui a lieu
$Cu^{2+}+2e\longrightarrow Cu$
4-a- Variation de masse au bout d'une heure de fonctionnement
$\begin{array}{rcl} \Delta m&=&3\times \dfrac{60}{1}\\&\Rightarrow&\Delta m\\&=&180\,cg \end{array}$
b- On note une variation de masse de $1.2\,g$ à la cathode.
Temps correspondant au déroulement de l'expérience
$\begin{array}{rcl} \Delta m&=&3\times \dfrac{t}{1}\\&\Rightarrow&t\\dfrac{\Delta m}{3}\\&=&\dfrac{1.2\cdot 10^{2}}{3}\\&\Rightarrow&t\\&=&40\,min \end{array}$
Exercice 8
1.a. La formule brute de l'hydroxyde de potassium est :
b. Écriture du bilan de la réaction de dissolution de l'hydroxyde de potassium dans l'eau.
$KOH\longrightarrow\,K^{+}+OH^{-}$
2. Polarités du générateur et sens de déplacement des électrons.
3. La réaction se produisant à l'électrode reliée à la borne positive du générateur est une oxydation car cette borne, déficitaire d'électrons, attire les électrons issus de l'oxydation
$H_{2}O+H^{+}2e\longrightarrow H_{2}+OH^{-}$
4.a. Équation de la réaction électrochimique qui se produit à cette électrode
b. Bilan global de la réaction qui a eu lieu lors de la restauration de ces vestiges
$\begin{array}{rcl} H_{2}O+H^{+}+2e\longrightarrow H_{2}+OH^{-}\\ HO_{2}O+2CI^{-}+H^{+}\longrightarrow H_{2}+Cl_{2}+OH^{-}\\ 2C1^{-}\longrightarrow Cl_{2}+2e \end{array}$

Ajouter un commentaire