Solution des exercices : Classification qualitative des couples oxydant-réducteur ion métalique/métal - 1er s
Classe:
Première
Exercice 1
1) Équation de la réaction qui se produit.
$\begin{array}{ll} Cu^{2+}\ +\ 2e\ \longrightarrow\ Cu&\\&\Rightarrow\;Fe\ +\ Cu^{2+}\ \longrightarrow\ Fe^{2+}\ +\ Cu\\Fe\ \longrightarrow\ Fe^{2+}\ +\ 2e& \end{array}$
$\begin{array}{ll} Cu^{2+}\ +\ 2e\ \longrightarrow\ Cu&\\&\Rightarrow\;Cu^{2+}\ +\ 2Ag\ \longrightarrow\ Cu\ +\ 2Ag^{+}\\2\left(Ag\ \longrightarrow\ Ag^{+}\ +\ e\right)& \end{array}$
2) Précisons les couples redox mis en jeu sont :
$Ag^{2+}/Ag$, $Cu^{2+}/Cu$ et $Fe^{2+}/Fe$
3) Classons les métaux mis en jeu par pouvoir réducteur croissant.
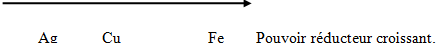
4) L'hydrogène est moins réducteur que le fer ; les ions $H^{+}$ réagissent avec le fer pour donner des ions $Fe^{2+}$ et du dihydrogène si on met du fer dans une solution acide.
Équation de la réaction s'écrit :
$\begin{array}{ll} Fe\ \longrightarrow\ Fe^{2+}\ +\ 2e&\\&\Rightarrow\;Fe\ +\ 2H^{+}\ \longrightarrow\ H_{2}\ +\ Fe^{2+}\\2H^{+}\ +\ 2e\ \longrightarrow\ H_{2}& \end{array}$
Exercice 2
1. Expliquons ce qui s'est passé dans les deux expériences.
Pour l'expérience a ,les ions cobalt $Co^{2+}$ ont oxydés le métal fer.
Pour l'expérience b, les ions hydronium $H^{+}$ ont oxydés le cobalt équations-bilans des réactions
$\begin{array}{ll} Fe\ \longrightarrow\ Fe^{2+}\ +\ 2e&\\&\Rightarrow\;Fe\ +\ Co^{2+}\ \longrightarrow\ Co\ +\ Fe^{2+}\\Co^{2+}\ +\ 2e\ \longrightarrow\ Co& \end{array}$
$\begin{array}{ll} Co\ \longrightarrow\ Co^{2+}\ +\ 2e&\\&\Rightarrow\;Co\ +\ 2H^{+}\ \longrightarrow\ H_{2}\ +\ Co^{2+}\\2H^{+}\ +\ 2e\ \longrightarrow\ H_{2}& \end{array}$
2. Classons qualitativement les trois couples mis en jeu.
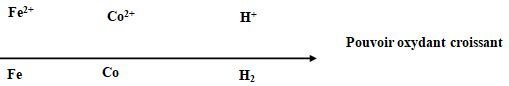
3. Dans la première expérience quelle est La masse de métal formé ?
$\begin{array}{lll} m_{Co}&=&n_{Co}\times M_{Co}\\&=&CV\times M_{Co}\\&=&0.20\times 100\cdot 10^{-3}\times 58.93\\\Rightarrow\;m_{Co}&=&1.18g \end{array}$
Exercice 3
1. Demi-équation du couple rédox qui permet d'expliquer le dépôt de cuivre.
$Cu^{2+}\ +\ 2e\ \longrightarrow\ Cu$
2. Demi-équation du couple rédox qui permet d'où proviennent les électrons de la demi-réaction précédente.
$Ni\ \longrightarrow\ Ni^{2+}\ +\ 2e$
3. Équation bilan de la réaction chimique traduisant le dépôt métallique.
$\begin{array}{ll} Cu^{2+}\ +\ 2e\ \longrightarrow\ Cu&\\&\Rightarrow\;Cu^{2+}\ +\ Ni\ \longrightarrow\ Cu\ +\ Ni^{2+}\\Ni\ \longrightarrow\ Ni^{2+}\ +\ 2e& \end{array}$
Aucun dépôt n'est observé dans l'expérience 2 parce que $Fe^{2+}$ est un oxydant faible pour oxyder la lame de nickel
Exercice 4
I. 1) Précisons la nature du dépôt.
Le dépôt est le cuivre métal
2) Demi équations électroniques représentant les transformations subies par l'ion $Cu^{2+}$ et le zinc $Zn.$
$Cu^{2+}\ +\ 2e\ \longrightarrow\ Cu$
$Zn\ \longrightarrow\ Zn^{2+}\ +\ 2e$
3) Équation bilan de la réaction d'oxydoréduction.
$Cu^{2+}\ +\ Zn\ \longrightarrow\ Cu\ +\ Zn^{2+}$
4) Précisons l'oxydant et le réducteur qui interviennent dans cette réaction.
L'ion $Cu^{2+}$ est l'oxydant ; le zinc est le réducteur
5)
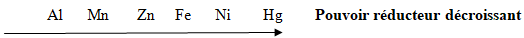
a) Citons les métaux qui peuvent jouer le rôle de « anode sacrificielle ».
Ces métaux sont l'aluminium $(Al)$, le manganèse $(Mn)$ et le zinc $(Zn)$ car plus réducteurs que le fer.
b) Équation bilan de la réaction avec l'une des métaux possible.
$\begin{array}{ll} 3\left(Fe^{2+}\ +\ 2e\ \longrightarrow\ Fe\right)&\\&\Rightarrow\;3Fe^{2+}\ +\ 2Al\ \longrightarrow\ 3Fe\ +\ 2Al^{3+}\\2\left(Al\ \longrightarrow\ Al^{3+}\ +\ 3e\right)& \end{array}$
II. 1) Demi-équations électroniques et l'équation bilan de la réaction.
$2\left(H_{3}O^{+}\ +\ e\ \longrightarrow\ \dfrac{1}{2}H_{2}\ +\ H_{2}O\right)\Rightarrow\;2H_{3}O^{+}\ +\ Zn\ \longrightarrow\ H_{2}\ +\ 2H_{2}O\ +\ Zn^{2+}$
$Zn\ \longrightarrow\ Zn^{2+}\ +\ 2e$
2) a) Calcul de la quantité de matière (nombre de moles) de dihydrogène obtenu.
$\begin{array}{lll} n_{H_{2}}&=&\dfrac{V}{V_{m}}\\\\&=&\dfrac{0.14}{22.4}\\\\\Rightarrow\;n_{H_{2}}&=&6.25\cdot 10^{-3}mol \end{array}$
b) Détermination de la masse de zinc ayant réagi.
$\begin{array}{lll} n_{Zn}&=&n_{Zn}\times M_{Zn}\quad\text{or}\quad n_{H_{2}}=n_{Zn}\\\Rightarrow\;m_{Zn}&=&6.25\cdot 10^{-3}\times 65.4\\\Rightarrow\;m_{Zn}&=&0.409g \end{array}$
3) Détermination de la masse de cuivre contenu dans cet alliage
$\begin{array}{lll} m_{Cu}&=&m-m_{Zn}\\&=&1-0.409\\\Rightarrow\;m_{Cu}&=&0.591g \end{array}$
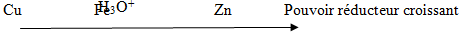
1) Équations des réactions d'oxydoréductions qui se produisent s'il est possible,
a) Quand on plonge une lame de fer dans une solution contenant des ions $Au^{3+}$ il produit une réaction d'oxydoréduction car le zinc moins réductéur réagit les ions $Au^{3+}$ plus oxydant
$\begin{array}{ll} 3\left(Fe^{2+}\ +\ 2e\ \longrightarrow\ Fe\right)\\&\Rightarrow\;Fe^{2+}\ +\ 2Au\ \longrightarrow\ 3Fe\ +\ 2Au^{3+}\\2\left(Au^{3+}\ +\ 3e\ \longrightarrow\ Au\right)& \end{array}$
b) Quand on plonge une lame de zinc dans une solution contenant des ions $Cu^{2+}$, il produit une réaction d'oxydoréduction car le zinc moins réductéur réagit les ions $Cu^{2+}$ plus oxydant
$\begin{array}{ll} Cu^{2+}\ +\ 2e\ \longrightarrow\ Cu\\&\Rightarrow\;Cu^{2+}\ +\ Zn\ \longrightarrow\ Cu\ +\ Zn^{2+}\\Zn\ \longrightarrow\ Zn^{2+}\ +\ 2e& \end{array}$
2. Plaçons le dihydrogène sur l'axe de classification électrochimique ci-dessus.
Exercice 5
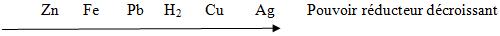
1) Équation de la réaction qui a lieu.
$\begin{array}{ll} Cu^{2+}\ +\ 2e\ \longrightarrow\ Cu&\\&\Rightarrow\;Cu^{2+}\ +\ Fe\ \longrightarrow\ Cu\ +\ Fe^{2+}\\Fe\ \longrightarrow\ Fe^{2+}\ +\ 2e& \end{array}$
2) Calcul de
a) la masse du solide formé.
$\begin{array}{lll} m_{Cu}&=&n_{Cu}\times M_{Cu}\quad\text{or}\quad n_{Cu}=C\times V\\\Rightarrow\;m_{Cu}&=&0.2\times 100\cdot 10^{-3}\times 63.55\\\Rightarrow\;m_{Cu}&=&1.27g \end{array}$
b) la concentration des ions $Fe^{2+}$ dans la solution.
$\begin{array}{lll} C_{Fe^{2+}}&=&\dfrac{m}{MV}\\\\&=&\dfrac{1.12}{55.85\times 100\cdot 10^{-3}}\\\Rightarrow\;C_{Fe^{2+}}&=&0.2mol\cdot L^{-1} \end{array}$
3) a) La réaction qui se produit est la réaction entre le zinc et les ions $Fe^{2+}$
b) Les deux demi-équations électroniques et l'équation bilan de la réaction qui se produit.
$\begin{array}{ll} Zn\ +\ 2e\ \longrightarrow\ Zn^{2+}&\\&\Rightarrow\;Zn\ +\ Fe^{2+}\ \longrightarrow\ Zn^{2+}\ +\ Fe\\Fe^{2+}\ +\ 2e\ \longrightarrow\ Fe& \end{array}$
c) Calcul de la quantité de matière du métal formé (fer).
$\begin{array}{lll} m_{Fe}&=&n_{Fe}\times M_{Fe}\quad\text{or}\quad n_{Fe}=n_{Fe^{2+}}\\&=&C\times V\\\Rightarrow\;m_{Fe}&=&0.2\times 50\cdot 10^{-3}\times 55.85\\\Rightarrow\;m_{Fe}&=&0.56g \end{array}$
La masse du métal attaqué (zinc).
$\begin{array}{lll} m_{Zn}&=&n_{Zn}\times M_{Zn}\quad\text{or}\quad n_{Fe}=n_{Zn}=n_{Fe^{2+}}\\&=&C\times V\\\Rightarrow\;m_{Zn}&=&0.2\times 50\cdot 10^{-3}\times 65.39\\\Rightarrow\;m_{Zn}&=&0.65g \end{array}$
4) a) Montrons qu'il se produit deux réactions d'oxydoréduction.
Le fer et le plomb étant plus réducteurs que le dihydrogène, il se produit donc entre l'acide chlorhydrique et les métaux le plomb et fer.
b) Précisons les deux couples redox pour chaque réaction.
Les deux couples redox sont :
$H_{3}O^{+}/H_{2}\quad$ et $\quad Pb^{2+}/Pb$ ;
$H_{3}O^{+}/H_{2}\quad$ et $\quad Fe^{2+}/Fe$
c) Demi équations électroniques et équations bilan de deux réactions.
$\begin{array}{ll} 2\left(H_{3}O^{+}\ +\ e\ \longrightarrow\ \dfrac{1}{2}H_{2}\ +\ H_{2}O\right)&\\&\Rightarrow\;2H_{3}O^{+}\ +\ Fe\ \longrightarrow\ H_{2}\ +\ 2H_{2}O\ +\ Fe^{2+}\\Fe\ \longrightarrow\ Fe^{2+}\ +\ 2e& \end{array}$
$\begin{array}{ll} 2\left(H_{3}O^{+}\ +\ e\ \longrightarrow\ \dfrac{1}{2}H_{2}\ +\ H_{2}O\right)&\\&\Rightarrow\;2H_{3}O^{+}\ +\ Pb\ \longrightarrow\ H_{2}\ +\ 2H_{2}O\ +\ Pb^{2+}\\Pb\ \longrightarrow\ Pb^{2+}\ +\ 2e& \end{array}$
d) Calcul de la masse de chaque métal du mélange (zinc, plomb et argent).
$\begin{array}{lll} m_{Fe}&=&n_{Fe}\times M_{Fe}\quad\text{or}\quad n_{Fe}=n_{H_{2}}=\dfrac{V}{V_{m}}\\\Rightarrow\;m_{Fe}&=&\dfrac{0.672}{24}\times 55.85\\\Rightarrow\;m_{Fe}&=&1.56g \end{array}$
$\begin{array}{lll} m_{Pb}&=&n_{Pb}\times M_{Pb}\quad\text{or}\quad n_{Pb}=n_{H_{2}}=\dfrac{V}{V_{m}}\\\Rightarrow\;m_{Pb}&=&\dfrac{0.672}{24}\times 207\\\Rightarrow\;m_{Pb}&=&5.8g \end{array}$
Exercice 6

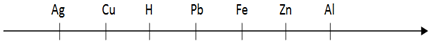
1) Montrons,en se basant sur l'échelle de la classification électrochimique des métaux, que seul le zinc a réagi.
Le zinc, plus réducteur que l'hydrogène peut être oxydé par l'acide chlorhydrique ; contrairement au cuivre plus électropositif ne peut être oxydé par l'acide chlorhydrique.
2) Équation de la réaction entre le zinc $Zn$ et les ions $H_{3}O^{+}.$
$\begin{array}{ll} 2\left(H_{3}O^{+}\ +\ e\ \longrightarrow\ \dfrac{1}{2}H_{2}\ +\ H_{2}O\right)&\\&\Rightarrow\;2H_{3}O^{+}\ +\ Zn\ \longrightarrow\ H_{2}\ +\ 2H_{2}O\ +\ Zn^{2+}\\Zn\ \longrightarrow\ Zn^{2+}\ +\ 2e& \end{array}$
Précisons les couples redox mis en jeu au cours de cette réaction d'oxydoréduction.
Ces couples sont :
$H_{3}O^{+}/H_{2}\quad$ et $\quad Zn^{2+}/Zn$
3) a) Calcul de la quantité de matière de dihydrogène recueillie à la fin de la réaction.
$\begin{array}{lll} n_{H_{2}}&=&\dfrac{V}{V_{m}}\\\\&=&\dfrac{0.9}{22.4}\\\\\Rightarrow\;n_{H_{2}}&=&0.040mol \end{array}$
b) Déduction de la quantité de matière de zinc contenue dans l'échantillon.
$\begin{array}{lll} n_{Zn}&=&n_{H_{2}}\\\Rightarrow\;n_{Zn}&=&0.040mol \end{array}$
4) a) Calcul de la masse du zinc qui a réagi.
$\begin{array}{lll} m_{Zn}&=&n_{Zn}\times M_{Zn}\\&=&0.040\times 65.39\\\Rightarrow\;m_{Zn}&=&2.62g \end{array}$
b) Déduction du pourcentage massique, en zinc et en cuivre, du laiton.
$\begin{array}{lll} \%\;m_{Zn}&=&\dfrac{m_{Zn}}{m}\times 100\\\\&=&\dfrac{2.62}{15}\times 100\\\\\Rightarrow\%\;m_{Zn}&=&17.5 \end{array}$
$\begin{array}{lll} \%\;m_{Cu}&=&100-17.5\\&=&100-\%\;m_{Zn}\\\Rightarrow\%\;m_{Cu}&=&82.5 \end{array}$
Exercice 7
1) Décrivons ce que se passe dans chaque expérience.
a) Lorsqu'on plonge une lame de cuivre dans une solution $\left(Ag^{+}\;,\ NO^{-}_{3}\right)$, les ions $Ag^{+}$, oxydant plus fort, réagissent avec la lame de cuivre, et on observe une coloration bleue caractéristique des ions $Cu^{2+}$
b) Lorsqu'on plonge une lame de cuivre dans une solution $\left(Zn^{2+}\;,\ SO^{2-}_{4}\right)$, on n'observe rien car les ions $Zn^{2+}$ ne peuvent pas oxyder la lame de cuivre.
c) Si on plonge une lame d'aluminium dans une solution $\left(H^{+}\;,\ Cl^{-}\right)$, les ions $H^{+}$, oxydant plus fort, réagissent avec la lame d'aluminium ; et on observe un dégagement du dihydrogène.
2) Équations des réactions possibles
$\begin{array}{ll} Cu\ \longrightarrow\ Cu^{2+}\ +\ 2e&\\&\Rightarrow\;Cu\ +\ 2Ag^{+}\ \longrightarrow\ Cu^{2+}\ +\ 2Ag\\2\left(Ag^{+}\ +\ e\ \longrightarrow\ Ag\right)& \end{array}$
$\begin{array}{ll} 3\left(H_{3}O^{+}\ +\ e\ \longrightarrow\ \dfrac{1}{2}H_{2}\ +\ H_{2}O\right)&\\&\Rightarrow\;3H_{3}O^{+}\ +\ Al\ \longrightarrow\ \dfrac{3}{2}H_{2}\ +\ 3H_{2}O\ +\ Al^{3+}\\Al\ \longrightarrow\ Al^{3+}\ +\ 3e& \end{array}$
Exercice 8
1) a) Identification des produits de la réaction.
Le dépôt gris scintillant qui apparaît sur les grains de fer montre qu'il s'est formé de l'argent métal.
Le précipité vert qui apparaît instantanément montre qu'il s'est également formé des ions $Fe3+$
b) Équations relatives à l'oxydation et à la réduction
$Fe\ \longrightarrow\ Fe^{2+}\ +\ 2e$
$2\left(Ag^{+}\ +\ e\ \longrightarrow\ Ag\right)$
$-\ $Équation bilan de la réaction
$Fe\ +\ 2Ag^{+}\ \longrightarrow\ 2Ag\ +\ Fe^{2+}$
$-\ $Précisons les couples rédox mis en jeu au cours de cette réaction.
Ces couples sont :
$Ag^{+}/Ag\quad$ et $\quad Fe^{2+}/Fe$
2) a) Calcul de la quantité de matière initiale de chacun des réactifs.
$\begin{array}{lll} n_{Ag^{+}}&=&C\times V\\&=&1\times 100\cdot 10^{-3}\\\Rightarrow\;n_{Ag^{+}}&=&0.1mol \end{array}$
$\begin{array}{lll} n_{Fe}&=&\dfrac{m}{M}\\\\&=&\dfrac{2.24}{55.85}\\\\\Rightarrow\;n_{Fe}&=&0.04 \end{array}$
b) Les réactifs ne sont pas en proportions stœchiométriques
$\begin{array}{lll} \dfrac{n_{Ag^{+}}}{2}&=&\dfrac{0.1}{2}\\\\&=&0.05mol\succ\dfrac{n_{Fe}}{1}=0.04mol \end{array}$
Le fer est le réactif limitant.
c) Calcul, à la fin de la réaction :
$-\ $la concentration molaire des ions présents dans la solution.
$\begin{array}{lll} C_{Fe^{2+}}&=&\dfrac{n_{Fe}}{V}\\\\&=&\dfrac{0.04}{100\cdot 10^{-3}}\\\\\Rightarrow\;C_{Fe^{2+}}&=&0.4 \end{array}$
$-\ $la masse du dépôt métallique formé $(Ag).$
$\begin{array}{lll} m_{Ag}&=&n_{Ag}\times M_{Ag}\\&=&2n_{Fe}\times M_{Ag}\\&=&2\times 0.04\times 107.87\\\Rightarrow\;m_{Ag}&=&8.63g \end{array}$
3) Comparons les pouvoirs réducteurs de $Fe$, $Ag$ et $H.$
Une solution d'acide chlorhydrique réagit avec le fer mais elle est sans action sur l'argent.
Le fer est réducteur que l'hydrogène ; par contre l'argent est donc moins réducteur.
D'où ce classement

Exercice 9
l) a) interprétation des expériences
$\blacktriangleright\ $Dans la première partie $\left(S_{1}\right)$, lorsqu'on place une lame d'argent, on obtient un dépôt d'or.
L'oxydant $Au^{3+}$ du couple $Au^{3+}/Au$, dont le potentiel électrochimique plus élevé, réagit avec le réducteur $Ag$ du couple $Ag^{+}/Ag$ pour donner un dépôt d'or
$\blacktriangleright\ $Dans la deuxième partie $\left(S_{2}\right)$, lorsqu'on met une lame de cuivre, On obtient un dépôt d'argent et d'or.
Les oxydants $Au^{3+}$ et $Ag^{+}$ des couples $Au^{3+}/Au$ et $Ag^{+}/Ag$, dont les potentiels électrochimique plus élevés, réagissent avec le réducteur $Cu$ pour donner un dépôt d'argent et d'or.
$\blacktriangleright\ $Dans la troisième partie $\left(S_{3}\right)$, lorsqu'on met une lame de zinc, on obtient un dépôt d'argent et d'or.
Les oxydants $Au^{3+}$, $Ag^{+}$ et $Cu^{2+}$ des couples $Au^{3+}/Au$, $Ag^{+}/Ag$ et $Cu^{2+}/Cu$, dont les potentiels électrochimique plus élevés, réagissent avec le reducteur $Zn$ pour donner un dépôt d'argent, d'or et de cuivre
b) Équations des réactions dans $\left(S_{1}\right)$ et $\left(S_{2}\right)$, en précisant à chaque fois l'oxydant et le réducteur
$\begin{array}{ll} Au\ \longrightarrow\ Au^{3+}\ +\ 3e&\\&\Rightarrow\;Au\ +\ 3Ag^{+}\ \longrightarrow\ Au^{3+}\ +\ 3Ag\\3\left(Ag\ \longrightarrow\ Ag^{+}\ +\ e\right)& \end{array}$
$Au^{3+}$ et $Ag$ sont respectivement l'oxydant et le réducteur
$\begin{array}{ll} Cu\ \longrightarrow\ Cu^{3+}\ +\ 2e&\\&\Rightarrow\;Cu\ +\ 2Ag^{+}\ \longrightarrow\ Cu^{2+}\ +\ 2Ag\\2\left(Ag^{+}\ +\ e\ \longrightarrow\ Ag\right)& \end{array}$
$\begin{array}{ll} 3\left(Cu\ \longrightarrow\ Cu^{2+}\ +\ 2e\right)&\\&\Rightarrow\;3Cu\ +\ 2Au^{3+}\ \longrightarrow\ 3Cu^{2+}\ +\ 2Au\\2\left(Au^{3+}\ +\ 3e\ \longrightarrow\ Au\right)& \end{array}$
$Au^{3+}$, $Ag^{+}$ et $Cu$ sont respectivement les oxydants et le réducteur.
c) Déduction d'une classification électrochimique des métaux utilisés.
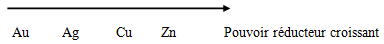
2) Calcul des molarités des ions $Cu^{2+}$, $Ag^{+}$, $Au^{3+}$ et $NO_{3}^{-}$ dans la solution $(S).$
$\begin{array}{lll} C_{Cu^{2+}}&=&\dfrac{m_{3}-m_{2}}{M_{Cu}V}\\&=&\dfrac{1.188-0.934}{63.5\times 300\cdot 10^{3}}\\\Rightarrow\;C_{Cu^{2+}}&=&0.013mol\cdot L^{-1} \end{array}$
$\begin{array}{lll} C_{Ag^{+}}&=&\dfrac{m_{2}-m_{1}}{M_{Ag}V}\\&=&\dfrac{0.934-0.394}{108\times 300\cdot 10^{3}}\\\Rightarrow\;C_{Ag^{+}}&=&0.017mol\cdot L^{-1} \end{array}$
$\begin{array}{lll} C_{Au^{3+}}&=&\dfrac{m_{1}}{M_{Au}V}\\&=&\dfrac{0.394}{197\times 300\cdot 10^{3}}\\\Rightarrow\;C_{au^{3+}}&=&0.0067mol\cdot L^{-1} \end{array}$
$\begin{array}{lll} C_{NO_{3}^{-}}&=&\left(\dfrac{3m_{1}}{M_{Au}}+\dfrac{2\left(m_{3}-m_{2}\right)}{M_{Cu}}+\dfrac{m_{2}-m_{1}}{M_{Ag}}\right)\dfrac{1}{V}\\\\&=&\left(\dfrac{3\times 0.394}{197}+\dfrac{2(1.188-0.934)}{63.5}+\dfrac{0.934-0.394}{108}\right)\\\\\Rightarrow\;C_{NO_{3}^{-}}&=&0.063mol\cdot L^{-1} \end{array}$

Ajouter un commentaire