Solution des exercices : Les composés oxygènes
Exercice 1
Exercice 2
1. Complétons le tableau suivant :
$\begin{array}{|c|c|c|} \hline \text{Fonction }&\text{Groupe caractéristique}&\text{ Nom du groupe caractéristiqu }\\ \hline \text{Cétone }&-C-CO-C-&\text{Cabonyle }\\ \hline \text{Acide }&-COOH&\text{Carboxyde }\\ \hline \text{Alcool }&-C-OH&\text{Alcool }\\ \hline \text{Aldéhyde }&-CHO&\text{Carbonyle }\\ \hline \text{Ester }&-C-CO-O-C-&\text{Ester }\\ \hline \end{array}$
2 - Nommons les composés suivants et précisons la classe si c'est un alcool,
$CH_{3}-CHOH-CH_{2}-CH_{3}$ : Butan -$2$-ol Classe $II$
$CH_{3}-CH_{2}-CHOH-CH_{2}-CH_{3}$ : pentan $-3-ol$
Classe $II$
$CH_{3}-CH_{2}-CH\left(CH_{3}\right)-COOH$ : Acide $2$-méthylbutanoique
$CH_{3}-CH_{2}-CHO$ : Propanal
$CH_{3}-CO- CH_{2}-CH_{2}$ Butan-$2$-one ou butanone
$CH_{3}-CH_{2}-CH_{2}-CH_{2}-CO-O-CH_{2}-CH_{3}$
Pentanoate d'éthyle
Exercice 3
1. Le groupe hydroxyle caractérise un alcool
Un aldéhyde et une cétone sont caractérisés par le groupe carbonyle
2. Formule semi-développée des corps suivants et leur groupe fonctionnel auquel ils appartiennent
a. $CH_{3}OH$ : alcool
b. $CH_{3}COCH_{2}-CH_{3}$ : cétone
c. $CH_{3}-CH_{2}-CH_{2}-COOH$ acide
d. $CH_{3}-CH_{2}-CH_{2}-COO-CH_{3}$ : ester
e. $CH_{3}-CH_{2}-CH_{2}-CHO$ : aldéhyde
f. $CH_{3}CHOH-CH_{2}-CH_{2}-CH_{3}$ : alcool
g. $CH_{3}-COH\left(CH_{3}\right)-CH_{3}$ : alcool
h. $CH_{3}-CH\left(CH_{3}\right)-COOH$ : acide carboxylique
i. $CH_{3}-CH_{2}-CO-CH_{2}-CH_{3}$ : cétone
j. $CH_{3}-CH_{2}-CH_{3}-COO-CH_{2}H_{5}$
3. Famille à laquelle appartiennent les composés organiques et leur nom :
$CH_{3}-CH_{2}-CH_{2}-CH_{2}-CH_{2}CHOH-CH_{3}$ : alcool ; octan $-2-$ ol
$CH_{3}-CH_{2}-CH_{2}-CH_{2}-CH_{2}COOH$ : acide carboxylique ; acide pentanoique
$CH_{3}-CH_{2}-CO-CH_{2}-CH_{2}-CH_{3}$ :
: cétone; hexan $-2-$ one
$CH_{3}-COH\left(CH_{3}\right)-CH_{3}$ :
alcool; $2$-méthylpropan $-2-$ ol
$CH_{3}-CH_{2}-CH_{2}-CH\left(C_{2}H_{5}\right)-CO-CH_{3}$ : céton ; $3-$éthylhéxan $-2-$ one
$CH_{3}-CH_{2}-CH_{2}-CH\left(C_{2}H_{5}\right)-CH_{2}OH$ :alcool ; $2-$ éthylpentan
Exercice 4:
Étiquetage imprécis
1. Montrons que la formule brute $C_{3}H_{8}O$ conduit à deux formules semi-développées.
Le test avec la $2.4-DNPH$ est positif, le composé $A$ est un alcool de formules semi-développées.
$CH_{3}-CH-CH_{2}OH$
$CH_{3}-CHOH-CH_{3}$
2. Nom de deux isomères, groupe caractéristique et classe.
$CH_{3}-CH-CH_{2}OH$
$CH_{3}-CHOH-CH_{3}$
Propan-$1$ -ol ; classa $I$
Proban $-2$ ol, classe $II$
Le groupe caractéristique est le groupe hydroxyle
3. Le groupe caractéristique est mis en évidence dans les produits de l'oxydation de A est la cétone
Un test positif avec la $2.4-DNPH$ met en évidence les composés carbonylés c'est-à-dire les aldéhydes et les cétones.
Le composé est une cétone lorsque le test est négatif avec la liqueur de Felhing.
4. Formule semi-développée du composé $A$
Le composé $A$ est un alcool secondaire dont l'oxydation donne une cétone
5. Le composé obtenu le propène
Équation bilan de la réaction.
$CH_{3}-CHOH-CH_{3}\longrightarrow CH_{2}=CH-CH_{3}+H_{2}O$
Exercice 5 Identification de composés oxygénés
1. Ces données ne sont pas suffisantes pour identifier les cinq composés en particulier $C$ ou $D$
Elles permettent d'identifier seulement $A$ comme alcool primaire, $B$ comme alcool secondaire et $E$ une cétone
2. Le composé $C$ réagit avec la liqueur de Fehling.
$C$ est donc un aldéhyde de formule semi-développée : $CH_{3}-CH_{2}CHO$ propanal
$D$ est un acide carboxylique : $CH_{3}-CH_{2}-COOH$ : acide propanoique
B : $CH_{3}-CHOH-CH_{3}$ : propan -$2$- ol
E : $CH_{3}-CO-CH_{3}$ : propanone
A : $CH_{3}-CH_{2}-CH_{2}OH$ : propan-l-ol
Exercice 5
1. Exprimons la formule brute de l'alcool en fonction de $n$
La formule brute de l'alcool $A$ en fonction de $n$ : $C_{n}H_{2n+2}O$
2. Expression de la masse molaire de $A$ en fonction de $n$
$\begin{array}{rcl} M_{C_{n}}H_{2n+2}O&=&12n+2n+2+16\\&=&14n+18 \end{array}$
3.1. Détermination de la valeur de $n$ et la formule brute de $A$
$\begin{array}{rcl} \dfrac{M_{C_{n}H_{2n+2}O}}{100}&=&\dfrac{16}{P(O)}\\&\Rightarrow&\dfrac{14n+18}{100}\\&=&\dfrac{16}{26.7}\\&\Rightarrow&26.7\times (14n+18)\\&=&16\times 100\\&\Rightarrow&373.8n+480.6\\&=&1600\\&\Rightarrow&373.8n\\&=&1600-480.6\\&\Rightarrow&n\\&=&\dfrac{1119.4}{373.8}\\○&\Rightarrow&n\\&=&3\\&\Rightarrow&C_{3}H_{8}O \end{array}$
Formules semi-développées possibles pour $A.$
$CH_{3}-CH_{2}-CH_{2}OH$ et $CH_{3}-CHOH-CH_{3}$
3.2..Identification de A sachant que c'est un alcool primaire.
A est le propan $-1-$ ol de formule semi-développée : $CH_{3}-CH_{2}-CH_{2}OH$
Exercice 7
1. Détermination de la formule brute composé organique
$\begin{array}{rcl} \%O&=&100-\left(\%C+\%H\right)\\&=&100-(60+13.3)\\&\Rightarrow&\%O\\&=&26.7 \end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{y}{\%H}\\&=&\dfrac{14z}{\%O}\\&=&\dfrac{M}{100} \end{array}$
$\begin{array}{rcl} \dfrac{12x}{\%C}&=&\dfrac{M}{100}\\&\Rightarrow&x\\&=&\dfrac{\%C\times M}{12\times 100}\\&=&\dfrac{60\times 60}{12\times 100}\\&\Rightarrow&x\\&=&3 \end{array}$
$\begin{array}{rcl} \dfrac{y}{\%O}&=&\dfrac{M}{100}\\&\Rightarrow&z\\&=&\dfrac{M\times\%O}{100\times 16}\\&=&\dfrac{60\times 13.3}{100}\\&\Rightarrow&y\\ &=&8 \end{array}$
$\begin{array}{rcl} \dfrac{16z}{\%O}&=&\dfrac{M}{100}\\&\Rightarrow&z\\&=&\dfrac{M\times \%O}{100\times 16}\\&=&\dfrac{60\times 26.7}{100\times 16}\\&\Rightarrow&z\\&=&1 \end{array}$
La formule brute est donc : $C_{3}H_{8}O$
2.1. Équation de la réaction
$C_{3}H_{4}O+4O_{2}\longrightarrow 3CO_{2}+2H_{2}O$
2.2. Calcul de la masse de carbone et d'hydrogène dans cet échantillon.
$\begin{array}{rcl} \dfrac{m_{c}}{3M_{c}}&=&\dfrac{m_{C_{3}H_{4}O}}{m_{C_{3}H_{4}o}}\\1\Rightarrow&m_{c}\\&=&\dfrac{m_{C_{3}H_{4}O}\times 3M_{c}}{M_{C_{3}H_{4}O}}\\&=&\dfrac{1.2\times 4\times 12}{60} \\&\Rightarrow&m_{c}\\&=&0.72\,g \end{array}$
$\begin{array}{rcl} \dfrac{m_{H}}{4M_{H}}1+1\dfrac{m_{c_{3}H_{4}O}}{M_{C_{3}H_{4}O}}\\&\Rightarrow&m_{H}\\&=&\dfrac{m_{C_{3}H_{4}O}\times 4M_{H}}{M_{C_{3}H_{4}O}}\\&=&\dfrac{1.2\times 4\times 1}{60}\\&\Rightarrow&m_{H}\\&=&0.08\,g \end{array}$
2.3. Déduisons la masse d'eau et le volume de dioxyde de carbone obtenus lorsque la réaction est terminée
D'après le bilan molaire :
$\begin{array}{rcl} \dfrac{m_{H_{2}o}}{2M_{H_{2}o}}&=&\dfrac{m_{C_{3}H_{4}O}}{M_{C_{3}H_{4}O}}\\&\Rightarrow&m_{H_{2}o}\\&=&\dfrac{m_{C_{3}H_{4}O}}{M_{C_{3}H_{4}O}}\\&\Rightarrow&m_{H_{2}o}\\&=&\dfrac{m_{C_{3}H_{4}O}\times 2M_{H2O}}{M_{C_{3}H_{4}O}}\\&=&\dfrac{1.2\times 18}{60}\\&\Rightarrow&m_{H_{2}o}\\&=&0.72\,g \end{array}$
$\begin{array}{rcl} \dfrac{m_{H}}{4M_{H}}&=&\dfrac{m_{C_{3}H_{4}O}}{M_{C_{3}H_{4}O}}\\&\Rightarrow&m_{H}\\&=&\dfrac{m_{C_{3}H_{4}O}\times 4M_{H}}{M_{C_{3}H_{4}O}}\\&=&\dfrac{1.2\times 4\times 1}{60}\\&\Rightarrow&m_{H}\\&=&0.08\,g \end{array}$
2.3. Déduisons la masse d'eau et le volume de dioxyde de carbone obtenus lorsque la réaction est terminée.
D'après le bilan molaire :
$\begin{array}{rcl} \dfrac{V_{co_{2}}}{3V_{m}}&=&\dfrac{m_{C_{3}H_{4}O}}{M_{C_{3}H_{4}O}}\\&\Rightarrow&V_{CO_{2}}\\&=&\dfrac{m_{C_{3}H_{4}O}\times 3V}{M_{C_{3}H_{4}O}}\\&=&\dfrac{1.2\times 3\times 24}{60}\\&\Rightarrow& V_{co_{2}}\\&=&1.44\,L \end{array}$
3. Formules semi développées possibles du composé.
$CH_{3}-CH_{2}-CH_{2}OH_{2}OH$ ;
$CH_{3}-CHOH-CH_{3}$ ;
$CH_{3}-CH_{2}-O-CH_{3}$
Exercice 8
1. Montons que leur formule brute est $C_{4}H_{10}O$
$\begin{array}{rcl} M_{C_{n}H_{2n+2}O}&=&12n+2n+2+16\\&=&14n+18\\&=&74\\&\Rightarrow&14n\\&=&74-18\\&\Rightarrow&n\\&=&\dfrac{56}{14}\\&=&4\\&\Rightarrow&C_{4}H_{10}O \end{array}$
2.1. Précisons en le justifiant la classe de chacun des alcools $\left(A_{1}\text{ et }A_{2}\right)$
$A_{1}$ ne donne rien lors son oxydation ménagée par une solution de bichromate de potassium acidifiée, $A_{1}$ est
un alcool tertiaire de classe $III$
$A_{2}$ donne un composé $B_{2}$ qui donne un test positif avec la $D.N.P.H$ et un test négatif avec le réactif de Schiff.
$A_{2}$ est un alcool secondaire de classe $II$
2.2. Formule semi développée et le nom de $B_{2}$
$B_{2}$ est une cétone de formule semi développée : : Butanone
2.3. Formule semi développées et le nom de $A_{1}$ et $A_{2}$
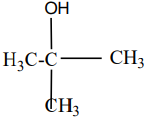
$CH_{3}-CHOH-CH_{2}-CH_{3}$
$A_{1}$ : Méthylpropan-$2$-ol
$A_{2}$ : Butan-$2$-ol
3.1. Équation de la réaction en utilisant les formules semis développées.
$\begin{array}{rcl} CH_{3}-CHOH\left(CH_{3}\right)-CH_{3}\\&\Rightarrow&CH_{3}\\&=&CH\left(CH_{3}\right)-CH_{3}+H_{2}O \end{array}$
3.2. Précisons le nom de $C_{1}$ et dire, comment on peut l'identifier ?
$CH_{3}=CH\left(CH_{3}\right)-CH_{3}$ : Méthylpropène
On peut identifier le composé organique $C_{1}$ qui est un alcène qui décolore l'eau de brome
Exercice 9
1.a. Équation de combustion.
$\begin{array}{rcl} C_{n}H_{2n+2}O+\dfrac{3n}{2}O_{2}\\&\Rightarrow&nCO_{2}+(n+1)H_{2}O \end{array}$
Formule brute de l'alcool.
D'après le bilan molaire :
$\begin{array}{rcl} n_{C_{n}H_{2n+2}O}&=&\dfrac{n_{CO_{2}}}{n}\\&=& \dfrac{V_{CO_{2}}}{V_{M}n}\\&\Rightarrow&n\\&=&\dfrac{V_{CO_{2}}}{V_{M^{n}C_{n}H_{2n+2}O}}\\&=&\dfrac{6.72}{22.4\times 0.1}\\&\Rightarrow&n\\&=&3\\&\Rightarrow&C_{3}H_{8}O \end{array}$
b. Formule semi-développée et nom des isomères possibles
$CH_{3}-CH_{2}-CH_{2}OH$ : propan -$ol$ ;
$CH_{3}-CHOH-CH_{3}$ : propan -$2$-$ol$
2.a. Une solution de $DNPH$ permet de mettre en évidence les composés carbonylés (aldéhydes et cétones) ;
tandis que la solution de liqueur de Fehling permet de tester les aldéhydes
b. En utilisant ces réactifs, on peut identifier sans ambiguïté l'alcool $A$
3.a. L'alcool $A$ a été obtenu par hydratation du propène
b. Cette hydratation conduit à plusieurs des isomères trouvés à la question $1^{\circ}$
Équations chimiques de cette hydratation.
$\begin{array}{rcl} CH_{3}-CH&=&CH_{2}H_{2}O\\&\Rightarrow&CH_{3}-CH_{2}-CH_{2}OH \end{array}$
$\begin{array}{rcl} CH_{3}-CH&=&CH_{2}+H_{2}O\\&\Rightarrow&CH_{3}-CHOH-CH_{3} \end{array}$
Exercice 10
1. On prépare un alcool $A$ par addition d'eau sur un alcène $B$ de formule brute $C_{n}H_{2n}$
Équation de la réaction.
$C_{n}H_{2n}+H_{2}O\longrightarrow C_{n}H_{2n+2}O$
2. La combustion complète de $m(g)$ de $A$ donne une masse $m_{1}(g)$ de dioxyde de carbone et une $m_{2}(g)$ d'eau telles que
$\dfrac{m_{1}}{m_{2}}=\dfrac{11}{6}$
2.1. Équation de la réaction de combustion de $A$
$\begin{array}{rcl} C_{n}H_{2n+2}O+\dfrac{3n}{2}O_{2}\\&\Rightarrow&nCO_{2}+(n+1)H_{2}O \end{array}$
2.2. Déduction de la valeur de $n$ et formules brutes de $A$ et $B$
D'après le bilan molaire :
$\begin{array}{rcl} \dfrac{n_{1}}{n}&=&\dfrac{n_{2}}{n+1}\\&\Rightarrow&\dfrac{m_{1}}{M_{1}n}\\&=&\dfrac{m_{2}}{M_{2}(n+1)}\\&\Rightarrow&\dfrac{m_{1}}{m_{2}}\\&=&\dfrac{M_{1}n}{M_{2}(n+1)}\\&=&\dfrac{11}{6}\\&=&\dfrac{44n}{18(n+1)}\\&\Rightarrow&44n\times 6\\&=&11\times 18(n+1)\\&\Rightarrow&264n\\&=&198n+198\\&\Rightarrow&\\&\Rightarrow&\dfrac{m_{1}}{M_{1}n}\\&=&\dfrac{m_{2}}{M_{2}(n+1)}\\&\Rightarrow&\\&=&\dfrac{11}{6}\\&=&\dfrac{44n}{18(n+1)}\\&\Rightarrow&44n\times 6\\&=&11\times 18(n+1)\\&\Rightarrow&264n\\&=&198n+198\\&\Rightarrow&264n-198n\\&=&198\\&\Rightarrow&66n\\&=&198\\&\Rightarrow&n\\&=&\dfrac{198}{66}\\&=&3\\&\text{ d'où }A\ :\ C_{3}H_{8}O\ ; B\ :\ C_{3}H_{6}\end{array}$
2.3. Formules semi-développées de $A$ et $B$
$A\ :\ \left\lbrace\begin{array}{rcl} CH_{3}-CH_{2}-CH_{2}OH\quad B\ :\ CH_{3}-CH=CH_{2}\\ CH_{3}-CHOH-CH_{3} \end{array}\right.$
3. Nom des produits $A$ et $A'$
A : $CH_{3}-CH_{2}-CH_{2}OH$ : propan $-1-ol$ $A'\ :\ CH_{3}-CH-CHO$ : propanal
Exercice 11
1. Détermination de la formule brute de l'alcool.
$\begin{array}{rcl} M_{C_{n}H_{2n+2}O}&=&12n+2+16\\&=&14n+18\\&=&74\\&\Rightarrow&14n\\&=&74-18\\&\Rightarrow&n\\&=&\dfrac{56}{14}\\&=&4\\&\Rightarrow&C_{4}H_{10}O \end{array}$
2- Formule semi-développée, le nom et la classe des alcools isomères correspondant à cette formule brute.
$CH_{3}-CH_{2}-CH_{2}-CH_{2}OH$ : Butan $-1-ol$ ; $CH_{3}-CH_{2}-CHOH-CH_{3}$ : Butan $-2-ol$ ;
$CH_{3}-C\left(CH_{3}\right)OH-CH_{3}$ : Méthylpropan $-2-ol$ ; $CH_{3}-CH_{2}OH$ : Méthylpropan $-1-ol$
3.3.a. On peut identifier l'isomère $A$ qui l'alcool tertiaire .
Les alcools ne peuvent pas subir d'oxydation.
3-b. Un test positif à la $2.4-D.N.P.H$ met en évidence les aldéhydes et les cétones
Il n'est pas suffisant pour identifier $D$ et $F$
3.c. Un test positif au réactif de Schiff met en évidence les aldéhydes
3.d. Déduction de la fonction chimique des composés $D$, $E$ et $F$
$D$ est une cétone ; $E$ est un acide carboxylique ; $F$ est un aldéhyde.
Identification des alcools $B$ et $C$ sachant que l'alcool $C$ possède une chaine ramifiée
;
Exercice 12
1. Montrons que l'on peut prévoir théoriquement la formation de deux alcools $\left(A_{1}\right)$ et $\left(A_{2}\right)$
$CH_{3}-CH=CH_{2}+H_{2}O\longrightarrow_{\lim\limits H_{2}}\left\lbrace\begin{array}{rcl} CH_{3}-CH-CH_{2}OH :\text{propan}-1-ol\ ;\ \text{Classe }I\\ CH_{3}-CHOH-CH_{3} \text{propan}-2-ol ; \text{Classe }II \end{array}\right.$
2.1. Fonction chimique, nom et formule sémi-développée du produit $\left(B_{2}\right)$
$\left(B_{2}\right)$ rosit le réactif de Schiff.
$\left(B_{2}\right)$ est donc un aldéhyde
2.2. Identification de l'alcool $\left(A_{2}\right)$ $\left(A_{2}\right)$ est un alcool primaire ; son oxydation a conduit à la formation de l'aldéhyde $\left(B_{2}\right)$
2.3. Identification de l'alcool $\left(A_{1}\right)$
$\left(A_{1}\right)$ est un alcool secondaire
Fonction chimique, nom et formule sémi-développée du produit $\left(B_{1}\right)$
$\left(B_{1}\right)$ est une cétone le propanone de formule semi-développée
3.1. Il s'agit du propan $-1-ol$ dont l'oxydation ménagée avec un excès d'oxydant conduit à l'acide carboxylique
3.2. Nom et formule sémi-développée de l'acide $(C)$ obtenu
Exercice 13
1- Formule bute de ce composé
Équation de la réaction
$C_{x}H_{y}O_{z}+\left(x+\dfrac{y}{4}-\dfrac{y}{4}-\dfrac{z}{2}\right)O_{2}\longrightarrow xCO_{2}+\dfrac{y}{2}H_{2}O$
D'après le bilan molaire :
$\begin{array}{rcl} n&=&\dfrac{n_{CO_{2}}}{x}\\&=&\dfrac{n_{H_{2}O}}{\dfrac{y}{2}}\\&\Rightarrow&\dfrac{m}{M}\\&=&\dfrac{m_{co_{2}}}{xM_{co_{2}}}\_\\&=&\dfrac{2m_{H_{2}O}}{yM_{H_{2}O}}\\&\Rightarrow&\left\lbrace\begin{array}{rcl} x&=&\dfrac{m_{CO_{2}}\times M}{M_{CO_{2}}\times m}&=&\dfrac{3.52\times 74}{44\times 1.48}&=&4 \\y&=&\dfrac{2m_{H_{2}O}\times M}{M_{H_{2}O}\times m}&=&\dfrac{2\times 1.8\times 74}{18\times 1.48}&=&10 \end{array}\right. \end{array}$
$\begin{array}{rlc} M_{C_{x}H_{y}O_{z}}&=&12x+y+16z\\&=&74\\&\Rightarrow&12\times 4+10+16z\\&=&74\\&\Rightarrow&16z\\&=&16\\&\Rightarrow&z\\&=&1\\&\Rightarrow&C_{4}H_{10}O \end{array}$
2- Ce composé peut être obtenu par addition d'eau sur un hydrocarbure $A$
2.1 Cet hydrocarbure $A$ appartient à la famille des alcènes
Formule brute de $A$ :
2.2- Isomères de A et identification des isomères présentant une isomère $Z-E$
$CH_{3}-CH_{2}-CH=CH_{2}$
$CH_{3}-CH=CH-CH_{3}$
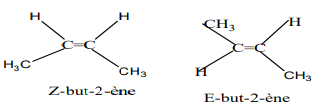
2.3- Règle de Markovnikov
Lors de l'addition d'eau sur un alcène dissymétrique, l'hydrogène se fixe sur le carbone le plus hydrogéné
Identification des composés $A$ qui respectent cette règle
$CH_{3}-CH_{2}-CH=CH_{2}$ ;
$CH_{3}-C\left(CH_{3}\right)=CH_{2}$
Application de cette règle dans l'addition du chlorure d'hydrogène sur un isomère de $A$
$CH_{3}-CH_{2}-CH=CH_{2}H_{2}O\longrightarrow\left\lbrace\begin{array}{rcl} CH_{3}-CH_{2}-CH_{2}-CH_{2}OH\\ CH_{3}-CH_{2}-CHOH-CH_{3} \end{array}\right.$
3.1- Le composé $B$ appartient à la famille des alcynes
3.2- Équation – bilan de la réaction d'hydrogénation de $B$ donnant $A$
$\begin{array}{rcl} CH_{3}-CH_{2}-C&\equiv&CH+H_{2}\longrightarrow_{\lim\limits Pd}CH_{3}-CH_{2}-CH=CH_{2} \end{array}$
Le catalyseur utilisé est le palladium désactivé
3.3- L'hydrocarbure obtenu est l'alcane si l'hydrogénation de B a lieu en présence de nickel comme catalyseur.
Équation – bilan de cette réaction.
$\begin{array}{rcl} CH_{3}-CH_{2}-C&\equiv&CH+2H_{2}\longrightarrow_{\lim\limits Ni}CH_{3}-CH_{2}-CH=CH_{2}
\end{array}$

Ajouter un commentaire