Série d'exercices sur la Structure de la matière - 4e
Classe:
Quatrième
Exercice 1
Compléter le texte suivant en ajoutant les mots ou groupes de mots manquants.
La matière a une structure ....... Parmi les corps purs on note des corps moléculaires dont la particule élémentaire est la ....... qui est constituée d' .........
Chaque type d'atome est appelé .......; on le représente par un ....... chimique.
Un atome qui perd des électrons est appelé ....... alors que celui qui en gagne est dit......
Exercice 2
La plus petite partie d'un corps pur est appelée :
$-\ \ $ Molécule
$-\ \ $ Élément
$-\ \ $ Symbole
Exercice 3
Soient les formules chimiques suivantes :
1) $CH_{4}$
2) $O_{2}$
3) $NaOH$
Donner les noms des éléments chimiques contenus dans chaque corps purs. Donner le nombre d'atomes de chaque élément
Exercice 4
Soient les formules chimiques suivantes :
$N_{2}\;;\ CO_{2}\;;\ Al_{4}C_{3}\;;\ Fe\;;\ O_{3}\;;\ HCl$ ;
$CaCO_{3}\;;\ H_{2}\;;\ S\;;\ Pb\;;\ H_{2}SO_{4}$
$CHCl_{3}\;;\ O_{2}\;;\ Cu.$
Compléter le tableau ci-dessous en écrivant la formule de chaque corps pur dans la colonne qui convient
$$\begin{array}{|l|l|l|} \hline \text{Corps purs}&\text{Corps purs}&\text{Corps purs}\\ \text{simple}&\text{simple}&\text{Composés}\\ \hline \text{atomiques}&\text{moléculaires}&\\ \hline & &\\ \hline \end{array}$$
Donner la composition de chacun des corps purs composés.
Exercice 5
Compléter le tableau suivant où les points représentent des nombres et les tirets, des symboles d'élément chimique :
$$\begin{array}{|c|c|c|c|} \hline\text{Formule}&\text{Noms}&\text{Nombre}&\text{Nombre}\\ \text{chimique}&\text{éléments}&\text{d'atomes}&\text{total}\\ \text{du corps}&\text{chimiques}&\text{de chaque}&\text{d'atome}\\ \text{pur}&\text{présents}&\text{élément}&\text{dans le}\\ &\text{dans le}& &\text{corps}\\ &\text{corps}& &\\ \hline --..&Oxygène&2&...\\ \hline --Cl&Sodium&...&2\\ &---&...&2\\ \hline H..--&--&2&3\\ &Oxygène&...&\\ \hline Fe..--..&Oxygène&4&7\\ &----&...&\\ \hline AlCl_{3}&----&...&...\\ &----&...&\\ \hline Al_{2}(SO_{4})_{3}&----&...&\\ &----&...&...\\ \hline &----&...&\\ \hline Ca(--O...)..&Azote&2&9\\ &----&...&\\ &----&...&\\ \hline \end{array}$$
Exercice 6
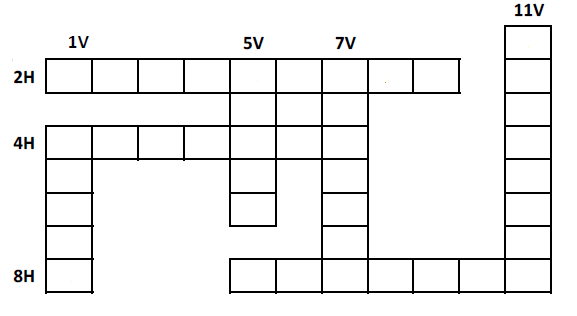
Compléter cette grille de mots croisés
2 H : Le premier des éléments chimique
4 H : Il représente l'élément chimique
8 H : l'atome en est la particule de base
1 V : Sa formule chimique est NaOH
5 V : Gaz dont la molécule n'est formée que d'oxygène.
7 V : Corps chimique dont le carbone en est la référence.
11 V : Particule formée d'atomes
Exercice 7
Donner la formule chimique de chacun des corps dont la molécule renferme :
$\centerdot\ $ Un atome de carbone et quatre atomes d'hydrogène.
$\centerdot\ $ Un atome de sodium, un atome d'oxygène et un atome d'hydrogène
$\centerdot\ $ Six atomes de carbone, douze atomes d'hydrogène et six atomes d'oxygène.
$\centerdot\ $ Un atome de calcium, deux atomes d'oxygène et deux atomes d'hydrogène.
$\centerdot\ $ Un atome de carbone et deux atomes d'oxygène.
Exercices supplémentaires
Exercice A
Écrire la formule chimique des corps dont les noms sont donnés ci-après
$\rhd\ $ dioxyde de soufre
$\rhd\ $ trioxyde de soufre
$\rhd\ $ dioxygène
$\rhd\ $ trioxygène ou ozone
$\rhd\ $ monoxyde de carbone
Exercice B
Savoir distinguer un corps pur simple d'un corps pur composé Choisissez la bonne réponse :
$\rhd\ $ l'eau est un ....
a) corps simple
b) corps composé
c) élément
d) mélange
$\rhd\ $ le dihydrogène est un .....
a) corps simple
b) corps composé
c) élément
d) mélange
$\rhd\ $ il existe plusieurs corps simples contenant le même élément
a) vrai
b) faux
c) question n'ayant aucun sens
Exercice 8 Maitrise de connaissances
Recopie et complète les phrases suivantes à l'aide de la liste de termes :
composé ; négativement ; $10^{-10}$ $m$ ; neutre ; ion ; simple ; positivement ; noyau ; électrons.
Un atome possède un noyau central chargé ........... et des électrons chargés ...............
La charge des .............. compense celle du ...............; l'atome est donc électriquement ...............
Un .............. est un atome qui a gagné ou perdu un ou plusieurs électrons.
Les dimensions de l'atome sont de l'ordre de .................
Un corps pur ............... est formé d'atomes différents.
Un corps pur ........... est formé d'atomes identiques.
Exercice 9 Symbole d'un élément chimique
1) Donne le nom de l'élément correspondant à chacun des symboles suivants :
$$\begin{array}{|c|c|c|c|c|c|c|} \hline \text{Symbole}&Mg&Cl&Al&Ne&Ca&P\\ \hline \text{Nom}& & & & & &\\ \hline \end{array}$$
2) Donne le symbole de chacun des éléments chimiques suivants :
$$\begin{array}{|c|c|c|c|c|c|c|} \hline \text{Elément chimique}&\text{oxygène}&\text{hydrogène}&\text{azote}&\text{sodium}&\text{soufre}&\text{potassium}\\ \hline \text{Symbole}& & & & & &\\ \hline \end{array}$$
Exercice 10 Formule chimique
Écris la formule chimique à partir de la composition de la molécule
$$\begin{array}{|l|c|} \hline \text{Composition de la molécule}&\text{Formule du corps pur}\\ \hline \text{2 atomes de chlore}&\\ \hline \text{1 atome de soufre et 2 atomes d'oxygène}&\\ \hline \text{1 atome de carbone et 2 atomes d'oxygène}&\\ \hline \text{3 atomes d'oxygène}&\\ \hline \text{1 atome d'azote et 3 atomes d'hydrogène}&\\ \hline \end{array}$$
Exercice 11 Signification d'une formule
Le sucre ou saccharose a pour formule moléculaire : $C_{12}H_{22}O_{11}$
Indique le nom et le nombre des différents atomes présents dans la molécule.
Exercice 12 Reconnaissance de formule
On considère les écritures suivantes : $O_{3}\;;\ 2O_{2}\;;\ 2O\;;\ O_{2}.$
Laquelle de ces quatre écritures représente :
1) Une molécule de dioxygène ?
2) Deux atomes d'oxygène séparés
Exercice 13 Classement selon l'atomicité
Indique l'atomicité des molécules suivantes
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|} \hline &N_{2}&HCl&Ne&H_{2}O&CO&O_{3}&He&NO_{2}&Cl_{2}\\ \hline \text{atomicité}& & & & & & & & &\\ \hline \end{array}$$
Exercice 14 Corps pur simple et corps pur composé
Recopie et mets une croix dans la case correspondant à la bonne réponse.
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|} \hline &H_{2}O&He&Cl_{2}&H_{2}&SO_{2}&Ne&NH_{3}&HCl&O_{3}\\ \hline \text{Corps pur simple}& & & & & & & & &\\ \hline \text{Corps pur composé}& & & & & & & & &\\ \hline \end{array}$$
Exercice 15 Entité chimique
On considère les entités chimiques suivantes :
$O_{3}\;;\ PO_{4}^{3^{-}}\;;\ SO_{4}^{2^{-}}\;;\ HO^{-}\;;\ NH_{3}\;;\ Fe^{3^{+}}\ \text{ et }\ H_{3}O^{+}.$
1) Classe-les en molécules, anions et cations.
2) Donne la charge électrique de chaque entité chimique.
Exercice 16 « un collier d'or »
Le diamètre d'un atome d'or est environ $0.144\;nm.$
Quel nombre minimal d'atomes d'or pourrait-on placer côte à côte pour obtenir une longueur $40\;cm$ ?
Exercice 17
La masse d'un noyau d'atome de cuivre est de $1.05\times 10^{-25} kg.$
Celle de l'ensemble de ses électrons est de $2.64\times 10^{-29} kg.$
1) Compare la masse du noyau de l'atome de cuivre à celle de ses électrons en calculant le rapport masse noyau/masse des électrons.
2) Explique la phrase suivante : « la masse de l'atome est concentrée en son noyau. ».
Exercice 18 Formule statistique d'un composé
Complète le tableau ci-dessous en reliant la formule statistique du composé ionique à celles de ses ions.
$$\begin{array}{|c|c|c|c|c|} \hline &Na^{+}&Cu^{2^{+}}& &Fe^{3^{+}}\\ \hline Cl^{-}& & & & \\ \hline SO_{4}^{2^{-}}& & &CaSO_{4}&\\ \hline & &Cu\left(OH\right)_{2}& &\\ \hline NO_{3}^{-}& & & &\\ \hline S^{2^{-}}& & & &\\ \hline \end{array}$$
Exercice 19 Changement d'échelle
Le rayon de l'atome est environ $100 000$ fois plus grand que le rayon du noyau.
Si on représentait le noyau par une orange de $5\;cm$ de rayon,
1) Quel serait en $m$, puis en $km$ le rayon de l'atome correspondant ?
2) Tire une conclusion.
$\begin{array}{c}\blacktriangleright\,\boxed{\text{Correction des exercices}}\end{array}$
Source:
irempt.ucad.sn & ADEM

Commentaires
Koté (non vérifié)
lun, 03/02/2020 - 15:06
Permalien
Svp j v les cours et exos en mode PDF pour que je puisse les tél
Anonyme (non vérifié)
lun, 09/14/2020 - 23:27
Permalien
C tres b1 j'aime ses genres d
Ndeye (non vérifié)
mar, 04/27/2021 - 23:27
Permalien
Étudie
Ndeye (non vérifié)
mar, 04/27/2021 - 23:27
Permalien
Étudie
Diama gadiaga (non vérifié)
ven, 04/15/2022 - 23:47
Permalien
Je ne comprend pas cette
Ndeye ami (non vérifié)
lun, 06/06/2022 - 22:41
Permalien
Structure de la matiers
Ndeye ami (non vérifié)
lun, 06/06/2022 - 22:41
Permalien
Structure de la matiers
Alassane (non vérifié)
mar, 01/31/2023 - 21:37
Permalien
De comprendre
Wane (non vérifié)
lun, 05/23/2022 - 21:35
Permalien
Pc
Anonyme (non vérifié)
ven, 06/17/2022 - 22:12
Permalien
Svp essayer de créer un
Anta sall (non vérifié)
sam, 02/04/2023 - 23:43
Permalien
Demande d'aide en pc
ALY TOLNO (non vérifié)
lun, 07/31/2023 - 20:24
Permalien
Télécharger des cours et les exercices physiques et chimie collè
AADI (non vérifié)
lun, 12/25/2023 - 13:47
Permalien
REVISION
Kalignagué abgu... (non vérifié)
ven, 01/12/2024 - 15:50
Permalien
Structure des atomes
Mohamed Déthié ... (non vérifié)
ven, 01/26/2024 - 23:19
Permalien
S'exercer pour les devoirs et la composition
Anonyme (non vérifié)
mar, 03/26/2024 - 21:49
Permalien
Merci pour votre excellent
Ajouter un commentaire