Notion de réaction chimique - 4e
Classe:
Quatrième
A Situation problématique
Observons le fonctionnement d'une lampe à carbure ou lampe acétylénique.
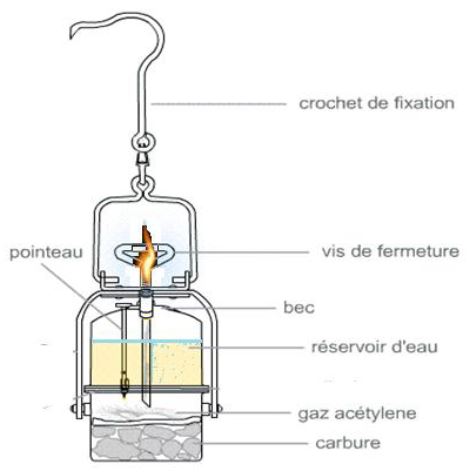
Les lampes à carbure sont constituées de deux cuves :
la première sert de réservoir d'eau, et l'autre contient des morceaux de carbure de calcium.
Lorsque l'eau est versée sur le carbure par l'intermédiaire du pointeau, on observe alors le dégagement d'un gaz inflammable appelé acétylène qui produit une lumière très intense lorsqu'il brûle.
Le texte ci-dessus est une description simple du fonctionnement d'une lampe à carbure
a) Quels corps utilise-t-on pour le fonctionnement de la lampe ?
b) Quels sont les corps qui apparaissent lors de ce fonctionnement ?
c) Le phénomène observé est-il physique ou chimique ?
Contenus
I- Exemples de réaction chimique
I-1. Electrolyse de l'eau
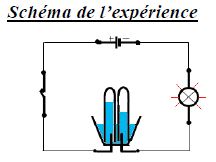
On remplit un électrolyseur avec de l'eau.
Ajoutons quelques gouttes d'acide.
Lorsqu'on ferme l'interrupteur, la lampe s'allume ; le courant passe.
On observe un dégagement de bulles au niveau des électrodes :
ces gaz sont le dihydrogène et le dioxygène.
Ainsi l'eau est décomposée par le courant électrique pour donner ces deux gaz.
I-2. Combustion du carbone dans un flacon de dioxygène.
On réalise la combustion d'un morceau de charbon dans un flacon contenant de l'eau de chaux.
Après la combustion on observe le dégagement d'une fumée et l'eau de chaux contenue dans le flacon se trouble :
la combustion s'accompagne alors d'un dégagement de gaz carbonique qui trouble l'eau de chaux.
Dans le dioxygène, le carbone brûle et donne du dioxyde de carbone (gaz carbonique).
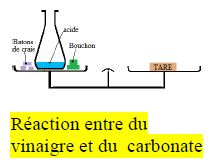
I-3. Action de l'acide sur le calcaire
Introduisons dans un tube à essai contenant de l'acide chlorhydrique un petit morceau de calcaire.
On observe une effervescence.
Le gaz qui se dégage trouble l'eau de chaux. De plus, le ballon est légèrement chaud.
Lorsque l'acide chlorhydrique attaque le calcaire il se dégage du gaz carbonique.
D'autres expériences montrent la formation aussi d'eau et du chlorure de calcium.
Il se produit un dégagement de chaleur.
I-4. Combustion du mélange fer-soufre
Préparons un mélange intime de $7\;g$ de fer et $4\;g$ de soufre.
Chauffons à une extrémité du mélange. On observe une propagation de la combustion du mélange fer-soufre.
On obtient à la fin un corps grisâtre qui n'est pas attiré par un aimant : c'est du sulfure de fer.
II- Définitions :
Une réaction chimique est une transformation de corps purs en d'autres corps purs.
Les corps qui réagissent et qui disparaissent sont appelés réactifs.
Les corps purs qui se forment ou qui apparaissent lors de la réaction sont les produits de la réaction

III- Caractéristiques d'une réaction
III-1. Aspects énergétiques
La réaction entre l'acide chlorhydrique et le calcaire s'accompagne d'un dégagement de chaleur :
la réaction est dite exothermique.
Certaines réactions se déroulent en absorbant de la chaleur :
ces réactions sont dites endothermiques.
Pour d'autres, aucun effet thermique n'est observé :
on a une réaction athermique.
III-2. La loi de conservation :
a) Combustion fer-soufre
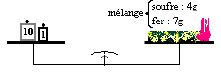
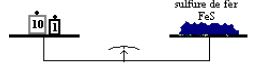
La réaction entre $7\;g$ de fer et $4\;g$ de soufre donne $11\;g$ de sulfure de fer.
Cette expérience montre que la somme des masses des réactifs ayant disparu est égale à celle des produits apparus (le sulfure de fer).
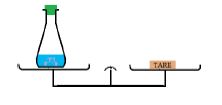
b) Réaction acide-calcaire

La balance est en équilibre avant la réaction et reste toujours en équilibre à la fin de la réaction.
La masse reste invariable au cours de la transformation :
la masse se conserve au cours d'une réaction chimique.
Interprétation
Au cours d'une réaction chimique, il y a une conservation de la matière.
La matière étant constituée d'atomes, il y a alors conservation des atomes présents dans les molécules des différents réactifs.
Les atomes présents dans les réactifs se sont réorganisés pour donner les produits.

IV- Représentation d'une réaction chimique
On utilise les formules chimiques des réactifs et des produits pour représenter une réaction chimique.
On obtient une écriture symbolique appelée équation bilan.
IV-1. L'équation de la réaction :
Elle indique les différents corps (réactifs et produits) qui entre en jeu au cours de la réaction :
c'est une représentation qualitative de la réaction.
Les réactifs sont écrits à gauche et les produits à droite.
Réactifs et produits sont séparés par une flèche qui indique le sens de la transformation
Exemples :
$\centerdot$ L'électrolyse de l'eau
$$H_{2}O\Longrightarrow H_{2}+O_{2}$$
$\centerdot$ La combustion du carbone
$$C+O_{2}\Longrightarrow CO_{2}$$
$\centerdot$ L'action de l'acide sur le calcaire
$$HCl+CaCO_{3}\Longrightarrow CaCl_{2}+H_{2}O+CO_{2}$$
$\centerdot$ La combustion du mélange fer-soufre
$$Fe+S\Longrightarrow Fe$$
Remarque :
$\centerdot$ Les réactifs sont à gauche de la flèche et les produits à droite.
$\centerdot$ la conservation de la matière n'est pas toujours vérifiée avec l'équation de la réaction.
Dans ce cas, l'équation est dite non équilibrée (électrolyse de l'eau).
IV-2. L'équation bilan :
La réaction étant caractérisée par la conservation de la matière, sa représentation doit alors satisfaire à cette loi.
L'équation de la réaction est corrigée si nécessaire : on obtient alors une équation bilan équilibrée.
L'équation bilan équilibrée conserve :
$\centerdot$ Les éléments chimiques : on a les mêmes éléments chimiques dans les réactifs que dans les produits.
$\centerdot$ Le nombre d'atomes de chaque élément chimique : pour un élément donné, on a le même nombre d'atomes dans les réactifs que dans les produits.
Conséquence :
la masse des réactifs ayant disparu est égale à celle des produits apparus.
Exemples d'équation bilan :
$\centerdot\ $ Electrolyse de l'eau
$$2H_{2}O\Longrightarrow 2H_{2}+O_{2}$$
$\centerdot\ $ Action de l'acide chlorhydrique sur le calcaire
$$2HCl+CaCO_{3}\Longrightarrow CaCl_{2}+H_{2}O+CO_{2}$$
Les nombres utilisés pour équilibrer l'équation de la réaction sont appelés coefficients stoechiométriques.
L'équation bilan montre :
$\centerdot\ $ Au niveau microscopique, dans quelles proportions les espèces chimiques (atomes, molécules et ions) se combinent et disparaissent pour les réactifs et se forment pour les produits.
$\centerdot\ $ Au niveau macroscopique, dans quelles proportions les moles d'espèces chimiques se combinent et disparaissent pour les réactifs et se forment pour les produits.
Exemples :
$\centerdot\ $ L'équation de l'électrolyse de l'eau indique :
Au niveau microscopique que $2$ molécules d'eau se sont décomposées pour donner $2$ molécules de dihydrogène et une molécule de dioxygène
Au niveau macroscopique, $2$ moles d'eau ont donné $2$ moles de dihydrogène et une mole de dioxygène.
$\centerdot\ $ L'action de l'acide chlorhydrique sur le calcaire montre que :
Au niveau microscopique, $2$ molécules d'acide se combinent avec une molécule de calcaire pour donner une molécule de chlorure de calcium, une molécule d'eau et une molécule de gaz carbonique
Au niveau macroscopique, 2 moles d'acide se combinent avec une mole de calcaire pour donner une mole de chlorure de calcium, une mole d'eau et une mole de gaz carbonique
B- Le problème de chimie
1) Énoncé
Une électrolyse de l'eau $(H_{2}O)$ a permis de recueillir $56\;ml$ de dioxygène $(O_{2})$ dans les conditions normales.
Trouver :
a) La masse d'eau décomposée.
b) Le volume de dihydrogène $(H_{2})$ recueilli simultanément.
2) Corrigé
$2 H_{2}O\longrightarrow 2 H_{2}+O_{2}$
$2\;mol\qquad 2\;mol\quad 1\;mol$
$n_{H_{2}O}\ ?\qquad n H_{2}\ ?\quad n O_{2}=$
le nombre de mole dans $56\;ml$ de $O_{2}$ est :
$n_{O_{2}}=\dfrac{v}{V}\rightarrow n_{O_{2}}=\dfrac{56\cdot 10^{-3}}{22.4}=2.5\cdot 10^{-3}mol$
a) La masse d'eau décomposée est :
$m_{H_{2}O}=n\cdot M$
$2\;mol\longrightarrow 1\;mol$
$n_{H_{2}O}$ ? $\longrightarrow n_{O_{2}}=n_{H_{2}O}=\dfrac{n_{O_{2}}\times 2}{1}=2 n_{O_{2}}$
$n_{H_{2}O}=\dfrac{n_{O_{2}}\times 2}{1}2\;n_{O_{2}}$
$n_{H_{2}O}=2\times 2.5\cdot 10^{-3}=5\cdot 10^{-3}mol$
$M(H_{2}O)=2M(H)+M(O)\rightarrow M(H_{2}O)=2\times 1\times 16=2+16=18\;g/mol$
$m_{H_{2}O}=5\cdot 10^{-3}\times 18=9\cdot 10^{-2}g$
b) Le volume de dihydrogène recueilli est de $v_{H_{2}}=n\cdot V\text{ avec }V=22.4\;mol/L$
$2\;mol\longrightarrow 1\;mol$
$n_{H_{2}}$ ? $\longrightarrow n_{O_{2}}=$
$n_{H_{2}}=\dfrac{n_{O_{2}}\times 2}{1}=2\times n_{O_{2}}$
$n_{H_{2}}=2\times 2.5\cdot 10^{-3}=5\cdot 10^{-3}mol$
$v_{H^{2}}=5\cdot 10^{-3}\times 22.4=112\cdot 10^{-3}L$
L'essentiel du cours
$\centerdot$ La réaction chimique transforme certains corps purs appelés réactifs en d'autres corps purs appelés produits.
$\centerdot$ La réaction chimique est représentée par une équation bilan qui satisfait à la loi de conservation de la matière et montre dans quelles proportions les réactifs se combinent et les produits se forment.
$\centerdot$ L'équation bilan permet de résoudre des problèmes de chimie.
Source:
irempt.ucad.sn

Commentaires
Traoré (non vérifié)
lun, 06/10/2019 - 23:54
Permalien
D'être une scientifique
Elhadji lo (non vérifié)
jeu, 09/24/2020 - 13:00
Permalien
Je veux d'être excellent partout
abdoulaye (non vérifié)
mar, 06/29/2021 - 23:24
Permalien
L excellence se mérite seul
Cheikh Mouhamed... (non vérifié)
jeu, 12/17/2020 - 07:14
Permalien
Pc
Cheikh Mouhamed... (non vérifié)
jeu, 12/17/2020 - 07:14
Permalien
Pc
Ameth (non vérifié)
sam, 02/20/2021 - 03:12
Permalien
Je d être un scientifique
Diama (non vérifié)
mar, 07/06/2021 - 14:46
Permalien
En classe de 4 éme
Fatoumata (non vérifié)
mer, 06/01/2022 - 21:52
Permalien
De m’expliquer svp
Mohamed Ouoba (non vérifié)
lun, 04/20/2020 - 03:44
Permalien
Enseignement
Amadouuuuuuuuuu (non vérifié)
lun, 06/27/2022 - 19:33
Permalien
Cours
star (non vérifié)
ven, 05/29/2020 - 01:42
Permalien
c'est FUN
DDGF (non vérifié)
mar, 09/01/2020 - 15:42
Permalien
FD
ZSZD (non vérifié)
mar, 09/01/2020 - 15:42
Permalien
DZF
Abou (non vérifié)
sam, 04/10/2021 - 16:59
Permalien
Devenir un scientifique
Anonyme (non vérifié)
jeu, 06/03/2021 - 20:26
Permalien
Travail
Sophie tall (non vérifié)
mar, 01/10/2023 - 21:41
Permalien
C est être un bon élève de la science
Anonyme (non vérifié)
jeu, 06/03/2021 - 20:28
Permalien
Aime les sciences et tout ce qui va avec
Eleve (non vérifié)
mar, 06/08/2021 - 22:30
Permalien
J'aime la science
Anonyme (non vérifié)
mar, 07/06/2021 - 14:48
Permalien
Explication
Anonyme (non vérifié)
mar, 07/06/2021 - 14:49
Permalien
Explication
Anonyme (non vérifié)
mar, 07/06/2021 - 14:49
Permalien
Explication
Anonyme (non vérifié)
mar, 07/06/2021 - 14:49
Permalien
Explication
Ndeye Nogoye (non vérifié)
sam, 06/11/2022 - 22:45
Permalien
Pc
Ibra seck (non vérifié)
lun, 06/13/2022 - 22:42
Permalien
Pc
Ibra seck (non vérifié)
lun, 06/13/2022 - 22:42
Permalien
Pc
Anonyme (non vérifié)
jeu, 06/16/2022 - 22:10
Permalien
Merci beaucoup de m'avoir
Sam Cissé (non vérifié)
mer, 06/14/2023 - 01:09
Permalien
Remerciements
Ajouter un commentaire