Série d'exercices : Structure de la matière et quantité de matière - 2nd L
Classe:
Seconde
Exercice 1
Mots croisés :
Horizontal
1. Métal de couleur rouge ou orangée
6. Relative à la masse d'une mole d'une espèce chimique
8. Unité SI de mesure de quantité de matière
9. Atome ou une molécule ayant perdu un ou plusieurs électrons
10. Partie centrale de l'atome, autour de laquelle se meuvent les électrons
12. Particule électriquement neutre appartenant au noyau d'un atome.
13. Assemblage d'atomes liés entre eux
15. Autre du nom du nuage électronique
17. Se rapporte à la masse d'une mole de molécules
Vertical
2. Atomes ayant le même nombre $Z$, mais de nucléons différents
3. Particule chargée négativement se trouvant autour du noyau d'un atome.
4. Lettre majuscule, suivie parfois d'une lettre minuscule, représentant un élément chimique
5. Entité chimique qui présente le même nombre $Z$ de protons dans leur noyau.
7. Petite partie d'un corps simple pouvant se combiner chimiquement avec un autre
11. Atome ou une molécule ayant gagné un ou plusieurs électrons
14. Particule chargée positivement appartenant au noyau d'un atome.
16. Métal aimanté
Exercice 2
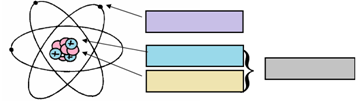
Compléter le schéma ci-dessous à l'aide de la liste des mots suivante :
NOYAU, ÉLECTRON, NEUTRON et PROTON
Exercice 3
Compléter les phrases avec les mots suivants : ion, noyau, atomes, cation, molécules, électrons, anion.
La matière est formée par un très grand nombre de particules microscopiques appelées des$\ldots\ldots\ldots\ldots$
Une molécule est formée par des$\ldots\ldots\ldots$liés entre eux.
Chaque atome contient des charges négatives appelées des$\ldots\ldots\ldots$et des charges positives rassemblées dans une partie centrale appelée$\ldots\ldots\ldots$
Un$\ldots\ldots\ldots$est un atome qui a gagné ou perdu un ou plusieurs électrons.
Lorsque l'atome gagne des électrons il se transforme en un$\ldots\ldots\ldots$et lorsqu'il perd des électrons il se transforme en un$\ldots\ldots\ldots$
Exercice 4
Compléter les phrases suivantes :
Dans un atome, quand il y a autant de$\ldots\ldots\ldots$que d'électrons, on dit que celui-ci.
Un atome qui perd des électrons devient chargé$\ldots\ldots\ldots$on l'appelle alors un ion positif.
Un atome qui gagne des électrons devient chargé$\ldots\ldots\ldots$on l'appelle alors un ion négatif ou$\ldots\ldots\ldots$
Un$\ldots\ldots\ldots$est une particule qui tourne autour du noyau d'un atome.
Un$\ldots\ldots\ldots$c'est seulement un atome qui a gagné ou perdu des électrons
A chaque élément chimique est associé un$\ldots\ldots\ldots$, par exemple $C$ pour le carbone.
Pour distinguer deux isotopes on indique, en haut et à gauche du symbole de l'élément, le$\ldots\ldots\ldots$
Deux noyaux sont dits isotopes lorsqu'ils ont le même$\ldots\ldots\ldots$et des nombres de$\ldots\ldots\ldots$différents.
Deux isotopes diffèrent donc par leurs$\ldots\ldots\ldots$
Dans le cycle naturel du carbone, l'élément$\ldots\ldots\ldots$se conserve et dans le cycle naturel de l'azote c'est l'élément$\ldots\ldots\ldots$qui se conserve.
Les gaz nobles occupent la$\ldots\ldots\ldots$du tableau périodique.
Leur couche électronique externe est$\ldots\ldots\ldots$Ils sont donc stables chimiquement et ne forment ni ion, ni molécule car ils respectent la règle du $\ldots\ldots\ldots$ $(2$ électrons maximum sur la couche n°1$)$ pour l'hélium et la règle de$\ldots\ldots\ldots$ $(8$ électrons maximum sur la couche n°2 ou $3)$ pour le néon et l'argon.
Exercice 5
Répondre par vrai ou faux.
Corriger si la réponse est fausse
1. Un élément chimique est caractérisé par le nombre de ses nucléons.
2. Un élément chimique correspond à l'ensemble des atomes ou ions dont le noyau comporte le même nombre de neutrons.
3. Deux noyaux d'un même élément peuvent avoir des nombres de masse différents.
4. Les atomes d'un même élément chimique ont le même nombre d'électrons.
5. Les atomes d'un même élément chimique ont des noyaux identiques.
6. Les isotopes d'un même élément chimique sont caractérisés par des noyaux ayant le même nombre de neutrons et des nombres de protons différents.
7. Deux atomes qui ont le même nombre d'électrons et des nombres de nucléons différents, sont deux isotopes.
8. Les atomes d'un même élément chimique ayant des nombres de masse différents sont des isotopes.
9. Au cours d'une réaction chimique les éléments chimiques se conservent.
10. Dans le cycle du carbone l'élément carbone se conserve
Exercice 6
Choisir la bonne réponse.
1. Un élément chimique est caractérisé par son nombre de :
a. charge
b. masse
c. neutrons.
2. Tous les représentants d'un même élément ont un noyau comportant le même nombre de :
a.nucléons
b. neutrons
c. protons.
3. Le charbon $(C)$, le gaz carbonique $\left(CO_{2}\right)$, l'éthanol $\left(C_{2}H_{6}O\right)$ et le carbure de calcium $\left(CaC_{2}\right)$ renferment tous l'élément :
a. carbone
b. hydrogène
c. oxygène.
3. Tous les atomes d'un élément ont le même nombre de :
a. nucléons
b. neutrons
c. protons.
4. Deux isotopes diffèrent par leur nombre :
a. d'électrons
b. de neutrons
c. de protons.
Exercice 7
1. Parmi les constituants de l'atome, deux ont sensiblement la même masse :
a. l'électron et le proton
b. le neutron et le proton
c. le neutron et l'électron.
2. Recopier et compléter les phrases suivantes
Un atome est constitué d'un$\ldots\ldots\ldots$chargé$\ldots\ldots\ldots$et d'$\ldots\ldots\ldots$chargés$\ldots\ldots\ldots$en mouvement autour du noyau.
Un atome a une charge globale$\ldots\ldots\ldots$
On dit qu'il est$\ldots\ldots\ldots$
Le noyau d'un atome est constitué de$\ldots\ldots\ldots$et de$\ldots\ldots\ldots$
Les neutrons ont une charge électrique$\ldots\ldots\ldots$tandis que les protons ont une charge électrique$\ldots\ldots\ldots$
Dans un atome le nombre de$\ldots\ldots\ldots$est égal au nombre d'électrons
Exercice 8
Répondre par vrai ou faux.
Corriger si la réponse est fausse
1. Les électrons d'un atome comportant plus que deux électrons sont tous également liés au noyau.
2. Les électrons de la couche M sont plus liés au noyau que ceux de la couche $K.$
3. La couche L peut contenir plus d'électrons que la couche $K.$
4. Une couche peut contenir un nombre illimité d'électrons.
5. Un atome a $12$ électrons.
Sa structure électronique est :
6. La formule électronique du chlore $(Z=17)$ est : $(K)^{2}(L)^{8}(M)^{7}.$
7. L'atome de magnésium $(Z=12)$ a deux électrons sur la couche externe $M.$
Il a une seule couche interne.
8. La formule électronique du carbone est $(K)^{2}(L)^{4}$, sa couche périphérique est la couche $M.$
9. La couche $L$ est saturée à $18$ électrons.
10. La structure électronique de l'ion $Mg^{2+}$ est identique à celle de l'atome de magnésium $Mg.$
Exercice 9
A. Choisir la bonne réponse
1. Dans les couches $K$ et $L$, on peut placer :
a. un nombre illimité d'électrons ;
b. le même nombre d'électrons dans chaque couche ;
c. $12$ électrons.
2. Le nombre maximum d'électrons que peut contenir une couche :
a. est le même pour toutes les couches ;
b. diffère d'une couche à une autre ;
c. dépend de l'atome considéré.
3. Un atome dont la couche externe est saturée peut avoir pour formule électronique :
a. $(K)^{1}(L)^{8}$ ;
b. $(K)^{2}(L)^{5}$ ;
c. $(K)^{2}(L)^{6}.$
4. La formule électronique de l'atome d'aluminium $(Z=13)$ est $(K)^{2}(L)^{8}(M)^{3}.$
Celle de l'ion aluminium $Al^{3+}$ est alors :
a. $(K)^{2}(L)^{8}(M)^{6}$ ;
b. $(K)^{2}(L)^{8}(M)^{3}$ ;
c. $(K)^{2}(L)^{8}.$
B. Recopier et compléter les phrases suivantes
1. Les électrons d'un atome se répartissent en$\ldots\ldots\ldots$ou$\ldots\ldots\ldots$
2. Les couches électroniques sont désignées par les lettres$\ldots\ldots\ldots\;,\ \ldots\ldots\ldots\;,\ \ldots\ldots\ldots\;,$ etc.
Les électrons sont d'autant plus liés au$\ldots\ldots\ldots$que la couche à laquelle ils appartiennent est plus$\ldots\ldots\ldots$du noyau.
3. Chaque couche ne peut contenir qu'un nombre$\ldots\ldots\ldots$d'électrons.
Ainsi la couche $K$ peut contenir au plus$\ldots\ldots\ldots$électrons, tandis que la couche $L$ peut contenir au maximum$\ldots\ldots\ldots$électrons.
Le remplissage des couches électroniques s'effectue en commençant par la couche$\ldots\ldots\ldots$
Lorsqu'elle est$\ldots\ldots\ldots$, on remplit la couche$\ldots\ldots\ldots$et ainsi de suite
Exercice 10
Reproduire et compléter le tableau suivant :
$$\begin{array}{|l|l|l|l|l|l|} \hline \text{Molécule}&\text{Composition en atomes}&\text{Atomicité}&\text{Formule}&\text{Corps simple}&\text{Corps composé}\\ \hline \text{Ammoniac}&\text{1 atome d'azote et 3}&&&&\\ &\text{atomes d'hydrogène}&&&&\\ \hline \text{Dihydrogène}&&H_{2}&&\\ \hline \text{Trioxyde}&\text{1 atome de soufre et}&&&&\\ \text{de soufre}&\text{3 atomes d'oxygène}&&&&\\ \hline \text{Trioxygène}&\text{3 atomes d'oxygène}&&&&\\ \text{(ozone)}&&&&&\\ \hline \text{Méthane}&&&CH_{4}&&\\ \hline \end{array}$$
Exercice 11
Choisir la bonne réponse.
1. Une mole est :
a. la quantité de matière constituée par $6.02\cdot 10^{22}$ particules.
b. la quantité de matière constituée par $6.02\cdot 10^{23}$ particules identiques.
c. l'ensemble de $6.02\cdot 10^{25}$ particules identiques
2. Si deux gaz, pris dans les mêmes conditions de température et de pression, occupent le même volume :
a. ils renferment la même quantité de matière.
b. ils ont la même masse.
c. il s'agit du même gaz.
3. Le volume molaire d'un gaz dépend de :
a. la température et de la pression.
b. la masse molaire du gaz.
c. la nature du gaz.
4. A l'échelle macroscopique $H_{2}O$ représente :
a. une molécule d'eau.
b. une mole de molécules d'eau.
c. une masse d'eau égale à $20q.$
Exercice 12
L'assemblage de certains éléments d'une étagère a été réalisé avec une colle à base d'acétate de vinyle.
Sa formule chimique brute est $C_{4}H_{6}O_{2}.$
1. Nommer les éléments constituant la molécule d'acétate de vinyle.
2. Calculer la masse molaire moléculaire de l'acétate de vinyle.
Données :
$M(H)= g/mol$,
$M(C)=12g/mol$
et $M(O)=16g/mol$
Exercice 13
La vitamine $"C"$ a pour formule brute $C_{6}H_{8}O_{6}.$
1. Indiquer le nom et le nombre des atomes présents dans une molécule de vitamine $"C".$
2. Calculer la masse molaire moléculaire $M$ $\left(C_{6}H_{8}O_{6}\right)$ de la vitamine $"C".$
On donne les masses molaires atomiques :
$M(C)=12g/mol$
$M(H)=1g/mol$ ;
$M(O)=16g/mol$
Exercice 14
Un comprimé de vitamine $C\ 600$ contient une masse $m =600\,mg$ de vitamine $C$ de formule $C_{6}H_{8}O_{6}.$
Olivier utilise deux comprimés dans un verre de $60\,mL$ d'eau.
1. Calculer la masse d'une molécule de vitamine $C.$
2. Calculer le nombre de molécules de vitamine C contenu dans un comprimé.
3. Calculer la quantité de matière de vitamine $C$ comprise dans ce comprimé.
4. Calculer la concentration en masse de vitamine $C$ du verre.
On donne :
$M(C)=12g/mol$
$M(H)=1g/mol$ ;
$N_{A}=6.02\cdot 10^{23}mol^{-1}$
Exercice 15 Le caoutchouc naturel.
L'isoprène a pour formule $C_{5}H_{8}.$
Le caoutchouc naturel, produit par l'hévéa, est un assemblage en chaîne de molécules d'isoprène.
Les macromolécules de caoutchouc ont pour formule $\left(C_{5}H_{8}\right)y$, avec $y$ entier.
1. Calculer la masse d'une molécule méthacrylate de méthyle.
2. Calculer la masse d'une mole de molécules d'isoprène.
Quelle quantité de matière d'isoprène y a-t-il dans $6\ 800\,g$ de caoutchouc naturel ?
3. Une macromolécule de caoutchouc naturel a pour masse de $3.39\cdot 10^{-22}g.$
Déterminer le nombre $y$ de molécules d'isoprène constituant la chaîne de cette macromolécule.
Données :
$M(C)=12g/mol$ ;
$M(H)=1g/mol$ ;
$N_{A}=6.02\cdot 10^{23}mol^{-1}$
Exercice 16 Masse molaire moléculaire
Le méthacrylate de méthyle sert à fabriquer, par polymérisation, le Plexiglas.
Il a pour formule brute $C_{5}H_{8}O_{2}.$
1. Quels sont les éléments présents dans cette molécule ?
2. Calculer la masse $m$ de la molécule de méthacrylate de méthyle.
3. Calculer la masse d'une mole de méthacrylate de méthyle.
4. Trouver la quantité de matière contenue dans $m=10\,g$ de méthacrylate de méthyle.
Données :
$M(C)=12g/mol$ ;
$M(H)=1g/mol$ ;
$M(O)=16g/mol$ ;
$N_{A}=6.02\cdot 10^{23}mol^{-1}$

Commentaires
Khadijathiam (non vérifié)
dim, 02/26/2023 - 20:16
Permalien
Thiam
Khadijathiam (non vérifié)
mer, 03/01/2023 - 18:58
Permalien
Thiam
Papa Diouf (non vérifié)
dim, 12/17/2023 - 00:55
Permalien
Oui
Diallo (non vérifié)
sam, 03/09/2024 - 08:24
Permalien
Élèves
Imed ouni (non vérifié)
dim, 06/30/2024 - 17:17
Permalien
Structure de la matière et quantité de matière - 2nd L
Ajouter un commentaire