Exercices sur action à froid des acides dilués sur les métaux usuels 3e
Classe:
Troisième
Exercice 1
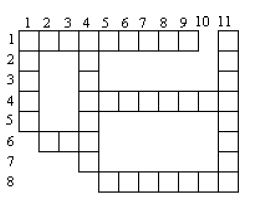
Donner les mots qui permettent de remplir correctement la grille ci-contre.
Horizontalement
1 à froid, ce métal ne réagit qu'avec l'acide chlorhydrique dilué
4 celui d'aluminium se note $AlCl_{3}$.
6 métal qui réagissent à froid avec $HCl,\ H_{2}SO_{4}$ et $HNO_{3}$ dilués
8 produit de l'action de l'acide sulfurique sur les métaux.
Verticalement :
1 solutions qui attaquent certaines métaux
4 métal liquide à l'état naturel.
11 qualité des réactions du plomb avec certains acides
Exercice 2
Compléter et équilibrer chacune des équations chimiques ci-dessous.
$\ldots\ldots\ +\ \text{ acide chlorhydrique } \longrightarrow\quad AlCl_{3}\ +\ \ldots$.
$Zn\ +\ \ldots\ldots\longrightarrow\quad ZnSO_{4}\ +\ H_{2}$
$Pb\ +\ \ldots\ldots \longrightarrow\quad PbCl_{2}\ +\ \ldots.$
$Fe\ +\ HCl \longrightarrow\quad\ldots\ +\ \ldots$.
Exercice 3
Sur chacun des métaux contenus dans les tubes à essais ci contre, on verse de l'acide chlorhydrique dilué en excès.
1) Indiquer les observations que l'on peut faire au niveau de chaque tube.
2) On recueillit $56\;mL$ de gaz au niveau d'un des tubes , calculer la masse de métal qu'il contenait.

Exercice 4
Citer, parmi les métaux usuels, deux métaux attaqués à froid par les trois acides dilués $HCl,\ H_{2}SO_{4},\ HNO_{3}$. Donner alors les produits de chacune des réactions et écrire éventuellement l'équation bilan correspondante.
Exercice 5
On verse un excès d'acide chlorhydrique $HCl$ dilué sur un mélange de cuivre et d'aluminium.
1) Dites ce qui se passe et écrivez l'équation bilan de la réaction.
2) A la fin du phénomène observé, on y verse ensuite de l'acide nitrique dilué. Qu'est-ce qu'on observe ? expliquez.
Exercice 6
Vous disposez de trois bidons : un en fer, un en aluminium et un en cuivre. Dites, en motivant votre choix, Quel(s) bidon(s) peut-on utiliser pour conserver :
1) de l'acide chlorhydrique dilué.
2) de l'acide sulfurique dilué.
Exercice 7
On fait réagir entièrement $10\;mL$ d'une solution d'acide chlorhydrique dilué avec $56\;mg$ de fer.
1) Calculer la masse de chacun des produits obtenus
2) Quelle est la molarité de la solution d'acide chlorhydrique utilisé ?
Exercice 8
On considère l'action de l'acide chlorhydrique dilué sur l'aluminium d'une part et sur le zinc d'autre part.
1) Écrire les équations bilan de chacune de ces réactions chimiques.
2) Quelle masse d'aluminium faut-il utiliser pour obtenir le même volume de dihydrogène, dans les conditions normales, qu'avec $6.54\;g$ de zinc.
Exercice 9
Un technicien de laboratoire veut obtenir $1.12\;L$ de dihydrogène dans les conditions normales. Il dispose de deux acides dilués (acide nitrique et acide chlorhydrique) et de trois métaux (plomb, fer et cuivre).
1) Indiquer les réactifs qu'il devra utiliser et écrire l'équation bilan de la réaction à réaliser. (1.5pt)
2) Calculer la masse de chacun des réactifs utilisés. (3pts)
3) Justifier de manière précise et sommaire le choix de ce laborantin. (1.5pt)
Prendre : $Al=27\;g/mol\;;\ Cl=35.5\;g/mol\;;\ Fe=56\;g/mol\;;\ Zn=65.4\;g/mol\;;\ H=1\;g/mol$.
$\begin{array}{c}\blacktriangleright\,\boxed{\text{Correction des exercices}}\end{array}$
Source:
irempt.ucad.sn

Commentaires
Mame Bousso Sylla (non vérifié)
mer, 06/16/2021 - 23:10
Permalien
Franchement les exercices
Anonyme (non vérifié)
lun, 11/06/2023 - 10:50
Permalien
Étudier l action cylindrique
Ndiaye (non vérifié)
mer, 03/01/2023 - 21:19
Permalien
Correction exercice 8je
Boubacar Traoré (non vérifié)
lun, 03/06/2023 - 22:19
Permalien
Exercice
Lybiana DESGRANGES (non vérifié)
lun, 11/06/2023 - 10:54
Permalien
Action chlorhydrique sur le fer le zinc et l argent
Anonyme (non vérifié)
jeu, 04/13/2023 - 00:43
Permalien
merci beaucoup pour ce que
Ajouter un commentaire