Série d'exercices sur Dosage Acide - Base - Ts
Classe:
Terminale
Exercice 1
On mélange un volume $V_{A}$ d'une solution d'acide chlorhydrique $\left(H_{3}O_{aq}^{+}+Cl_{aq}^{-}\right)$ de concentration molaire $C_{A}$ ayant un $pH_{A}$ avec un volume $V_{B}$ d'une solution d'hydrogène de sodium $\left(Na_{aq}^{+}+OH_{aq}^{-}\right)$ de concentration molaire $C_{B}$ ayant un $pH_{B}.$
1) Réaliser le bilan de matière des ions hydronium et hydroxyde.
2) Calculer leur concentration molaire dans la solution après la réaction de neutralisation.
Montrer que celui-ci est :
$\centerdot\ \ pH=7$, dans le cas d'une réaction totale et stœchiométrique.
$\centerdot\ \ pH=-\log\left(\dfrac{C_{A}V_{A}-C_{B}V_{B}}{V_{A}+V_{B}}\right)$, dans le cas d'un excès de la solution acide.
$\centerdot\ \ pH=14+\log\left(\dfrac{C_{B}V_{B}-C_{A}V_{A}}{V_{B}+V_{A}}\right)$, dans le cas d'un excès de la solution Basique.
$\centerdot\ $ En déduire le $pH$ de la solution obtenue.
On donne :
$\ \bullet\ V_{A}=200\,mL\;,\ pH_{A}=2.0\text{ et }V_{B}=200\,mL\;,\ pH_{B}=12.0.$
$\ \bullet\ V_{A}=800\,mL\;,\ pH_{A}=2.0\text{ et }V_{B}=500\,mL\;,\ pH_{B}=12.0.$
$\ \bullet\ V_{A}=300\,mL\;,\ pH_{A}=2.0\text{ et }V_{B}=200\,mL\;,\ pH_{B}=12.3.$
3) Calculer la concentration molaire des ions sodium et des ions chlorure qui sont resté dans la solution des trois cas.
Exercice 2
Pour déboucher les canalisations, on utilise des produits domestiques qui sont des solutions concentrées d'hydroxyde de sodium, $NaOH_{s}$, (soude).
Sur l'étiquette de l'un de ces produits on lit :
$-\ $ Densité $d=1.2$ (masse volumique $\rho=1.2\,g\cdot cm^{-3})$
$-\ $ Contient $20\%$ en masse de soude.
1) Montrer que la concentration molaire $C$ de la solution commerciale est voisine de $6\,mol\cdot L^{-1}.$
2) Quel volume de solution commerciale faut-il prélever pour obtenir $1\,L$ de solution dilué de concentration molaire $3\cdot 10^{-2}mol\cdot l^{-1}$ ?
Les solutions de soude sont des solutions de base forte.
3) a) Rappeler la définition d'une base forte.
Pour vérifier sa concentration, on dose $5\,mL$ de la solution diluée par une solution d'acide chlorhydrique de concentration $C_{A}=1\cdot 10^{-2}mol\cdot L^{-1}.$
4) a) Écrire l'équation bilan de la réaction.
b) Pour obtenir l'équivalence, on doit verser $15\,mL$ de la solution d'acide chlorhydrique.
Calculer la concentration de la solution diluée.
Retrouve-t-on la valeur souhaitée ?
Exercice 3
On se propose de déterminer l'alcalimétrie d'une eau industrielle.
Pour ceci on réalise le dosage $pH$ métrique de $50\,mL$ d'eau par une solution d'acide chlorhydrique de concentration molaire $C_{A}=1\cdot 10^{-1}mol\cdot L^{-1}.$
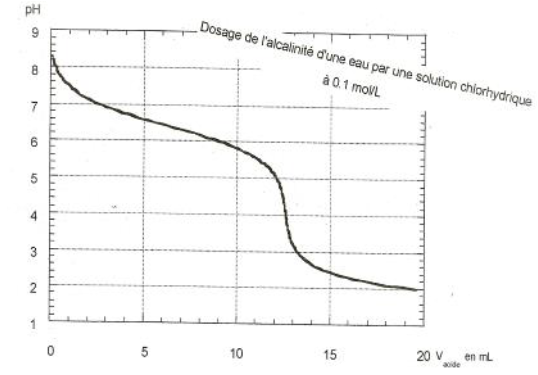
Les résultats des différentes mesures ont permis de tracer la courbe ci-dessus.
On admettra que l'alcalinité était due à la seule base faible : lion hydrogénocarbonate $HCO_{3}^{-}$
1) Déterminer graphiquement :
a) les cordonnées du point d'équivalence.
b) le $pK_{A}$ de la base faible.
2) Écrire l'équation de la réaction de dosage, puis calculer la concentration molaire et la concentration massique de la base.
3) Le titre alcali métrique complet $(T.A.C)$ d'une eau s'exprimant par le même nombre que le volume exprimé en $mL$ d'une solution acide telle que $C_{A}=2\cdot 10^{-2} mol\cdot L^{-1}$ nécessaire pour doser $100\,mL$ d'eau, déterminer le $T.A.C$ de l'eau étudiée.
Exercice 4
A l'aide d'une pipette et à partir d'une solution aqueuse $S_{A}$ d'un monoacide $AH$ de concentration molaire $C_{A}$, on prélève un volume $V_{A}=20\,mL$ qu'on verse dans un bécher.
Le dosage $pH$ métrique de $S_{A}$ par une solution aqueuse $S_{B}$ d'hydroxyde de sodium $NaOH$ (base forte), concentration molaire $C_{B}=0.2\,mol\cdot L^{-1}.$
1) a) Décrire comment varie le $pH$ en fonction de volume de la base ajouté.
b) La forme de la courbe permet-elle de vérifier que l'acide $AH$ dosé est un acide faible ?
Justifier.
2) Déterminer graphiquement en précisant la méthode utilisée :
a) La valeur du $pH$ à l'équivalence.
b) La valeur de la constante d'acidité $pKa$ du couple $AH/A^{-}.$
3) Vérifier que le $pH$ à l'équivalence $E$ est donné par la relation $pH_{E}=\left(pKe+pKa+\log\,C'_{AE}\right).$
4) pour permettre une bonne immersion de l'électrode combinée du $V_{e}$ d'eau pure au volume $V_{a}=20\,mL$ de la solution $S_{A}$ à doser.
a) Préciser, en le justifiant, l'effet de cette dilution sur :
$-\ $ Le $pH$ initial de la solution acide.
$-\ $ Le $pH$ à demi-équivalence.
$-\ $ Le volume $V_{BE}$ de base versée à l'équivalence.
$-\ $ Le $pH$ à l'équivalence.
b) Sachant que la valeur de $pH_{E}$ a varié de $0.15$ de la valeur précédente.
Calculer le volume $V_{e}$ d'eau.
5) Parmi les indicateurs colorés consignés dans le tableau ci-dessous,
a) Qu'appelle-t-on la teinte sensible d'un indicateur coloré ?
b) Préciser l'indicateur le plus approprié pour réaliser ce dosage ?*
Justifier.
$$\begin{array}{|c|c|} \hline \text{Indicateur coloré}&\text{Zone de virage}\\ \hline \text{Bleu de bromothymol}&6.2 - 7.4\\ \hline \text{Hélianthine}&3.1 - 4.4\\ \hline \text{Phénolphtaléine}&8.2 - 10.0\\ \hline \end{array}$$
Exercice 5
Dans un examen de travaux pratiques, un élève est chargé d'effectuer le dosage d'un volume $V_{a}=20\,mL$ d'une solution d'acide $AH$ inconnu par une solution aqueuse dhydroxyde de sodium (base forte) de concentration molaire $C_{b}$ afin d'identifier $AH.$
Au cours du dosage, l'élève suit à l'aide d'un $pH-$mètre l'évolution de $pH$ du milieu réactionnel en fonction du volume $V_{b}$ de base versée, les résultats sont consignés dans le tableau suivant :
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|c|c|c|c|c|} \hline V_{b}(mL)&0&2&4&6&8&9&9.5&10&10.5&12&14&16&18&20\\ \hline pH&2.81&3.62&4.03&4.38&4.8&5.16&5.48&8.31&11.2&11.7&11.97&12.12&12.23&12.3\\ \hline \end{array}$$
On donne une liste de $pKa$ de quelques couples acide-base qui peuvent être utiles à l'identification de l'acide.
$$\begin{array}{|c|c|c|c|c|} \hline \text{Couple}&NH_{4}^{+}/NH_{3}&HCOOH/HCOO^{-}&C_{6}H_{5}COOH/C_{6}H_{5}COO^{-}&CH_{3}NH_{3}^{+}/CH_{3}NH_{2}\\ \text{acide-base}& & & &\\ \hline pKa&9.2&3.8&4.2&10.7\\ \hline \end{array}$$
Le candidat est appelé à :
1) Faire un schéma annoté du dispositif utilisé pour ce dosage.
2) Tracer la courbe représentative de $pH=f(V_{b}).$
3) Prélever la valeur du $pH$ :
a) à l'équivalence et à déduire le caractère de l'acide.
b) A la demi-équivalence et à identifier l'acide.
c) Initial de l'acide et à calculer sa concentration $C_{a}$ en supposant que $AH$ est un acide faiblement ionisé.
4) Écrire l'équation de la réaction du dosage.
5) Calculer la concentration $C_{b}$ de la base.
6) On dilue $10$ fois la solution d'acide initial et on refait le dosage de l'acide $AH$ par la soude, tracer sue le même papier millimétrée l'allure de la nouvelle courbe de $pH=f(V_{b})$
Exercice 6 Étude d'un produit d'entretien
Sur l'étiquette d'une solution commerciale d'ammoniac $\left(NH_{3}\right)$ on lit : $\%\text{ massique}=20\%.$
On prépare $100\,mL$ d'une solution diluée, noté $S$ au $20^{ième}$ de la solution commerciale, noté $S_{0}$
Données :
$H\ :\ 1.00\,g\cdot mol^{-1}\cdot\ ;\ N\ :\ 14\,g\cdot mol^{-1}\ ;\ Ka=6.3\cdot 10^{-3}\ ;\ pKa=9.2$
1) La mesure du $pH$ à $25^{\circ}$ de la solution diluée donne $pH=12.$
a) Indiquer en justifiant la nature de cette solution.
b) Préciser le nom et la forme de son espèce conjuguée.
c) Écrire le couple acide-base auquel appartient l'ammoniac.
d) Donner le diagramme de prédominance, en fonction de $pH$, des espèces de ce couple et en déduire l'espèce prédominante dans la solution $S.$
2) Pour vérifier les indications de l'étiquette on tire un volume $V=10.0mL$ par une solution d'acide chlorhydrique de concentration $C_{A}=5.00\cdot 10^{-1}mol\cdot L^{-1}$ en présence de quelques gouttes de $BBT.$
Le changement de teinte de la solution pour un volume $V_{A}=10.8\,mL$ de solution titrante.
a) Écrire l'équation de la réaction support du dosage en précisant toutes les caractéristiques de cette transformation chimique.
b) Établir l'expression de la constante d'équilibre $K_{r}$ en fonction de la constante d'acidité $Ka.$
Calculer sa valeur et conclure.
c) Déterminer la concentration molaire $C$ de la solution ; en déduire la concentration $C_{0}$ de la solution commerciale.
d) La mesure de la masse volumique de la solution commerciale donne $\mu=920\,g\cdot L^{-1}.$
Déterminer l'expression du pourcentage massique de la solution commerciale en fonction de $C_{0}\ ;\ M\text{ et }\mu.$
Calculer sa valeur et conclure.
3) Lors de ce titrage, la mesure du $pH$ de la solution lorsqu'on a versé un volume $V'_{A}=6.0\,mL$ d'acide chlorhydrique donne $pH=9.0.$
a) Déterminer de l'avancement final, l'avancement maximal à l'aide d'un tableau descriptif de l'évolution du système chimique.
c) Montrer en calculant le taux d'avancement final que la transformation est quasi-totale.
Exercice 7 (Acide fort et acide faible)
On réalise le dosage $pH$métrique de $10\,mL$ de deux acides $AH_{1}$ et $AH_{2}$ par une solution d'hydroxyde de sodium versé.
L'un des deux acides est fort, l'autre est faible.
Acide $AH_{1}$
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|c|c|} \hline V_{B1}&0&2&4&6&8&9&9.9&10&10.1&12&15\\ \hline pH&1&1.2&1.4&1.6&2&2.3&3.3&7&10.7&12&12.3\\ \hline \end{array}$$
Acide $AH_{2}$
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|c|c|c|c|c|c|c|} \hline V_{B2}&0&1&2&3&4&5&6&7&8&9&9.9&10&10.1&11&12&15\\ \hline pH&1&2.9&3.8&4.2&4.6&4.8&5&5.2&5.4&5.8&6.8&8.7&10.7&11.7&12&12.3\\ \hline \end{array}$$
1) Faire un schéma annoté du dispositif expérimental.
2) Tracer pour les deux acides, sur un même graphique, les courbes $pH_{1}=f(V_{B1})$ et $pH_{2}=f(V_{B2}).$
Échelle : $1\,cm$ pour une unité $pH$ et $1\,cm$ pour $1\,mL.$
3) Identifier sur le graphique, l'acide fort et l'acide faible.
4) Calculer les concentrations molaires des deux acides.
5) déterminer le $pK_{A}$ et la constante d'acidité de l'acidité faible.
6) Vers quelle valeur tend le $pH$ de la solution acide lorsqu'on continue à ajouter la solution basique ?
Exercice 8
Pour déboucher les canalisations, on utilise des produits domestique qui sont des solutions concentrées d'hydroxide de sodium, $NaOH_{s}$, (soude).
Sur l'étiquette de l'un de ces produits on lit :
$-\ $ densité $d=1.2$ (masse volumique $\rho=1.2\,g\cdot cm^{-3})$
$-\ $ contient $20\%$ en masse de soude.
1) Montrer que la concentration molaire $C$ de la solution commerciale est voisine de $6\,mol\cdot L^{-1}3.$
2) Quel volume de solution commerciale faut-il prélever pour obtenir $1\,L$ de solution diluée de concentration molaire $3\cdot 10^{-3}\,mol\cdot L^{-1} ?$
Les solutions de soude sont des solutions de base forte.
3) a) Rappeler la définition d'une base forte.
b) Calculer le $pH$ de la solution diluée.
Pour vérifier sa concentration, on dose $5\,mL$ de la solution diluée par une solution d'acide chlorhydrique de concentration $C_{A}=1\cdot10^{-2}mol\cdot L^{-1}.$
4) a) Écrire l'équation bilan de la réaction.
Calculer la concentration de la solution diluée.
Retrouve-t-on la valeur souhaitée ?
Exercice 9
On réalise différentes solutions en mélangeant à chaque opération une solution aqueuse $S_{1}$ d'un acide carboxylique $R-COOH$ de volume $V_{A}$ et une solution aqueuse $S_{2}$ de carboxylate de sodium $(R-COONa)$ de volume $V_{B}.$
Les concentrations molaires des solutions utilisées pour ces mélanges sont les memes pour $S_{1}$ et $S_{2}$ et égales à $C.$
Les valeurs du $pH$ de ces solutions pour les couples de valeurs $\left(V_{A}\;,\ V_{b}\right)$ sont indiquées dans le tableau suivant:
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|} \hline V_{B}(mL)&10&10&10&10&10&20&30&40&50 \\ \hline V_{A} (mL)&50&40&30&20&10&10&10&10&10 \\ \hline pH&3.1&3.2&3.3&3.5&3.8&4.1&4.3&4.4&4.5 \\ \hline \end{array}$$
1) a) Représenter graphiquement $pH=f(x)$ avec $x=\log\dfrac{V_{B}}{V_{A}}$ ;
Échelle :
$-\ \ 10\,cm$ sur l'axe horizontal correspond à l'unité de $x.$
$-\ \ 10\,cm$ sur l'axe vertical correspond à l'unité de $pH.$
b) Montrer que $pH=f(x)$ peut se mettre sous la forme $pH=a+bx$ ; $a$ et $b$ étant deux constantes que l'on déterminera graphiquement.
3) L'acide $R-COOH$ étant supposé faible, montrer que dans le mélange obtenu on a : $$\dfrac{\left[R-COO^{-}\right]}{\left[R-COOH\right]}.$$
3) a) Établir l'expression du $pH$ du mélange obtenu en fonction du $pKa$ du rapport $$\dfrac{\left[R-COO^{-}\right]}{\left[R-COOH\right]}.$$
b) En déduire le $pKa$ de l'acide.
Exercice 10
On propose d'étudier deux solutions aqueuses $S_{1}$ et $S_{2}$
1. La solution $S_{1}$ est obtenue en faisant dissoudre dans $1\,L$ d'eau pure une masse $m$ d'acide éthanoique.
1.1 Écrire l'équation-bilan entre l'acide éthanoique et l'eau .
1.2 Le $pH$ de cette équation à $25^{\circ}C$ est $3.4$ et le $pKa$ du couple acide/base est $4.78$
1.2.1 Donner l'expression du $pH$ et calculer le rapport $\dfrac{\left[CH_{3}COO^{-}\right]}{\left[CH_{3}COOH\right]}$
1.2.2 Calculer les concentrations molaires des espèces chimiques présentes dans $S_{1}$
1.2.3 En déduire la concentration $C_{A}$ de la solution $S_{1}$
1.2.4 Déterminer la masse $m$ introduite.
2. La solution $S_{2}$ est une solution d'éthanoate de sodium de concentration molaire $C_{B}=10^{-2}mol\cdot L^{-1}$ et de $pH=8.4$ à $25^{\circ}C$
2.1 Recenser les espèces chimiques présentes dans $S_{2}$
2.2 Calculer les concentrations molaire de celle-ci
2.3 Calculer la valeur $pKa$ du couple acide/base et la composer à celle donnée au 1.2
3. On ajoute à la solution $S_{1}$ de concentration molaire $C_{A}=10^{-2}mol\cdot L^{-1}$ et de volume $V_{A}=20\,mL$, la solution $S_{2}$ de concentration $C_{B}=10^{-2}mol\cdot L^{-1}$ et de volume $V_{B}=20\,mL$ pour obtenir une solution $S.$
3.1 A partir des équations d'électroneutralité et de conservation de la matière, montrer que :
$\left[CH_{3}COOH\right]=\left[CH_{3}COO^{-1}\right]$ (On négligera les concentrations des ions $H_{3}O^{+}$ et $OH^{-}$ devant celle des ions $Na^{+}$ et on ne fera pas de calcul)
3.2 En déduire le $pH$ de la solution $S$
3.3 Donner le nom et les propriétés de la solution.
Exercice 11
On veut préparer une solution tampon à partir d'une solution commerciale d'acide éthanoique
1) On dispose d'une bouteille commerciale d'acide éthanoique sue laquelle on lit les indications suivantes :
masse molaire : $60\,g\cdot mol^{-1}$
Masse volumique : $\rho=1050\,kg/m^{3}$
Pureté : $99\%$
1.1 Déterminer le volume $V_{0}$ de la solution commerciale qu'il faut prélever pour préparer un volume $V_{a}=1\,L$ de solution d'acide étha,oique concentration $C_{a}=0.1\,mol\cdot L^{-1}$
1.2 Écrire l'équation bilan de la réaction de l'acide éthanoique avec l'eau.
2. On dispose également d'un flacon d'éthanoate de sodium en poudre portant l'indication suivante : masse molaire : $82\,g/mol$
2.1 Déterminer la masse $m_{_{b}}$ d'éthanoate de sodium qu'il faut peser pour préparer un volume $V_{b}=500\,ml$ de solution d'éthanoate de sodium de concentration $C_{b}=0.3\,mol/L$
2.2 Écrire l'équation de la dissociation de l'éthanoate de sodium dans l'eau.
2.3 Écrire l'équation de la réaction entre un ion éthanoate et l'eau.
3. Préparation de la solution tampon.
3.1 Donner les propriétés d'une solution tampon.
3.2 Donner l'expression de la constante d'acidité $Ka$ du couple d'acide éthanoique ion/éthanoate et en déduire la relation entre $pH$ et $pKa$.
3.3 A quelle condition $pH=pKa$
3.4 On veut préparer un volume $V=100\,mL$ d'une solution tampon à partir des solutions d'acide éthanoique et d'éthanoate de sodium à Utiliser
4. Détermination expérimentale du $pKa$ du couple acide éthnoique/ion éthanoate
On introduit dans un bécher $V_{a}=20\,mL$ de solution aqueuse d'acide éthanoique on verse progressivement dans le bécher une solution aqueuse d'hydroxyde de concentration molaire $C_{b}=0.1\,mol/L.$
On relève au fur et à mesure la valeur du $pH$ et on obtient le tableau de mesure ci-dessous
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|} \hline V_{b}(mL)&2&4&6&8&12&14&16&18&19\\ \hline pH&2.9&3&3.8&4.6&4.8&5&5.3&5.7&6\\ \hline \end{array}$$
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|} \hline V_{b}(mL)&19.4&19.8&20&20.4&21&22&24&26&30\\ \hline pH&6.4&6.8&8.8&10.5&11&11.3&11.6&11.8&12\\ \hline \end{array}$$
4.1 Tracer la courbe $pH=f(V_{b}$
Échelle :
$1\,cm\ \rightarrow\ $unité de $pH$
$1\,cm\ \rightarrow\ 2\,mL$
4.2 Déterminer graphiquement les cordonnées du point d'équivalence $E$
4.3 Retrouver la valeur de la concentration molaire $C_{a}$ de la solution d'acide éthanoique
4.4 Déduire de la courbe la valeur du $pKa$ du couple
$$CH_{3}COOH|CH_{3}COO^{-}$$
Exercice 12
L'étiquette d'une bouteille contenant une solution $S_{0}$ d'acide chlorhydrique porte les indications suivantes : Acide chlorhydrique masse volumique $\mu=1190\,g\cdot L^{-1}$ pourcentage en masse d'acide chlorhydrique : $37\%.$
On introduit $V=4.2\,mL$ de $S_{0}$ dans une fiole jaugée de $V_{0}=500\,mL$ contenant environ $100\,mL$ d'eau distillée et l'on complète jusqu'au trait de jauge avec de l'eau distillée.
1) Déduire le prélèvement des $4.2\,mL$ de $S_{0}.$
2) Pourquoi a-t-on introduit l'eau distillée dans la fiole jaugée avant d'introduire la solution d'acide chlorhydrique ?
3) Déterminer l'ordre de grandeur de la concentration de la solution $S$ ainsi préparé.
4) Afin de vérifier cette concentration on dose $S$ par une solution $B$ d'hydroxyde de potassium de concentration $C_{B}=4.00\cdot 10^{-2}mol/L.$
Dans $20\,mL$ de cette dernière solution on verse $V_{S}\,mL$ de la solution $S$ et l'on mesure le $pH$ après chaque ajout.
On obtient les résultats suivants :
$$\begin{array}{|c|c|c|c|c|c|c|c|c|} \hline V_{S}&0&1&2&3&4&5&6&7\\ \hline pH&12.6&12.5&12.45&12.35&12.25&12.10&11.95&11.70\\ \hline V_{S}&8&8.5&9&10&11&12&13&\\ \hline pH&11.15&3.60&2.72&2.30&2.10&2.0&1.90&\\ \hline \end{array}$$
a) Faire un schéma annoté du dispositif utilisé pour le dosage.
b) Construire la courbe $pH=f(V_{S}).$
Déterminer le volume équivalent $V_{Se}.$
c) En déduire la concentration de la solution $S.$
Conclure.
5) Choisir dans la liste ci-dessous un indicateur coloré adapté pour ce dosage et indiquer l'évolution de teinte lors du virage.
Justifier la réponse.
Indicateur
a) Hélianthine
b) Bleu de bromophénol
c) Bleu de bromothymol
Zone de virage et couleur
$-\ $ rouge $3.1\ -\ 4.4$ jaune
$-\ $ jaune $3.0\ -\ 4.6$ bleu
$-\ $ jaune $6.0\ -\ 7.6$ bleu

Commentaires
Ibrahim (non vérifié)
mer, 01/18/2023 - 11:07
Permalien
Témoignage
Tsahirou yacouba (non vérifié)
sam, 02/03/2024 - 06:19
Permalien
Pc
Sns (non vérifié)
lun, 04/29/2024 - 09:33
Permalien
Exercice 2
Hicham (non vérifié)
mer, 02/07/2024 - 16:58
Permalien
Merci
Baye diery (non vérifié)
lun, 04/07/2025 - 17:18
Permalien
Réussir le bac
Ajouter un commentaire