Les acides a-aminés - Ts
Classe:
Terminale
I. Généralités sur les acides $\alpha-$ aminés
1. Définition
On appelle acide aminé ou aminoacide, un composé organique renfermant, dans la même la molécule les deux groupements fonctionnels carboxyle et amino : c'est un composé polyfonctionnel
L'acide est $\alpha–$ aminé si le groupement amino est fixé sur le carbone directement lié au carbone du groupement carboxyle
La formule générale sera 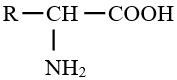
Le groupe amino $-$ $NH_{2}$ est fixé sur le carbone situé en $\alpha$ du groupe carboxyle
2. Nomenclature
2.1 Nomenclature systématique
Le nom de l'acide $\alpha-$ aminé s'obtient en faisant précéder du terme $2-$ amino le nom de l'acide correspondant
En effet, pour un acide $\alpha-$ aminé ; c'est nécessairement le carbone numéro $2$ qui porte le groupe $-NH_{2}$ puis que le carbone du groupe carboxyle situé en bout de chaine porte le numéro $1$
Exemples :
$H_{2}N-CH_{2}-COOH$ : Acide amino éthanoïque
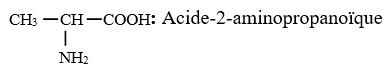
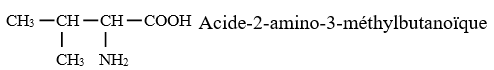

2.2 Nomenclature usuelle
Les acides $\alpha-$ aminés naturels qui ont une très grande importance biologique ont des noms consacrés par l'usage
Exemples
$H_{2}N-CH_{2}-COOH$ : Glycine (Gly)

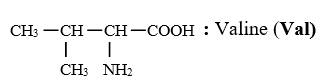
II. La stéréochimie
1. Carbone asymétrique
Un carbone asymétrique est un carbone tétragonal lié à quatre atomes ou groupements différents.
On le repère habituellement par un astérisque $(\ast)$
Exemples

2. Chiralité
La chiralité est la propriété d'un objet de ne peut être superposable à son image dans un miroir
Remarques
$-\ $ Une molécule qui comporte un seul carbone asymétrique est toujours chirale
$-\ $ Une molécule comportant plusieurs carbones asymétriques peut être achirale
$-\ $ Une molécule ou un objet qui possède un centre de symétrie ou plan de symétrie n'est pas chirale
Remarque :
Les acides $\alpha-$ aminés naturels : sont tous chirals (et donc optiquement actifs), à l'exception de la glycine pour laquelle le substituant latéral est un atome d'hydrogène sont tous de configuration $“L”$ selon la convention de Fischer
3. Énantiomérie
L'énantiomérie est la relation existant entre deux stéréoisomères de configurations image de l'une de l'autre dans un miroir et non superposables
De manière générale :
Deux stéréoisomères non superposables et image de l'une de l'autre dans un miroir sont appelés énantiomères (ou énantiomorphes ou antipodes optiques)
La représentation de Cram permet de représenter la géométrie spatiale des molécules : les liaisons situées dans le plan sont représentées par un trait plein, les liaisons pointant vers l'avant par un triangle plein et celles pointant vers l'arrière par un triangle hachuré
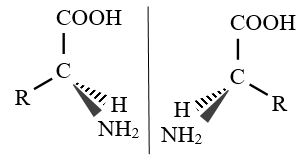
4. Représentation de Fischer
La représentation de Fischer s'obtient en projetant la structure spatiale sur le plan en respectant impérativement les conventions suivantes :
$-\ $ la chaine carbonée est disposée dans le plan vertical
$-\ $ le groupe en haut, le groupe en bas
$-\ $ ces deux groupes vers l'arrière
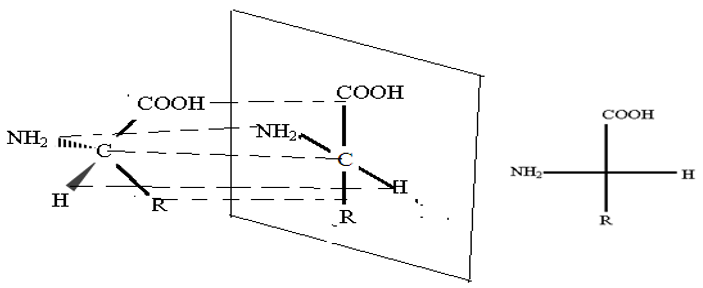
En projetant sur le plan de la feuille, on obtient deux représentations possibles
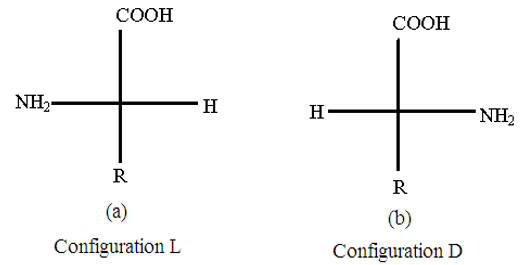
Dans la représentation (a), le groupe $-NH_{2}$ se situe à gauche de la chaine carbonée, par convention l'isomère a la configuration $L$ Dans la représentation (b), le groupe $-NH_{2}$ se projette à droite de la chaine carbonée, par convention l'isomère a la configuration $D$
III. Quelques propriétés des acides $\alpha-$ aminés
1. Activité optique
Ces substances ont la propriété de faire tourner le plan de la polarisation d'une lumière polarisée
$-\ $ soit à droite : la substance est dite dextrogyre ou présente le pouvoir rotatoire $(+)$
$-\ $ soit à gauche : elle dite lévogyre ou présente un pouvoir rotatoire $(-)$
Le mélange en proportion équimolaire de ses deux isomères $(+)$ et $(-)$ est sans sur la lumière polarisée.
Ce mélange est appelée mélange racémique ou inactif par compensation
Remarque :
Les lettres $D$ et $L$ représente la configuration du carbone asymétrique dans chacun des énantiomères et non le signe de leur pouvoir rotatoire
2. Propriétés acido-basiques des acides $\alpha-$ aminés
Les acides $\alpha-$ aminés possèdent à la fois les propriétés des acides carboxyliques et des amines.
Comme un acide avec une amine, le composé $R-CH\left(NH_{2}\right)-COOH$ ne peut pas exister en solution aqueuse.
Il sous la forme :
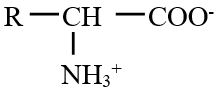
Cette espèce chimique est appelée zwitterion ou amphion ou ion dipolaire.
Un acide carboxylique réagit avec une amine selon la réaction :
$R_{1}-COOH+R_{2}-NH_{2}\ \longrightarrow\ R_{1}-COO^{-}+R_{2}-NH_{3}^{+}$
L'acide fournit un proton qui est capté par la base.
Dans le cas d'un acide $\alpha-$ aminé, cette réaction acide-base se produit de manière intramoléculaire
$H_{2}N-CHR-COOH\ \longrightarrow\ H_{3}N^{+}-CHR-COO^{-}$
base acide zwittérion
On passe de la forme moléculaire à la forme zwittérion (amphion)
A l'état solide une molécule d'acide $\alpha-$ aminé se trouve sous la forme zwittérion
En solution aqueuse, en l'absence d'apport d'acide et de base, la forme zwittérion est largement prépondérante
2.1 Forme cationique en milieu acide
En milieu fortement acide, les ions $H_{3}O^{+}$ réagissent avec le zwittérion selon la réaction pratiquement totale :
$H_{3}N^{+}-CHR-COO^{-}+H_{3}O^{+}\ \longrightarrow\ H_{3}N^{+}-CHR-COOH+H_{2}O$
On obtient la forme cationique
Le couple cation$/$zwittérion est : $H_{3}N^{+}-CHR-COOH|H_{3}N^{+}-CHR-COO^{-}.$
Il est caractérisé par un $pKa_{1}.$
L'espèce majoritaire à $pH<pKa_{1}$ est l'acide du couple, c'est-à-dire, la forme cationique
2.2 Forme anionique en milieu basique
En milieu fortement basique, les ions $OH^{-}$ majoritaire réagissent avec le zwittérion en déprotonant le groupe ammonium $–NH_{3}^{+}$ selon une réaction pratiquement totale :
$H_{3}N^{+}-CHR-COO^{-}+OH^{-}\ \longrightarrow\ H_{2}N-CHR-COO^{-}+H_{2}O$
On obtient la forme anionique
Le couple zwittérion$/$anion est : $H_{3}N^{+}-CHR-COO^{-}|H_{2}N-CHR-COO^{-}.$
Il est caractérisé par un $pKa_{2}.$
L'espèce majoritaire à $pH>pKa_{2}$ est l'acide du couple, c'est-à-dire, la forme anionique
2.3 Forme prédominante selon $pH$
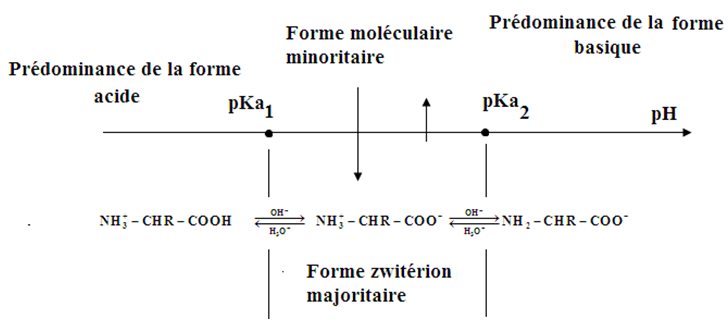
2.4 Point isoélectrique
Pour chaque acide aminé, il existe une valeur spécifique du $pH$ où la charge globale de la molécule est nulle.
Cette valeur de $pH$ (pHi) représente le point isoélectrique où la concentration du zwitterion de l'acide aminé est maximale.
La charge globale portée par les différentes formes ioniques de l'acide aminé en solution dépend de la valeur du $pH$ de la solution.
La charge électrique globale est nulle lorsque le $pH$ de la solution est égal au $pH_{i}.$
Le point isoélectrique peut être estimé à partir de l'équation de Henderson-Hasselbalch :
$pH=pKa_{1}+\log\dfrac{\left[R-CH\left(NH_{3}^{+}\right)-COOH\right]}{\left[R-CH\left(NH_{3}^{+}\right)-COO^{-}\right]}$ ;
$pH=pKa_{2}+\log\dfrac{\left[R-CH\left(NH_{3}\right)-COO^{-}\right]}{\left[R-CH\left(NH_{3}^{+}\right)-COO^{-}\right]}$
Au point isoélectrique $pH=pH_{i}$
et $\left[R-CH\left(NH_{3}^{+}\right)-COOH\right]=\left[R-CH\left(NH_{3}\right)-COO^{-}\right]$
$\Rightarrow 2pH_{i}=pKa_{1}+pKa_{2}+\log\dfrac{\left[R-CH\left(NH_{3}^{+}\right)-COOH\right]}{\left[R-CH\left(NH_{3}^{+}\right)-COO^{-}\right]}+\log\dfrac{\left[R-CH\left(NH_{3}\right)-COO^{-}\right]}{\left[R-CH\left(NH_{3}^{+}\right)-COO^{-}\right]}$
$\Rightarrow 2pH_{i}=pKa_{1}+pKa_{2}+\log\dfrac{\left[R-CH\left(NH_{3}^{+}\right)-COOH\right]}{\left[R-CH\left(NH_{3}^{+}\right)-COO^{-}\right]}\times\dfrac{\left[R-CH\left(NH_{3}\right)-COO^{-}\right]}{\left[R-CH\left(NH_{3}^{+}\right)-COO^{-}\right]}=pKa_{1}+pKa_{2}$
$\Rightarrow \boxed{pH_{i}=\dfrac{pKa_{1}+pKa_{2}}{2}}$
Elle est positive lorsque le pH de la solution est inférieur au $pH_{i}$ et négative lorsque le $pH$ de la solution est supérieur au $pH_{i}.$
IV. Les polypeptides et les protéines
1. Les polypeptides
1.1 Liaison peptidique
Cette liaison s'établit entre la fonction amine d'un acide aminé et la fonction acide d'un autre acide aminé selon le schéma :
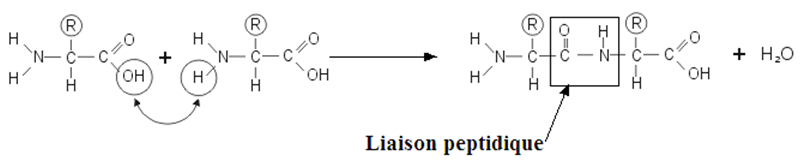
En fonction du nombre d'acides aminés liés les uns aux autres, on est en présences des peptides ou des polypeptides.
A partir de cinquante acides aminés environ, les composés sont appelés protéines
Lors qu'on écrit la formule d'un peptide, on écrit toujours à gauche le groupement $-NH_{2}$ terminal et à droite le groupement $–COOH$ terminal
Exemple :
Le tripeptide formé dans l'ordre par les trois acides $\alpha-$ aminés Gly, Ala, Val, s'écrit donc :
$H-$Gly$-$Ala$-$Val$-OH$
1.2 Synthèse des peptides
Si mélange plusieurs acides aminés, les possibilités de combinaison augmentent avec le nombre d'acides aminés
Pour obtenir un peptide donné, on bloque certaines fonctions et on active d'autres
Il faut que ces réactions soient réversibles.
Par exemple :
$-\ $ on bloque la fonction carboxyle par la formation d'un ester
$-\ $ on bloque la fonction amine par la formation d'un amide
$-\ $ on active la fonction carboxyle en la transformant en chlorure d'acyle
$-\ $ on débloque le groupe amino et le groupe carboxyle des acides$ -\alpha$ aminés qui étaient bloqués.
Exemple :
synthèse du dipeptide $H-$Gly$-$Ala$-OH$
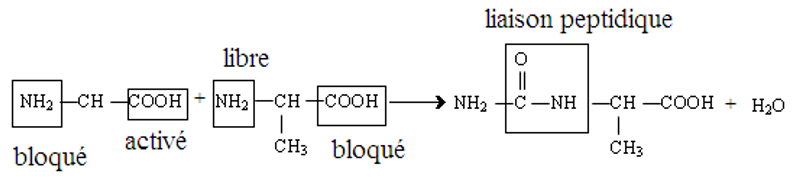
Remarque :
La dénomination d'acide $\alpha-$ aminé $N-$ terminal est réservée à celui qui porte la fonction amine $-NH_{2}$ libre et d'acide $\alpha-$ aminé $C-$ terminal à celui qui porte le groupe carboxyle libre $-COOH$
2. Les protéines
Les protéines sont des polypeptides complexes de masse molaire très élevée
Ce sont des macromolécules formées par un enchainement d'acides $\alpha-$ aminés : ce sont des polyamides
Remarques :
$-\ $ La structure primaire d'une protéine est définie par la nature des acides
$\alpha-$ aminés constitutifs et par l'ordre selon lequel ils sont assemblés dans la chaine du polypeptide
$-\ $ On obtient des acides $\alpha-$ aminés constitutifs par hydrolyse soit à chaud en milieu acide ; soit dans des conditions beaucoup plus douces en présence en d'enzymes
Exemple :
Hydrolyse du tripeptide Ala$-$Gly$-$Ala
$H_{2}N-CH\left(CH_{3}\right)-CO-NH-CH_{2}-CO-CH\left(CH_{3}\right)-COOH+2H_{2}O\ \longrightarrow\ H_{2}N-CH_{2}-COOH+2H_{2}N-CH\left(CH_{3}\right)-COOH$
Compléments
Une protéine, aussi appelée protide (anglicisme) est un assemblage (ou séquence) d'acides aminés liés par des liaisons peptidiques.
On parle de protéine lorsque plus de $50$ acides aminés sont liés au sein d'une chaîne d'acides aminés.
Les propriétés des acides aminés (charge, hydrophobicité...) gouvernent la structure de la protéine, globulaire ou fibrillaire, que l'on peut décrire à différents niveaux :
$-\ $ la structure primaire, qui est la séquence linéaire des acides aminés dans la protéine ;
$-\ $ la structure secondaire, qui rend compte de l'organisation de groupes d'acides aminés en éléments structuraux simples : hélices alpha, feuillets et tours béta, autres structures ;
$-\ $ la structure tertiaire, qui correspond au repliement de la protéine dans l'espace tridimensionnel (on parle aussi de structure tridimensionnelle décrite par les coordonnées des atomes dans l'espace).
Cette structure rend compte de l'organisation entre eux des éléments de structure secondaire ;
$-\ $ la structure quaternaire, qui définit l'association (multimérisation) entre des protéines de structures primaires identiques (homoassociation) ou distinctes (hétéroassociation).
Les protéines ont des fonctions très diverses : certaines pourront avoir une fonction structurale (elles participent à la cohésion structurale des cellules entre elles), enzymatique (elles catalysent les réactions chimiques de la matière vivante) ou encore une fonction de messager (pour les protéines impliquées dans des processus de signalisation cellulaire
Exercice d'application
Les protéines entrent dans la constituions des organismes vivants et participent a leur fonctionnement en intervenant dans un grand nombre de réactions biochimique.
Ceux sont des macromolécules constitues par association d'acide $\alpha-$ aminé par liaison peptidique.
On donne les masses molaires :
$M_{C}=12g/mol$
$M_{H}=1g/mol$
$M_{N}=14g/mol$
$M_{O}=16g/mol$
$M_{Na}=23g/mol$
On se propose d'identifier un peptidique noté $D$ résultant de la réaction entre deux acides $\alpha-$ aminé $A$ et $B$
1. Des méthodes d'analyses quantitatives ont permis de déterminer les pourcentages massiques de carbones d'hydrogène et du composé $A$ :
Soient : $\%C=40.45$ $\%H=7.87$ $\%N=15.72$
1.1 Le composé $A$ ne contenant qu'un atome d'azote par molécule vérifié que sa formule brute s'écrit $C_{3}H_{7}NO_{2}$
1.2 Le composé est précisément un acide $\alpha-$ aminé.
Écrire sa formule semi développe et donnez son nom dans la nomenclature officiel
2. Par rection de $A$ avec un autre acide $\alpha-$ aminé $B$ de formule brute $C_{5}H_{11}O_{2}$
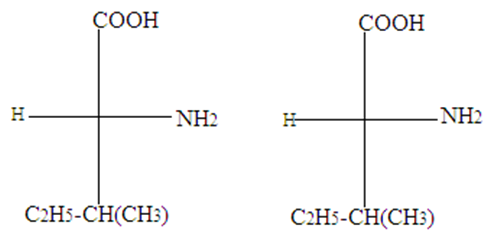
2.1 Écrire la formule semi développé de $B$ sachant que sa molécule deux atomes carbones asymétriques et donnez son nom dans la nomenclature officiel.
2.2 Représentez les couples d'énantiomères en utilisant la représentation de Fisher et en précisant les conventions utilisées
2.3 Écrire à l'aide de formule développé l'équation bilan traduisant la synthèse du peptide $D$ sachant qu'$A$ est l'acide $\alpha-$ aminé $C-$ terminal.
Encadrer la liaison peptide.
3. On effectue une décarboxylation de $A$ par chauffage.
Le composé organique azoté obtenu est dessous dans l'eau pour donner une solution $S.$
3.1 Écrire l'équation bilan de la réaction de décarboxylation d'$A.$
Nommer le produit $E.$
3.2 La concentration molaire de $S$ est $C=0.15mole/L$ et son $pH=12.$
Déterminer le $pKa$ du couple acide-base correspondant à $E.$
3.3 Dans la pratique ce $pKa=11.$
Sur un axe gradué en unité de $ph$ placé les domaines de prédominance des diverses formes en justifiant la réponse
Solution
1.1.1 Vérifions que la formule brute du composé $A$ s'écrit $C_{3}H_{7}NO_{2}$
Soit $C_{x}H_{y}NO_{z}$ la formule brute du composé
On a :
$\begin{array}{lcl} \dfrac{12x}{\%C}&=&\dfrac{y}{\%H}\\&=&\dfrac{16z}{\%O}\\&=&\dfrac{14}{\%N}\\&\Rightarrow&x=\dfrac{14\times\%C}{\%N\times 12}\\&=&\dfrac{14\times40.45}{15.72\times 12}\\&\Rightarrow&x=3 \end{array}$
$\begin{array}{lcl} y&=&\dfrac{14\times\%H}{\%N\times 1}&=&\dfrac{14\times 7.87}{15.72\times 1}\\&\Rightarrow&y=7 \end{array}$
$\begin{array}{lcl} z&=&\dfrac{14\times\%O}{\%N\times 16}&=&\dfrac{14\times(100-(40.45+15.72+7.87))}{15.72\times 16}\\&\Rightarrow&z=2 \end{array}$
$\Rightarrow\boxed{C_{3}H_{7}NO_{2}}$
1.1.2 Formule semi $-$ développée et nom de l'acide $\alpha-$ aminé dans la nomenclature officiel
Il a pour formule semi $-$ développée : $CH_{3}-CH\left(NH_{2}\right)-COOH$ : acide $-2-$ aminopropanoïque
1.2.1.1 Formule semi développé de $B$
$C_{2}H_{5}-CH\left(CH_{3}\right)-CH\left(NH_{2}\right)-COOH$ : cide $-2-$ amino $-3-$ méthylpentanoïque
1.2.1.2 Représentation des couples d'énantiomères
1.2.2 Équation bilan traduisant la synthèse du peptide $D$ sachant qu'$A$ est l'acide $\alpha-$ aminé $C-$ terminal.
$C_{2}H_{5}-CH\left(CH_{3}\right)-CH\left(NH_{2}\right)-COOH+CH_{3}-CH\left(NH_{2}\right)-COOH\ \longrightarrow\ C_{2}H_{5}-CH\left(CH_{3}\right)-CH\left(NH_{2}\right)-CO-NH-CH\left(CH_{3}\right)-COOH+H_{2}O$
3.1 Équation bilan de la réaction de décarboxylation d'$A$
$CH_{3}-CH\left(NH_{2}\right)-COOH\stackrel{\Delta}{\longrightarrow}CH_{3}-CH_{2}-NH_{2}+CO_{2}$
$E\ :\ CH_{3}-CH_{2}-NH_{2}$ : Ethanamide
1.3.2.1 Détermination du $pKa$ du couple acide-base correspondant à $E$
La solution d'éthanamide est une solution de base faible
$\begin{array}{lcl} pH&=&\dfrac{1}{2}(pKe+pKa+\log\,C)\\&\Rightarrow&pKa=2pH-pKa-\log\,C\\&=&2\times 12-14-\log\,0.15\\&\Rightarrow&pKa=10.8 \end{array}$
1.3.2 Domaines de prédominance des diverses formes
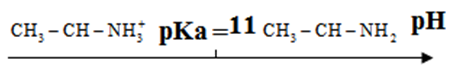
Un catalyseur est une substance qui accélère une réaction sans entrer dans le bilan de la réaction et sans modifier l'état final du système.
$-\ $ La catalyse est dite homogène lorsque le catalyseur et le mélange réactionnel constituent une seule phase (forment un mélange homogène).
$-\ $ La catalyse est dite hétérogène lorsque le catalyseur et le milieu réactionnel se trouvent dans des phases différentes.
Les enzymes sont des catalyseurs biologiques qui permettent aux transformations chimiques nécessaires à la vie de s'effectuer à vitesse élevée.
$-\ $ Un catalyseur est sélectif si, à partir d'un système initial susceptible d'évoluer selon plusieurs réactions spontanées, il accélère préférentiellement l'une d'elles.

Commentaires
oumar ciss (non vérifié)
sam, 07/25/2020 - 16:08
Permalien
suggestion
Diédhiou (non vérifié)
jeu, 09/19/2024 - 01:10
Permalien
Merci beaucoup pour le
Ajouter un commentaire