Éléments, atomes, classifications des éléments - 2nd S
Classe:
Seconde
I. Éléments
1. Mise en évidence de l'élément carbone
1.1 Pyrolyse du bois
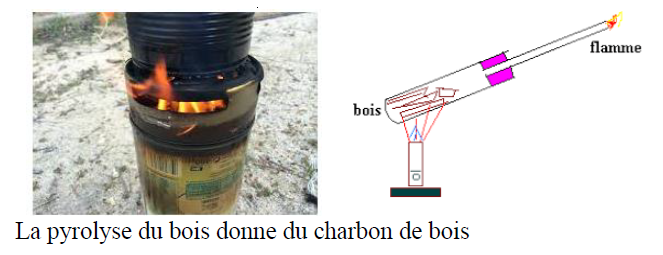
La pyrolyse du bois donne du charbon de bois
1.2 Pyrolyse du sucre
La pyrolyse du sucre donne un solide noir appelé charbon de sucre

1.3 Conclusion
Le charbon de bois (produit de la pyrolyse du bois), le solide noir (résidu de la pyrolyse du sucre) contiennent un constituant commun : le carbone
2. Définition de l'élément chimique
Un élément chimique est un constituant commun à tous les corps qui le contiennent
Remarque
$-\ $ Les corps purs simples sont formés d'un seul élément
Exemples :
le dihydrogène est formé de l'élément hydrogène ; le dioxygène est formé de l'élément oxygène
$-\ $ Les corps purs composés sont formés de plusieurs éléments
Exemples :
l'oxyde de dihydrogène (eau) est formé de l'élément oxygène et l'élément hydrogène ; le dioxyde de carbone (gaz carbonique) est formé de l'élément oxygène et de l'élément carbone
3. Notation de l'élément chimique
Pour faciliter l'étude de la chimie, les éléments sont représentés par des symboles
Généralement, on utilise la première lettre majuscule du nom (français, latin, grec, étranger...)
Lorsque plusieurs éléments commencent par la même lettre, on ajoute une seconde lettre minuscule pour les différencier
Symboles de quelques éléments chimiques
$$\begin{array}{|c|c|c|c|c|c|c|c|c|} \hline \text{Elément}&\text{Hydrogène}&\text{Carbone}&\text{Fer}&\text{Sodium}&\text{Azote}&\text{Oxygène}&\text{Fluor}&\text{Calcium}\\\hline \text{Symbole}&H&C&F&Na&N&O&F&Ca \\ \hline \end{array}$$
II. Atomes
La matière est faite à partir des particules extrêmement petites appelées atomes.
Les propriétés chimiques des corps purs peuvent être interprétées à partir d'un modèle unique d'atome
1. Dimension de l'atome
L'atome est représenté par une sphère infiniment petite.
Le diamètre de l'atome est de l'ordre de l'Angstrom $($symbole ; $A^{\circ})$ ; $1\,A^{\circ}=10^{-15}m$
2. Les constituants de l'atome
2.1 Le modèle atomique
L'atome peut être modélisé par une structure présentant un noyau autour duquel existe une zone dans laquelle on peut trouver les électrons.
Cette partie de l'atome est appelée nuage électronique
2.2 Les caractéristiques des constituants de l'atome
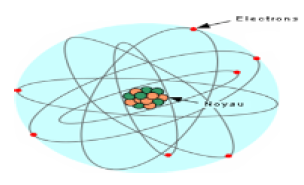
Les expériences montrent que l'atome est constitué de protons, de neutrons et d'électrons
$$\begin{array}{|c|c|c|} \hline \text{Particule}&\text{Masse}&\text{Charge}\\ \hline \text{Proton}&m_{p}=1.672\cdot10^{-26}kg&q_{n}=1.6\cdot10^{-19}C\\ \hline \text{Neutron}&m_{n}=1.674\cdot10^{-26}kg&q_{n}=0C\\ \hline \text{Electron}&m_{e}=9.1\cdot10^{-31}kg&q_{e}=1.6\cdot10^{-19}C\\ \hline \end{array}$$
Remarque :
$-\ $ La masse $m_{p}=m_{n}=1836\,m_{e}.$
La masse des électrons est $1836$ fois plus petite que celle du proton ; donc négligeable par rapport à celle-ci
$-\ $ Les charges des protons et des électrons sont identiques et ces particules sont en même nombre dans l'atome ; l'atome est donc électriquement neutre
3. Structure de l'atome
3.1 Le noyau
Le noyau est constitué de deux types de particules : les neutrons et les protons.
Ces deux types particules constituants du noyau sont appelés nucléons
Chaque atome est caractérisé par :
$-\ $ le nombre de protons $Z$ qu'il renferme.
Ce nombre est aussi appelé numéro atomique ou nombre de charge
$-\ $ le nombre de nucléons $A$ qu'il renferme.
Ce nombre est aussi appelé nombre de masse : $A=Z+N$
$N$ étant le nombre de neutrons
On symbolise le noyau des atomes par :

$A=Z+N=$ nombre de masse d'un noyau, c'est le nombre de nucléons $($protons $+$ neutrons$)$ qu'il contient.
$Z=$ numéro atomique d'un noyau, c'est le nombre de protons qu'il contient.
Exemples :
$_{6}^{12}C$ ; $_{8}^{16}O$ ; $_{1}^{1}H$ ; $_{7}^{14}N$
Remarque :
Des atomes sont dits isotopes lorsqu'ils renferment le même nombre de protons mais de nombre de nucléons (ou nombre de neutrons) différents
Exemples :
$_{6}^{12}C$, $_{6}^{13}C$ et $_{6}^{14}C$ ;
$_{1}^{1}H$, $_{1}^{2}H$ et $_{1}^{3}H$
3.2 Le nuage électronique
3.2.1 Notion du niveau d'énergie
Les électrons d'un atome sont répartis en couche de niveau d'énergie différent.
Pour arracher les électrons d'une même couche, il faut lui fournir la même énergie.
On dit que les électrons d'une même couche ont le même niveau d'énergie
Les couches sont désignées par des lettres $K$, $L$, $M$, $N$, $O$, $P$, $Q\ldots.$
A chaque couche correspond un nombre entier positif $n$
$$\begin{array}{|c|c|c|c|c|c|c|c|} \hline n&1&2&3&4&5&6&7\\ \hline \text{Lettre}&K&L&M&N&O&P&Q\\ \hline \end{array}$$
3.2.2 Règle de remplissage des couches
La répartition des électrons d'un atome sur les différentes couches ou niveaux d'énergie obéit à deux règles :
$-\ $ la première règle ; le nombre maximal d'électrons pouvant à une couche est : $N=2n^{2}$
Exemples :
Couche $K$ : $N=2\times1^{2}\Rightarrow\;N=2$ électrons
Couche $L$ : $N=2\times2^{2}\Rightarrow\;N=8$ électrons
Couche $M$ : $N=2\times3^{2}\Rightarrow\;N=18$ électrons
$-\ $ la deuxième règle ; on remplit successivement les couches dans l'ordre $K$, $L$, $M$, $N\ldots.$
Une couche ne commence à se remplir que si la précédente est saturée
3.2.3 La configuration électronique
Pour donner la structure électronique ou la configuration électronique, on représente tous les électrons par des points $(.)$ dans des cases portant autant de places disponibles dans une couche déterminée
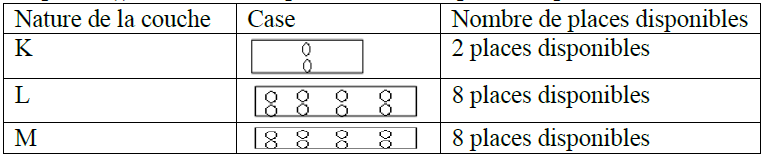
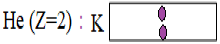
Exemples :

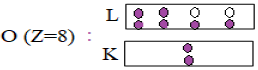
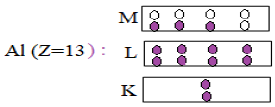
3.2.3 La formule électronique
On écrit la lettre qui correspond à chaque couche et on indique en exposant en haut à droite le nombre d'électrons par couche
Exemples :
$H\;(Z=1)\ :\ K^{1}$ ;
$He\;(Z=2)\ :\ K^{2}$ ;
$Li\;(Z=3)\ :\ K^{2}L^{1}$ ;
$C\;(Z=6)\ :\ K^{2}L^{4}$ ;
$O\;(Z=8)\ :\ K^{2}L^{6}$
$Al\;(Z=13)\ :\ K^{2}L^{8}M^{3}$
3.3 Structure de Lewis d'un atome
La représentation de Lewis permet de mettre en évidence les électrons de la couche externe ou couche périphérique.
Les électrons célibataires sont représentés par des points $(.)$ ; les doublets sont représentés par un tiret $(-)$ placé autour de l'élément considéré
Exemples :
$$\begin{array}{|c|c|c|c|c|c|c|c|c|} \hline \qquad\quad\text{Symbole}\qquad&\quad H\quad&\quad C\quad&\quad N\quad&\quad O\quad&\quad P\quad&\quad Cl\quad&\quad Na\quad&\quad Ne\quad\\ \hline \end{array}$$

3.4 Valence d'un atome
Le nombre d'électrons célibataires que possède l'élément est la valence
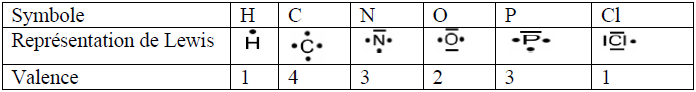
Hydrogène : monovalent ; Oxygène : divalent ; Azote : trivalent ; Carbone : Tétravalent.
4. Masse de l'atome
La masse $M$ de l'atome est la relation suivante :
$M=m_{\text{noyau}}+m_{\text{électrons}}\Rightarrow\ \boxed{M=Zm_{p}+Nm_{n}+Zm_{e}}$
Si $m_{p}=m_{n}\Rightarrow\;M=Zm_{p}+Nm_{p}+Zm_{e}$
$\Rightarrow M=(Z+N)m_{p}+Zm_{e}\Rightarrow\ \boxed{M=Am_{p}+Zm_{e}}$
Si on néglige la masse des électrons $\Rightarrow\ \boxed{M=Am_{p}}$
5. Structure lacunaire de l'atome
La matière de l'atome est essentiellement concentrée dans son noyau.
Les électrons tournent autour du noyau.
Les distances séparant le noyau des électrons sont très grandes.
Ainsi, la plus grandes partie (volume) est constituée de vide.
On dit que l'atome a une structure lacunaire
III. Classification périodique des éléments chimiques
1. Principe de la classification
$-\ $ Les éléments chimiques sont classés par numéro atomique $Z$ croissant ;
$-\ $ Les éléments dont les atomes ont le même nombre d'électrons sur leur couche externe sont disposés dans une même colonne verticale et constituent un groupe ou une famille
$-\ $ Chaque ligne ou période correspond au remplissage d'une couche électronique
2. Tableau simplifié
Le tableau simplifié comporte trois lignes ou périodes et huit colonnes ou groupe
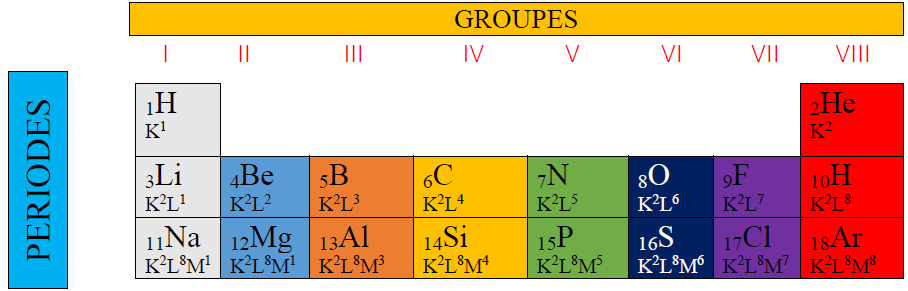
3. Intérêt de la classification périodique
Les atomes des éléments de même colonne ont le même nombre d'électrons périphériques.
Ils ont des propriétés chimiques semblables et forment un groupe ou famille
Considérons quelques exemples :
3.1 La famille des métaux alcalins
$-\ $ A l'exception de l'hydrogène, les éléments de la première colonne constituent le groupe des alcalins.
$-\ $ Ils ont la même structure électronique externe.
Il possède 1 électron sur la couche électronique externe.
$Li$ (Lithium) ;
$Na$ (Sodium) ;
$K$ (Potassium)
$-\ $ Les corps simples correspondant à ces éléments sont appelés les métaux alcalins.
$-\ $ Ce sont des corps mous, légers à l'éclat métallique, très réactifs chimiquement.
$-\ $ Ils sont oxydés par le dioxygène de l'air.
Il faut les conserver dans le pétrole, à l'abri de l'air.
3.2 La famille des Halogènes
$-\ $ Les éléments de la $7^{ième}$ colonne constituent la famille des Halogènes.
Ces éléments possèdent la même structure électronique externe à $7$ électrons.
$F$ (Fluor) ;
$Cl$ (Chlore) ;
$Br$ (brome) ;
$I$ (iode)
$-\ $ Ils existent sous la forme de molécules diatomiques :
$-\ $ Le difluor, le dichlore (gaz jaune-vert), le dibrome (liquide jaune-orangé), le diiode (solide violet foncé).
3.3 La famille des gaz nobles
$-\ $ Ce sont les éléments de la dernière colonne.
$-\ $ L'Hélium mis à part, ils possèdent une structure externe à huit électrons appelée octet d'électrons.
$He$ (Hélium) ;
$Ne$ (Néon) ;
$Ar$ (Argon)
$-\ $ Ils possèdent une grande stabilité chimique.
Ce sont des gaz monoatomiques, on les appelle les gaz rares ou gaz inertes
4. Les ions monoatomiques
Certains atomes peuvent perdre ou gagner des électrons et deviennent des ions simples
4.1 Les cations
Un cation ou ion positif provient d'un atome qui a perdu un ou plusieurs électron(s)
Exemples :
$Na\longrightarrow Na^{+}+e^{-}$
$Al\longrightarrow Al^{3+}+3e^{-}$
$B\longrightarrow B^{3+}+3e^{-}$
$Mg\longrightarrow Mg^{2+}+2e^{-}$
$H\longrightarrow H^{+}+e^{-}$
$Li\longrightarrow Li^{+}+e^{-}$
De manière générale : $M\longrightarrow Mn^{+}+ne^{-}$
4.2 Les anions
Un anion ou ion négatif provient d'un atome qui a gagné un ou plusieurs électron(s)
Exemples :
$Cl^{+}e^{-}\longrightarrow Cl^{-}$
$P+3e^{-}\longrightarrow P^{3-}$
$N+3e^{-}\longrightarrow N^{3-}$
$Mg+2e^{-}\longrightarrow Mg^{2-}$
$F+e^{-}\longrightarrow F^{-}$
$H+e^{-}\longrightarrow H^{-}$
De manière générale : $M+ne^{-}\longrightarrow M^{n-}$

Commentaires
Sarr (non vérifié)
dim, 01/26/2020 - 18:46
Permalien
Être scientifique
Eleve (non vérifié)
mar, 02/18/2020 - 01:57
Permalien
Les cours
Bamba (non vérifié)
mar, 12/15/2020 - 18:23
Permalien
Ecole
Falaye (non vérifié)
sam, 10/15/2022 - 15:04
Permalien
Pourquoi vous avez pas corrigé les exercices sur elelments atomc
Arame sow (non vérifié)
ven, 01/05/2024 - 19:41
Permalien
Pour réussite en matriéré
Eleve de la 2ndS (non vérifié)
jeu, 04/23/2020 - 01:56
Permalien
Apprendre
Khadi (non vérifié)
lun, 02/12/2024 - 12:17
Permalien
Réussir
Anonyme (non vérifié)
mer, 09/02/2020 - 01:27
Permalien
pour le symbole du fer c Fe
Anonyme (non vérifié)
mer, 09/02/2020 - 02:44
Permalien
Ça c'est pas fer c'est Fluor
Moustapha782004 (non vérifié)
jeu, 11/19/2020 - 21:59
Permalien
Pc
Diaw (non vérifié)
dim, 02/14/2021 - 20:16
Permalien
Réussir
Fatou Badio (non vérifié)
mer, 01/12/2022 - 23:51
Permalien
Math pc svt
Anonyme (non vérifié)
mer, 11/22/2023 - 18:14
Permalien
C vrai
Anonyme (non vérifié)
sam, 01/16/2021 - 18:36
Permalien
c un cours qui est trés bien
fcherif
sam, 01/16/2021 - 18:57
Permalien
pour les exercices y en a
pour les exercices y en a faut aller sur Exercices ensuite Exercices physique chimie en fin Exercices physique chimie 2nd vous aurez les séries làba
Anonyme (non vérifié)
mer, 02/10/2021 - 23:22
Permalien
Trés intérréssant
Kebe (non vérifié)
mer, 01/12/2022 - 04:17
Permalien
Demande de cours et exercices de maths et pc second s/l
Mame Madjiguène... (non vérifié)
mer, 12/03/2025 - 21:21
Permalien
Absence de matières
Anonyme (non vérifié)
sam, 01/24/2026 - 02:00
Permalien
très bien compris
Ajouter un commentaire