Mélanges et corps purs - 2nd S
Classe:
Seconde
Tous les objets qui nous entourent (êtres vivants, végétaux, minéraux...) constituent la matière
Les roches, les arbres, l'air...etc, ont des exemples de matières
I. Les états physiques de la matière et changements d'états
1. États physiques de la matière
La matière se présente dans la nature sous trois états différents : l'état solide, l'état liquide et l'état gazeux
1.1 L'état solide
A l'état solide, un corps possède une forme et un volume propres
Les solides sont incompressibles
Moyennant un effort, on peut changer la forme d'un solide, mais il est pratiquement impossible de faire varier son volume
Certains solides sont élastiques, mais chaque solide à sa limite d'élasticité
Exemples :
cahier, bois, fer, charbon...
1.2 L'état liquide
Les liquides n'ont pas de forme propre, mais leur volume est invariable ; ils sont fluides et incompressibles
Exemples :
l'eau, pétrole, l'essence, le lait...

Remarque
Les solides en poudre, divisés ou pulvérisés s'écoulent comme les liquides, mais leur surface libre n'est ni plane, ni horizontale comme les liquide
1.3 L'état gazeux
Les gaz n'ont pas de forme propre, ni de volume propre.
Ils sont compressibles, expansibles et élastiques.
Ils sont fluides
Exemples :
l'air, le dioxyde de carbone, le dioxygène...

Remarque :
Les solides sont caractérisés par un état ordonné et compact.
L'état liquide est désordonné.
L'état physique des gaz est désordonné et diffus
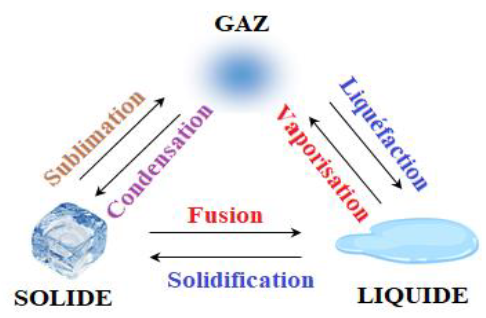
2. Les changements d'état physique
2.1 Définition
Le passage d'un état physique à un autre état physique est appelé changement d'état
2.2 Digramme de changement d'état
Un changement d'état physique s'effectue toujours à une température constante sous une pression donnée
3. Les transformations de la matière
3.1 Phénomène physique
Un phénomène physique est une transformation au cours de laquelle la nature de la matière n'est pas altérée (dénaturée ou détruite)
Exemples :
la fusion de la glace ; la dilatation des métaux ; la rosée...
3.2 Phénomène chimique
Un phénomène chimique est une transformation au cours de laquelle la nature de la matière est altérée (dénaturée ou détruite)
Exemples :
Action de l'eau de Javel sur une tache ; la décomposition de la craie par un acide ; feuille de papier brulée
II. Les mélanges
1. Définition
Un mélange est un ensemble de deux ou plusieurs constituants
Il peut être solide, liquide ou gaz
2. Mélange hétérogène
Un mélange hétérogène est un mélange dans lequel on peut distinguer à l' œil nu ses différents constituants
Exemples :
eau $+$ huile ; eau $+$ terre ; boissons gazeuses

3. Mélange homogène
Un mélange homogène est un mélange dans lequel on ne peut pas distinguer à l' œil nu ses différents constituants
Exemples :
lait ; sirop ; thé

4. Méthodes de séparation des constituants d'un mélange
Il existe de nombreuses méthodes variables de séparation selon la nature du mélange et la nature des constituants qui le constituent.
Parmi ces méthodes, on citer :
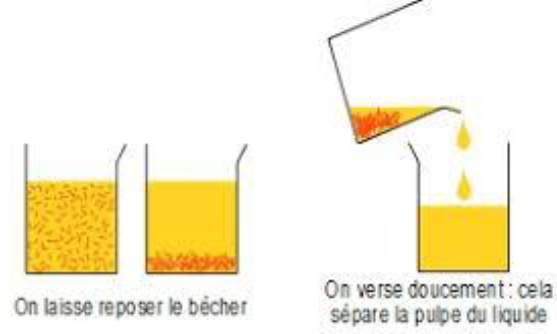
4.1 La décantation
La décantation est une de séparation qui consiste à laisser le mélange au repos pour que les particules solides lourdes se déposent au fond du récipient.
En transvasant, on peut séparer le liquide de ces particules.
Le produit de la décantation est appelé décantat
Exemples de décantation
$-\ $ Décantation d'un mélange solide-liquide : jus d'orange
$-\ $ Décantation d'un mélange liquide-liquide :
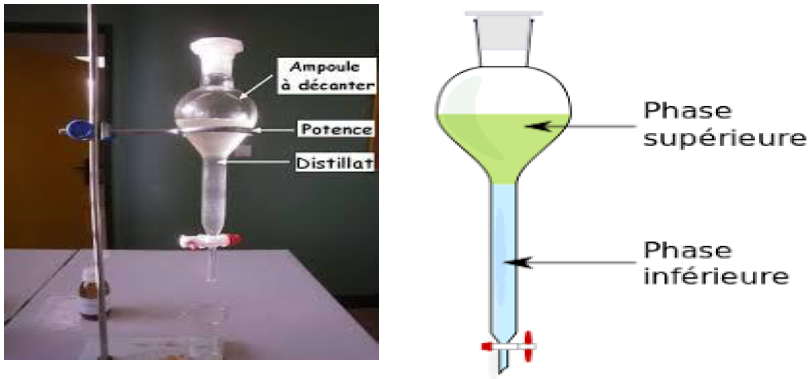
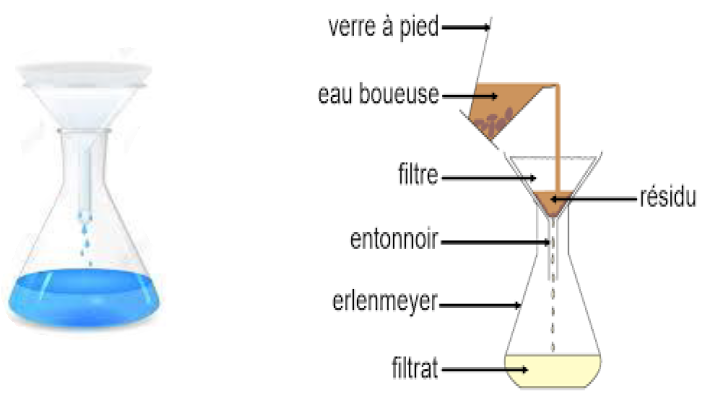
4.2 La filtration
La filtration est une méthode de séparation qui consiste à faire passer le mélange liquide à travers un filtre .
Le produit de la filtration est appelé filtrat
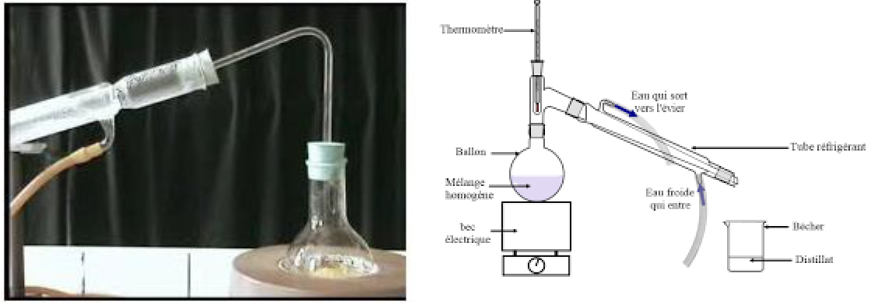
4.3 La distillation
La distillation est une méthode de séparation basée sur la différence de température d'ébullition.
Elle consiste à vaporiser partiellement un mélange liquide homogène et à condenser les vapeurs formées pour les séparer
Le produit de la distillation est appelé distillat
Exemple :
distillation de l'eau sucrée
Remarque :
Pour séparer les différents constituants de l'air, on le liquéfie en le comprimant.
On procède alors à la distillation de ce liquide
Au début de l'ébullition (température de liquéfaction du diazote liquide $(-196^{\circ}C)$, il se dégage du diazote, puis le dioxygène lorsque la température atteint $-183^{\circ}C$ (température de liquéfaction du dioxygène)
L'air est donc un mélange dont l'expérience montre qu'il est constitué de $78\%$ de diazote $(4/5$ en volume$)$, de $21\%$ de dioxygène $(1/5$ en volume$)$ et $1\%$ d'autres gaz (gaz rares, dioxyde de carbone et de la vapeur d'eau)
4.4 Quelques autres méthodes de séparation
4.4.1 La congélation
C'est une méthode de séparation basée sur la différence de cristallisation (température à laquelle un corps se congèle).
Le corps dont sa température d'ébullition est plus grande est récupéré le premier sous formes de cristaux
4.4.2 Le tamisage
Si les grains de différents solides ont des dimensions différentes, le passage au tamis permet de les séparer
4.4.3 La flottation
On mouille le mélange.
Selon le liquide choisi, certaines particules flottent
4.4.4 Le triage magnétique
Si un des constituants du mélange contient du fer, les particules de ce constituant sont attirées par l'aimant
III. Corps purs
1. Définition
Un corps pur est un corps qu'on ne peut pas fractionner par une méthode quelconque de séparation
2. Critères de pureté d'un corps pur
Tout corps pur est défini par les constantes physiques parmi lesquelles on citer :
$-\ $ la masse volumique
$-\ $ les points de changement d'état : température de fusion, d'ébullition, de solidification etc...
Exemple :
Valeurs de quelques constantes physiques de l'eau pure.
$-\ $ masse volumique : $1kg/L$
$-\ $ température de solidification ou de fusion : $t=0^{\circ}C$
$-\ $ température d'ébullition ou de liquéfaction : $t=100^{\circ}C$
3. Corps purs simples et corps purs composés
3.1 Analyse de l'eau
3.1.1 Définition
Analyser un corps revient à chercher ses constituants par une méthode appropriée
3.1.2 L'électrolyse de l'eau
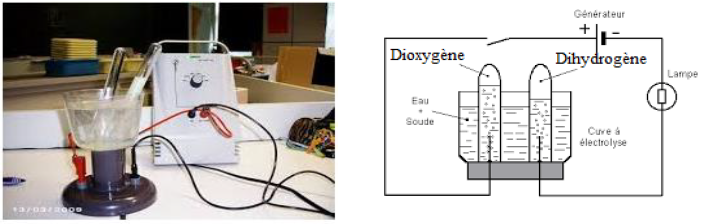
Mettons de l'eau additionnée de quelques gouttes d'acide dans le voltamètre (ou cuve à l'électrolyse) et fermons l'interrupteur
On constate que le courant circule et des dégagements gazeux au niveau des tubes
A l'anode $($signe $+)$, le gaz recueilli rallume une buchette presque éteinte.
Ce gaz est le dioxygène
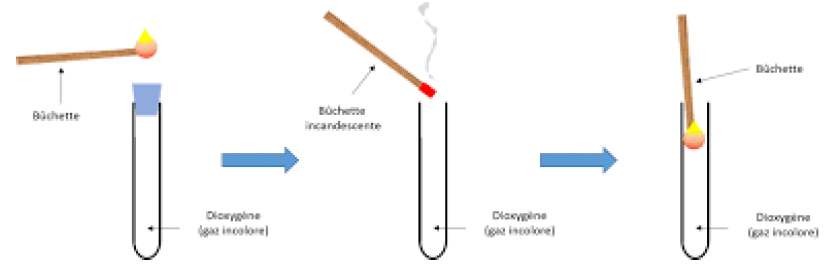
A la cathode $($signe $-)$, le gaz recueilli a volume deux fois grand et produit une légère détonation en présence d'une allumette enflammée.
Ce gaz est le dihydrogène
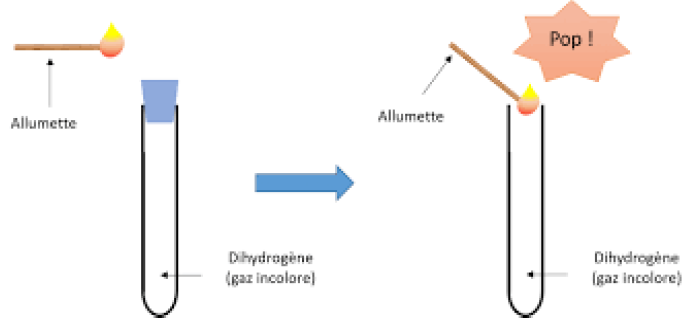
Conclusion :
$-\ $ L'eau est décomposé par le courant électrique en dioxygène et en dihydrogène
$-\ $ Le volume de dihydrogène est le double du volume de dioxygène : dihydrogène dioxygène $V_{\text{dihydrogène}}=2V_{\text{dioxygène}}$
$-\ $ La masse totale des gaz (dihydrogène et dioxygène) est égale à la d'eau disparue : $m_{e}=m_{H}+m_{O}$
eau $\longrightarrow$ dioxygène $+$ dihydrogène
$18g$ $16g$ $2g$
Les masses de dihydrogène et de dioxygène sont proportionnelles à la masse d'eau disparue
$\dfrac{m_{H}}{m_{E}}=\dfrac{2g}{18g}\Rightarrow\ m_{H}=\dfrac{1}{9}m_{E}$
$\dfrac{m_{O}}{m_{E}}=\dfrac{16g}{18g}\Rightarrow\ m_{O}=\dfrac{8}{9}m_{E}$
$-\ $ Un corps pur qui peut décomposer en deux ou plusieurs corps purs est un corps pur composé
Exemple :
l'eau
$-\ $ Un corps pur qui ne peut être décomposé en d'autres corps purs est un corps simple
Exemples :
le dioxygène et le dihydrogène
3.2 Synthèse de l'eau
3.2.1 Définition
La synthèse de l'eau est la formation de l'eau à partir du mélange du dihydrogène et du dioxygène.
3.2.2 Synthèse eudiométrique

On déclenche des étincelles électriques au niveau des électrodes pour amorcer le processus de synthèse
$-\ $ La pression des gaz baisse, le niveau de mercure qui va remonter lorsque les deux gaz réagissent en formant une buée (eau) sur la paroi interne du tube eudiométrique.
dioxygène $+$ dihydrogène $\longrightarrow$ eau
$16g$ $2g$ $18g$
La masse d'eau produite est proportionnelle à la masse de dihydrogène ou à la masse de dioxygène
$\dfrac{m_{E}}{m_{H}}=\dfrac{18g}{2g}\Rightarrow\ m_{E}=9m_{H}$
$\dfrac{m_{E}}{m_{O}}=\dfrac{18g}{16g}\Rightarrow\ m_{E}=\dfrac{9}{8}m_{O}$

Commentaires
Dior tall (non vérifié)
lun, 01/27/2020 - 18:40
Permalien
Je demande si on peut parler des constantes physiques d'un mèlan
Mouhamed diassé (non vérifié)
ven, 12/04/2020 - 00:06
Permalien
reponse
Sandji Lamine Cissé (non vérifié)
lun, 12/07/2020 - 23:45
Permalien
Apprendre
Sandji Lamine Cissé (non vérifié)
lun, 12/07/2020 - 23:45
Permalien
Apprendre
abero (non vérifié)
dim, 10/11/2020 - 17:14
Permalien
très intéressant
Anonyme (non vérifié)
ven, 11/20/2020 - 20:16
Permalien
C'est un excellent document.
Samb barham (non vérifié)
sam, 11/21/2020 - 01:11
Permalien
Félicitations
Anonyme (non vérifié)
mer, 12/02/2020 - 07:36
Permalien
Des exercices sur sciences
2SKT (non vérifié)
mer, 12/02/2020 - 20:43
Permalien
Merci
Maty (non vérifié)
mer, 12/02/2020 - 22:15
Permalien
Merci
Khadim touré (non vérifié)
jeu, 12/10/2020 - 10:25
Permalien
Félicitations de vous!!!!!!!!
mane (non vérifié)
jeu, 12/10/2020 - 19:38
Permalien
incompréhension de la généralité sur le mouvement
Abou (non vérifié)
dim, 12/27/2020 - 16:41
Permalien
Éleve
Ameth fall (non vérifié)
lun, 01/04/2021 - 21:49
Permalien
D'études
GORGUI FAYE (non vérifié)
mer, 01/06/2021 - 17:16
Permalien
Pc
Alassane Gningue (non vérifié)
dim, 01/17/2021 - 21:04
Permalien
etudier
Alassane Gningue (non vérifié)
dim, 01/17/2021 - 21:04
Permalien
etudier
Anonyme (non vérifié)
ven, 11/12/2021 - 00:15
Permalien
word
AMINE (non vérifié)
ven, 11/12/2021 - 00:16
Permalien
MERCI
Anonyme (non vérifié)
sam, 11/13/2021 - 13:18
Permalien
J'aime cette site
Dieylany Diop (non vérifié)
sam, 12/18/2021 - 02:31
Permalien
Savoir appliquer
Fallou diaw (non vérifié)
mer, 10/12/2022 - 22:19
Permalien
Merci beaucoup
Kalidou (non vérifié)
mar, 02/07/2023 - 23:15
Permalien
Etudié
AgRE (non vérifié)
sam, 08/16/2025 - 22:27
Permalien
TEleCHARGemENt
Mame Diarra (non vérifié)
lun, 10/09/2023 - 22:15
Permalien
Pour apprendre
Anonyme (non vérifié)
mar, 10/17/2023 - 21:13
Permalien
Mon site de téléchargement de
Ibrahima Diakhité (non vérifié)
mer, 10/25/2023 - 23:13
Permalien
D'attendre mon but
Ibrahima Diakhité (non vérifié)
mer, 10/25/2023 - 23:13
Permalien
D'attendre mon but
Mouhamed pam (non vérifié)
mer, 11/08/2023 - 22:32
Permalien
À part le professeur à l
gnamou ndione (non vérifié)
jeu, 11/09/2023 - 21:45
Permalien
eleve en 2nd s
mariama diallo (non vérifié)
sam, 09/27/2025 - 15:20
Permalien
réussir
Anonyme (non vérifié)
dim, 10/06/2024 - 22:15
Permalien
OKKOPPJPJPOJ
mika (non vérifié)
lun, 10/14/2024 - 22:56
Permalien
felicitation
Meroxx (non vérifié)
ven, 04/04/2025 - 01:02
Permalien
Its crazy
Anonyme (non vérifié)
ven, 10/17/2025 - 22:37
Permalien
C'est excellent
Ajouter un commentaire