Série d'exercices : Les alcanes - 1e s
Classe:
Première
Exercice 1
1. Nommer les alcanes suivants
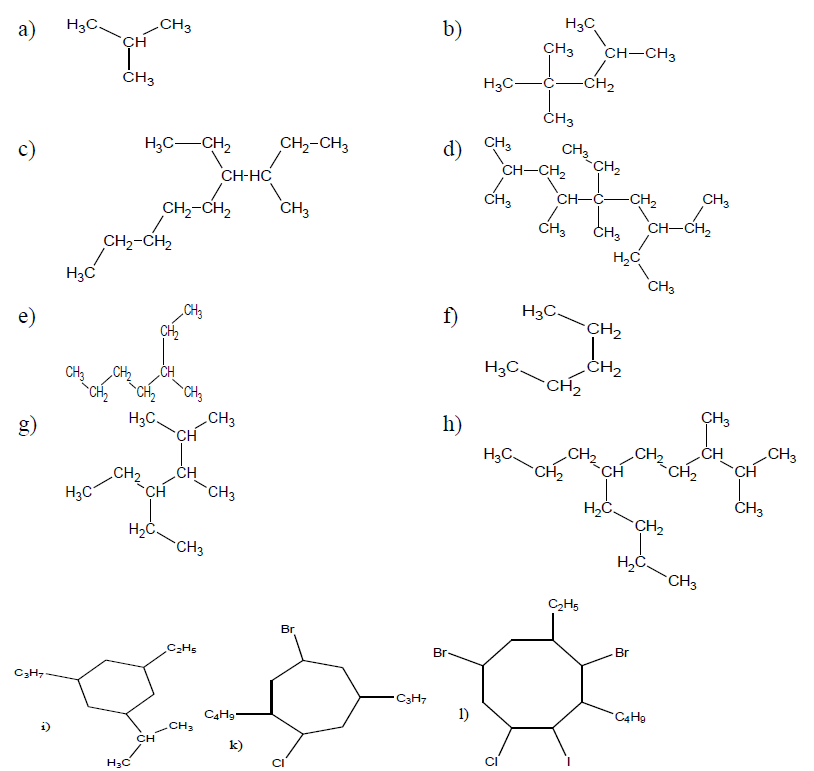
2. Écrire les formules semi développées des hydrocarbures suivants :
2.1 $\ 3-\text{élhyl}-2-\text{methylhexane}$
2.2 $\ 2.3-$dimethylpentane
2.3 $\ 4-\text{éthyl}-2.5-\text{méthylheptane}$
2.4 $\ 3.4-$diéthylhexane
2.5 $\ 3-\text{éthyl}-2.3-\text{diméthylhexane}$
2.6 $\ 2.2-\text{diméthyl}-5.6\text{dipropylnonane}$
2.7 $\ 4-\text{éthyl}-3-\text{méthyl}-5-\text{propyloctane}$
2.8 $\ 2.2\;,\ 3.3-$tétraméthylpentane
3) Écrire les formules semi-développées qui correspondent aux noms suivants.
Quelles sont les substances dont le nom est incorrect ?
Rectifier-le.
a) $4-$propyldécane
b) $3-\text{éthyl}-4-\text{méthylnonane}$
c) $2.2-$diméthlheloctane
d) $4-$éthlnonane
e) $4.4\;,\ 6.6-$tétraméthyloctane
f) $1.3-$diéthylpropane
g) $2-\text{propyl}-3-\text{éthylhexane}$
h) $4-\text{méthyl}-1.3-\text{diméthylpentane}$
i) $2-\text{éthyl}-3-\text{méthyl}-4-\text{propylnonane}$
j) $2\;,\ 3.4-$triméthypentane
k) $2-$méthylbutane
Exercice 2
1. Le pentane $C_{5}H_{12}$ présente trois isomères.
1.1. Définir des isomères.
1.2. Écrire les formule semi-développées de ces trois isomères.
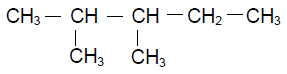
2.Donner le nom de l'alcane dont la formules semi- développée est:
3.1. Écrire la formule générale de l'alcane à chaîne carbonée ouverte (non cyclique) dont la molécule comporte $n$ atomes de carbone.
3.2. Exprimer en fonction de $n$ la masse molaire de cet alcane.
Les masses molaires atomiques des éléments carbone et hydrogène étant :
$M_{C}=12\,g\cdot mol^{-1}$ ;
$M_{H}=1\,g\cdot mol^{-1}.$
3.3. Un alcane a pour masse molaire $M=114\,g\cdot mol^{-1}.$
En utilisant le résultat obtenu au 3.2. trouver la formule de cet alcane.
3.4. Quel est son nom ?
Exercice 3
On réalise la combustion dans le dioxygène de $0.72\,g$ d'un hydrocarbure aliphatique $(A)$ de formule $C_{x}H_{y}.$
1) Rappeler la définition d'un hydrocarbure aliphatique.
2) Écrire l'équation de la réaction.
3) La réaction fournit $1.2\,L$ de dioxyde de carbone et $1.08\,g$ de vapeur d'eau
a) Calculer le nombre de moles de $(A)$ présent dans l'échantillon sachant que la masse molaire de $(A)$ est $M_{A}=72\,g\cdot mol^{-1}.$
b) Montrer que $(A)$ a pour formule brute $C_{5}H_{12}.$
4) Écrire toutes les formules semi-développées des isomères de $(A)$ et donner leur nom respectif.
On donne : les masses molaires suivantes :
$M_{C}=12\,g\cdot mol^{-1}$ ;
$M_{H}=1\,g\cdot mol^{-1}$ ;
$M_{O}=16\,g\cdot mol^{-1}.$
Le volume molaire des gaz : $V_{m}=24\,L\cdot mol^{-1}.$
Exercice 4
La combustion dans un eudiomètre d'un mélange de $V_{1}=10\,cm^{3}$ d'un hydrocarbure $A$ de formule brute $C_{x}H_{y}$ et de $V_{2}=90\,cm^{3}$ de dioxygène, produit un mélange gazeux de volume $V_{3}=65\,cm^{3}$ dont $V_{4}= 40\,cm^{3}$ sont absorbables par la potasse.
Les volumes sont mesurés dans les $C.N.T.P$ et l'eau formée se retrouve à l'état liquide.
1. Écrire l'équation-bilan de la réaction de combustion en fonction de $x$ et $y.$
2. Quel est le volume de dioxygène en excès ?
En déduire le volume de dioxygène réagi.
3. Montrer que la formule moléculaire brute de l'hydrocarbure $A$ est $C_{4}H_{10}.$
4. Écrire et nommer la formule semi-développée exacte de l'alcane $A$ sachant qu'il contient une chaine carbonée ramifiée.
5. On effectue la réaction de monosubstitution de l'alcane $A$ par le dichlore.
5.1. Rappeler les conditions expérimentales et écrire l'équation-bilan de la réaction en utilisant les formules brutes.
5.2. Écrire les formules et les noms des deux dérivés monochlorés qui se forment
Exercice 5
Un mélange de méthane et de propane a pour volume total $10$ litres.
On se propose de déterminer la composition de ce mélange.
On désigne par $V_{1}$ le volume de méthane et par $V_{2}$ le volume de propane.
1. Écrire une première relation entre les volumes $V_{1}$ et $V_{2}.$
2. Écrire les équations-bilans des réactions de combustions du méthane et du propane avec le dioxygène.
3.1. Exprimer en fonction de $V_{1}$ et $V_{2}.$
Les volumes de dioxygène consommés par la combustion complète des volumes $V_{1}$ et $V_{2}.$
3.2. En déduire le volume $V_{0}$ de dioxygène nécessaire à la combustion complète du mélange en fonction de $V_{1}$ et $V_{2}.$
4. Cette combustion a nécessité $38\,L$ de dioxygène, les volumes de mélange et de dioxygène ayant été mesurés dans les mêmes conditions.
En déduire les valeurs de $V_{1}$ et $V_{2}.$
5. Déterminer la composition centésimale volumique du mélange étudié.
Exercice 6
1. Nommer les composés A, B, C et D suivant :
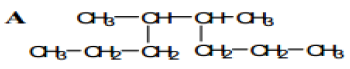
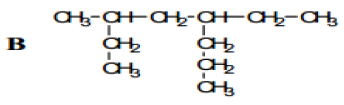
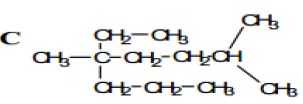
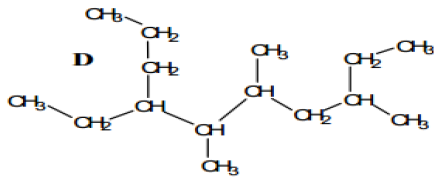
2. Écrire la Formule semi-développée des alcanes que l'on peut nommer
a) $4-\text{éthyl}-3.5-\text{diméthylheptane}$
b) $1-\text{éthyl}-4-\text{méthylcyclohexane}$
3. Un hydrocarbure B présente la composition massique :
$C\ :\ 83.7\%\text{ et }H\ :\ 16.3\%$, sa masse molaire est $M=86\,g/mol.$
a) Déterminer sa formule brute et donner le nom de sa famille.
b) Cet hydrocarbure est ramifié ; sa chaine carbonée présente deux groupes alkyles identiques sur deux carbones différents.
En déduire la $FSD$ et le nom de $B.$
c) Combien de dérivés monobromés peut-on espérer préparer avec $B$ ?
Exercice 7
Le carburant utilisé dans un moteur expérimental est de l'heptane de formule $C_{7}H_{16}.$
1. Écrire l'équation de combustion de l'heptane dans l'air.
2. Calculer la masse molaire moléculaire de l'heptane.
Le moteur consomme $1.5\,L$ d'heptane de masse volumique $700\,kg/m.$
3. Calculer, en gramme, la masse d'heptane consommé.
4. Calculer le nombre de moles d'heptane consommé.
5. Calculer le nombre de moles d'oxygène utilisé.
6. Le volume molaire des gaz dans les conditions de l'expérience est de $24\,L/mol.$
Calculer le volume d'oxygène utilisé.
7. L'air contient $20\%$ d'oxygène et $80\%$ de diazote.
Calculer le volume d'air consommé au cours de l'expérimentation.
8. En utilisant les mêmes étapes de calcul, calculer le volume de dioxyde de carbone produit.
9. Calculer la masse d'eau produite
Exercice 8
1) Un hydrocarbure aliphatique saturé $(A)$ a une masse molaire moléculaire $M=58\,g\cdot mol^{-1}.$
a) Trouver la formule brute de $(A).$
b. Écrire les formules semi développées possibles et donner le nom des différents isomères de $(A).$
c) Identifier l'isomère $(A_{1})$ de $(A)$ sachant qu'il présente une chaîne ramifiée.
2) L'action du dibrome $(Br_{2})$ sur l'hydrocarbure $(A_{1})$ en présence de la lumière, donne un mélange de dérivés bromés dont l'un est un dérivé dibromé noté $(B).$
a) Écrire l'équation chimique de la réaction conduisant à la formation de $(B)$ en utilisant les formules brutes.
b) Donner toutes les formules semi développées possibles de $(B)$ et le nom des isomères correspondants.
c) La structure de l'hydrocarbure de départ $(A_{1})$ a-t-elle été modifiée au cours de cette réaction.
Exercice 9
1) Définir les termes suivants et donner un exemple dans chaque cas : alcane, pouvoir calorifique, réaction endothermique, réaction exothermique.
2) Une bouteille domestique de butagaz contient$m=13\,kg$ de butane liquide.
La masse volumique de ce butane est.
La formule brute du butane est $C_{4}H_{10}$ et sa masse molaire est $M=58\,g\cdot mol^{-1}$
a) Calculer le nombre de moles $n$ de butane contenu dans la bouteille.
b) Calculer le volume $V$ occupé par le butane liquide.
c) Calculer dans les conditions où le volume molaire gazeux est $V_{m}=22.4\,L\cdot mol^{-1}$, le volume total $V_{B}$ de butane gazeux à priori disponible.
3) On réalise la combustion complète d'une masse $m=116\,g$ de ce butane.
a) Écrire l'équation-bilan de la réaction de cette combustion.
b) Calculer le nombre $n'$ de moles de butane utilisé, le volume $Va$ d'air nécessaire et le volume $V_{CO_{2}}$ de dioxyde de carbone formé dans les conditions normales de température et de pression.
d) Le pouvoir calorifique du butane est $q=115000\,kJ/m^{-3}$
$-\ $ En déduire l'énergie $Q$ libérée par la combustion de $m=116\,g$ de ce butane.
Exercice 10
L'analyse élémentaire quantitative en vue de déterminer la composition centésimale d'un carbure d'hydrogène $C_{x}H_{y}$ a donné les résultats suivants :
$\ast\ \ C\ :\ 83.3\%\quad H\ :\ 16.7\%$
$\ast\ \ $densité de vapeur par rapport à l'air : $d=2.48$
1) Déterminer Sa formule brute.
2) Écrire les diverses formules semi-développées possibles (isomères)
3) Sachant que l'action du dichlore sur le composé étudié ne donne qu'un seul dérivé monosubstitué, quel est le corps étudié ?
4) On fait brûler une masse $m=10.0\,g$ de ce composé dans un volume d'air ($V=10\,L$ mesuré dans les $C.N.T.P$) : la combustion donne du dioxyde de carbone et de l'eau.
L'air contenant $20\%$ de dioxygène en volume, la totalité du composé a-t-il réagi ?
Sinon, quelle masse $m'$ reste-t-il

Commentaires
Moussa (non vérifié)
mer, 12/02/2020 - 01:28
Permalien
Demande de correction
Sory Coulibaly (non vérifié)
sam, 05/07/2022 - 15:14
Permalien
Le résultat
Diop (non vérifié)
dim, 01/15/2023 - 08:16
Permalien
Exercice
Saidou ifra Diallo (non vérifié)
mar, 11/21/2023 - 21:23
Permalien
Téléphone
Ousmane (non vérifié)
dim, 12/15/2024 - 02:00
Permalien
Correction des exercices
Mory sow (non vérifié)
mar, 05/24/2022 - 17:50
Permalien
Pour comprendre mieux
Mokaram (non vérifié)
mer, 11/16/2022 - 15:27
Permalien
M
Akouto agbodji (non vérifié)
mar, 10/31/2023 - 20:45
Permalien
Exercice sur les alcanes
ALIMA NDONG (non vérifié)
lun, 12/02/2024 - 21:08
Permalien
ETUDIE
Odilon (non vérifié)
ven, 11/29/2024 - 11:48
Permalien
Augmenter ma connaissance
Daniel (non vérifié)
sam, 02/08/2025 - 08:48
Permalien
Élèves
Oumarou (non vérifié)
mer, 11/26/2025 - 19:53
Permalien
Alcane
Oumar camara (non vérifié)
jeu, 12/11/2025 - 16:03
Permalien
Réussir
kaba tolno (non vérifié)
lun, 12/21/2020 - 18:45
Permalien
demande de correction
Anonyme (non vérifié)
ven, 10/08/2021 - 02:22
Permalien
Exercice numéro 8
Michael (non vérifié)
lun, 04/04/2022 - 22:22
Permalien
Devoirs
Badria (non vérifié)
ven, 12/02/2022 - 22:48
Permalien
Exercice
Badria (non vérifié)
ven, 12/02/2022 - 22:48
Permalien
Exercice
hamme barry (non vérifié)
sam, 01/20/2024 - 16:34
Permalien
m
Hero (non vérifié)
lun, 10/24/2022 - 21:35
Permalien
Elève
Hakimou Sidi Ha... (non vérifié)
lun, 11/07/2022 - 10:22
Permalien
La correction de tous les exercices
Alioune chérif ... (non vérifié)
ven, 02/03/2023 - 08:10
Permalien
Éducation
Ndiane faye (non vérifié)
mer, 01/27/2021 - 11:21
Permalien
Des exercices et corrections
Amadou ba (non vérifié)
lun, 02/08/2021 - 13:53
Permalien
Élève
Hero (non vérifié)
lun, 10/24/2022 - 21:37
Permalien
Elève
Mouhamed Diop (non vérifié)
mar, 12/13/2022 - 14:22
Permalien
Des exos et corrections
Soumare (non vérifié)
ven, 02/05/2021 - 01:54
Permalien
C'est vraiment agréable merci
Ndeye Anna Mbengue (non vérifié)
dim, 04/18/2021 - 09:20
Permalien
Pc
AÏMONTCHE (non vérifié)
jeu, 09/09/2021 - 03:11
Permalien
Enregistrement
Ndao (non vérifié)
ven, 12/10/2021 - 09:30
Permalien
Comment enregistrer un doc de suunudara
Anonyme (non vérifié)
mar, 01/31/2023 - 00:17
Permalien
C very important
Abdel Aziz (non vérifié)
ven, 11/10/2023 - 17:56
Permalien
Enregistrer
AÏMONTCHE (non vérifié)
jeu, 09/09/2021 - 03:23
Permalien
Enregistrement
AÏMONTCHE (non vérifié)
jeu, 09/09/2021 - 03:26
Permalien
Enregistrement
Djadja aimé (non vérifié)
dim, 01/02/2022 - 19:28
Permalien
Exercices alcanes 1ère
Bachir Abdou Hassan (non vérifié)
jeu, 10/27/2022 - 15:52
Permalien
Pour améliorer mon niveau
ibrahima ndom0 (non vérifié)
jeu, 12/15/2022 - 16:35
Permalien
correction
IDENEK (non vérifié)
ven, 03/17/2023 - 07:22
Permalien
Je veux apprendre la physique chimie pour vous
Gracielah (non vérifié)
mar, 08/22/2023 - 16:07
Permalien
Pc 1ère
Kebongo michel (non vérifié)
sam, 12/16/2023 - 21:47
Permalien
Chimie
serigne abo diop (non vérifié)
dim, 12/01/2024 - 12:27
Permalien
apprendre
Emploi (non vérifié)
mar, 12/17/2024 - 02:50
Permalien
J
Ajouter un commentaire