Liaisons chimiques - 2nd S
Classe:
Seconde
Exceptés, les gaz rares, les éléments chimiques n'existent pas l'état libre mais en combinaison pour former des édifices moléculaires
I. Liaison covalente ou liaison de covalence
1. Définition
La liaison de covalence (ou liaison covalente) résulte de la mise en commun par deux atomes d'une ou plusieurs paires d'électrons célibataires appelées doublets de liaison ou doublets liants
Exemple :
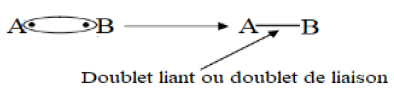
2. La valence d'un atome
La valence d'un atome est le nombre de liaisons de covalence qu'il peut former
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit acquérir pour saturer sa couche externe à un octet d'électrons (ou un duet pour l'atome d'hydrogène).
Le nombre de liaisons $n_{L}$ peut être calculé par la relation :
$$n=n_{max}-p$$
$n_{max}$ nombre d'électrons pour saturer la couche externe et $p$ nombre d'électrons périphériques d'un atome
Pour les couches $K$ : $n=2-p$
Pour les couches $L$ et $M$ : $n=8-p$
Exemples :
$$\begin{array}{|c|c|c|c|} \hline \text{Atome}&Z&\text{Formule électronique}&\text{Nombre de liaisons}\\ \hline \text{Hydrogène }H&1&(K)^{1}&n=2-1=1\\ \hline \text{Chlore }Cl&17&(K)^{2}(L)^{8}(M)^{7}&n=8-7=1\\ \hline \text{Oxygène }O&8&(K)^{2}(L)^{6}&n=8-6=2\\ \hline \text{Azote }N&7&(K)^{2}(L)^{5}&n=8-5=3\\ \hline \text{Carbone }C&6&(K)^{2}(L)^{4}&n=8-4=4\\ \hline \end{array}$$
$\surd\ $ Le nombre des doublets non liants $n_{d}$ est : $n_{d}=\dfrac{(p-n_{L})}{2}$
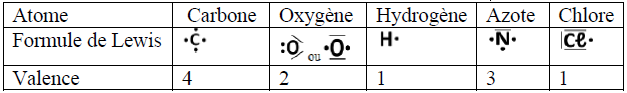
3. La molécule
3.1 Définition
Une molécule est une entité chimique électriquement neutre formée d'un nombre limité d'atomes liés entre eux par des liaisons de covalence
Remarque :
Dans une molécule, on retrouve :
$-\ $ une liaison simple, entre les atomes $A$ et $B$, est notée : $A-B$
$-\ $ une liaison double, entre les atomes $A$ et $B$, est notée : $A=B$
$-\ $ une liaison triple, entre les atomes $A$ et $B$, est notée : $A\equiv B$
3.2 Formule brute d'une molécule
La formule brute d'une molécule est constituée des symboles des éléments qui composent cette molécule affectés en indice de coefficients indiquant leur nombre dans la molécule
Exemples :
$H_{2}$, $O_{2}$, $Cl_{2}$, $NH_{3}$, $CH_{4}$, $C_{2}H_{6}$
3.3 Atomicité d'une molécule
L'atomicité d'une molécule représente le nombre de d'atomes qu'elle comporte
$$\begin{array}{|c|c|c|c|c|c|c|} \hline \text{Molécule}&H_{2}&NH_{3}&CH_{4}&C_{2}H_{6}&KMnO_{4}&K_{2}Cr_{2}O_{7}\\ \hline \text{Atomicité}&2&4&5&8&6&11\\ \hline \end{array}$$
3.4 Représentation de Lewis d'une molécule
La représentation de Lewis d'une molécule est une représentation des atomes et de tous les doublets d'électrons périphériques liants et non-liants de cette molécule
Exemples :
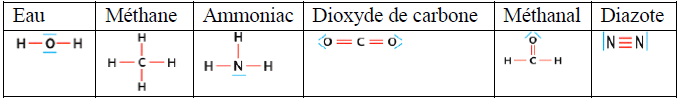
3.5 Formule développée et formule semi-développée
3.5.1 Formule développée
La formule développée d'une molécule est une représentation de Lewis de la molécule où les doublets non liants ne sont pas représentés
Exemples
$\begin{array}{|c|c|c|c|c|c|} \hline \text{Eau}\qquad\qquad&\text{Méthane}\qquad&\text{Ammoniac}\qquad&\text{Dioxyde de carbone}\qquad&\text{Méthanal}\qquad&\text{Diazote}\\ \hline \end{array}$
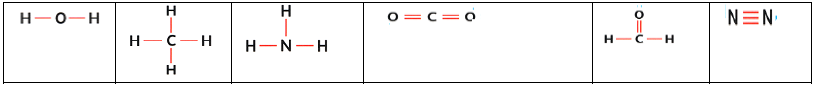
3.5.2 Formule semi-développée
La formule développée d'une molécule est une écriture simplifiée de la formule développée dans laquelle, les liaisons de type $X-H$ $(C-H\;,\ N-H\;,\ O-H\ldots\;etc.)$ ne sont pas représentées
Exemples :
$H_{2}N-NH_{2}$ ;
$CH_{2}=CH_{2}$ ;
$CH_{3}-CH_{2}-CH_{3}$ ;
$CH_{3}-CH_{2}-OH$ ;
$HN=NH$
3.6 Structure et géométrie de quelques molécules
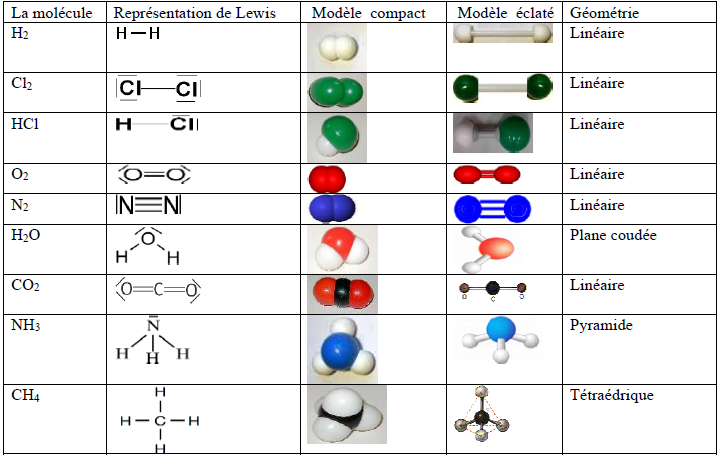
4. Liaison covalente polarisée et liaison dative
4.1 L'électronégativité
$-\ $ L'électronégativité est la tendance d'un atome à capter.
Elle traduit l'aptitude de l'atome à attirer les électrons des liaisons
Remarque :
L'électronégative augmente de la gauche vers la droite le long d'une période du bas vers le haut le long d'une colonne dans la classification périodique
Le fluor est l'élément le plus électronégatif
$-\ $ L'électropositivité est la tendance d'un élément chimique à céder des électrons
4.2 Liaison covalente polarisée
Une liaison entre deux atomes, $A$ et $B$, ayant des électronégativités différentes est polarisée : ils forment une liaison covalente polarisée (ou polaire)
Les électrons ne sont alors pas répartis de manière symétrique entre les deux atomes.
On considère alors que :
$-\ $ L'atome $A$ porte un excès de charges négatives $($noté $\delta^{-})$ ;
$-\ $ L'atome $B$ porte un défaut de charges négatives $($noté $\delta^{+}).$
Les symboles $\delta^{-}$ et $\delta^{+}$ représentent des fractions de la charge élémentaire $e$ $(e=1.6\cdot10^{-19}C)$ : on parle de charges partielles (négative ou positive) sur la liaison
Exemples :
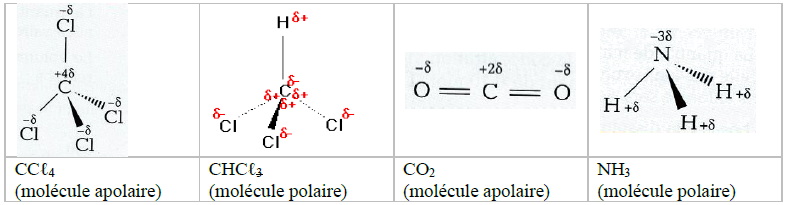
$-\ $ Dans une liaison polaire, le barycentre des charges électriques $(-)$ n'est pas confondu avec celui des charges électriques $(+).$
$-\ $ Plus la différence d'électronégativité entre les $2$ atomes est importante, plus la liaison est polarisée
4.3 Liaison covalente dative
C'est une liaison covalente dans laquelle le doublet d'électrons de liaison à partager est apporté par un seul atome.
L'atome qui donne le doublet s'appelle donneur, l'autre s'appelle accepteur.
La liaison dative se représente par une flèche allant du donneur à l'accepteur.
Une fois formée, cette liaison est égale aux autres liaisons covalentes.
Exemple :
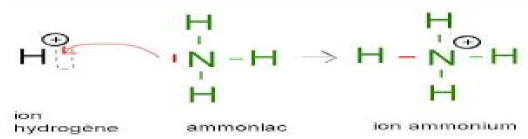
II. Liaison ionique
1. Définition
La liaison ionique est une liaison établie par attraction électrostatique entre deux ions de signes opposés dans les composés ioniques
Sa cohésion est assurée par la force de l'attraction électrostatique qui unit les deux ions
2. Le cristal ionique
2.1 Formule ionique et formule statistique d'un solide ionique
2.1.1 La formule ionique
La formule ionique représente un ensemble électriquement neutre écrit avec des ions constituant le composé
Exemples :
$-\ $ Chlorure de sodium $(Na^{+}$ ; $Cl^{-})$ ou $(Na^{+}+Cl^{-})$
$-\ $ Fluorure de calcium $(Ca^{2+}$ ; $2F^{-})$ ou $(Ca^{2+}+2F^{-})$
$-\ $ Chlorure de magnésium $(Mg^{2+}$ ; $2Cl^{-})$ ou $(Mg^{2+}+2Cl^{-})$
$-\ $ Sulfate de sodium $(2Na^{+}$ ; $SO_{4}^{2-})$ ou $(2Na^{+}+SO_{4}^{2-})$
2.1.2 La formule statistique
La formule statistique d'un composé ionique représente un ensemble électriquement neutre et indique la proportion de chacun des ions (cations et anions) qui la compose
Exemples :
$-\ $ Chlorure de sodium : $NaCl$
$-\ $ Fluorure de calcium : $CaF_{2}$
$-\ $ Chlorure de magnésium : $MgCl_{2}$
$-\ $ Sulfate de sodium : $Na_{2}SO_{4}$
2.2 Nomenclature de quelques ions
$$\begin{array}{|l|l|l|} \hline &\text{CATIONS}&\text{ANIONS}\\ \hline \text{Ion portant une seule charge}&H^{+}\text{ proton}&F^{-}\text{ ion fluorure}\\ &Na^{+}\text{ ion sodium}&NO_{3}^{-}\text{ion nitrate}\\ &Ag^{+}\text{ ion argent}&Cl^{-}\text{ion chlorure}\\ &H_{3}O^{+}\text{ ion hydronium}&HO^{-}\text{ion hydroxyde}\\ &K^{+}\text{ ion potassium}&MnO_{4}^{-}\text{ion permanganate}\\ &NH_{4}^{+}\text{ ion ammonium}&\\ \hline \text{Ion portant deux charge}&Mg^{2+}\text{ magnésium}&O^{2-}\text{ ion oxyde}\\ &Ca^{2+}\text{ ion calcium}&S^{2-}\text{ion sulfure}\\ &Ba^{2+}\text{ ion baryum}&SO_{3}^{2-}\text{ion sulfite}\\ &Fe^{2+}\text{ ion fer }II&SO_{4}^{2-}\text{ion sulfate}\\ &Ni^{2+}\text{ ion nickel}&CO_{3}^{2-}\text{ion carbonate}\\ &Cu^{2+}\text{ ion cuivre }II&Cr_{2}O_{7}^{2-}\text{ion dichromate}\\ &Zn^{2+}\text{ ion zinc}&S_{2}O_{3}^{2-}\text{ion thiosulfate}\\ &Sn^{2+}\text{ ion étain}&S_{2}O_{6}^{2-}\text{ion tétrathionate}\\ &Pb^{2+}\text{ ion plomb}&\\ \hline \text{Ion portant trois charge}&Al^{3+}\text{ ion aluminium}&PO_{4}^{3-}\text{ ion phosphate}\\ &Fe^{3+}\text{ ion fer }III&N^{3-}\text{ion nitrate}\\ &Au^{3+}\text{ ion or}&\\ \hline \end{array}$$
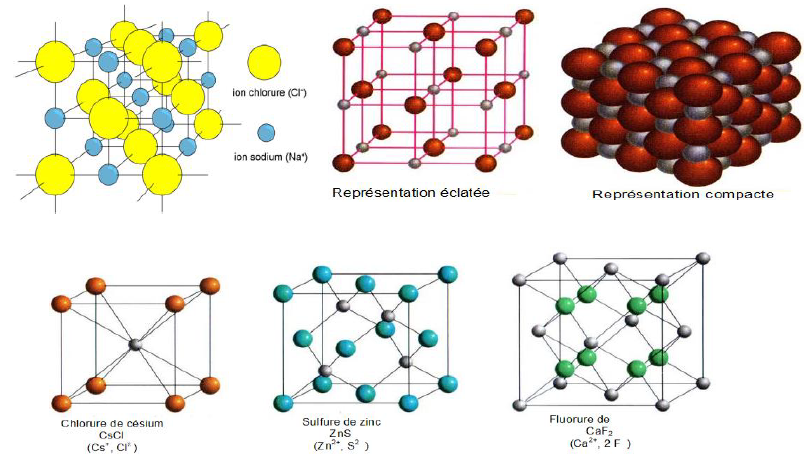
2.3 Exemples de cristal de métal
Dans un solide cristallin ionique, il existe des forces électriques attractives entre ions différents, mais également, des forces électriques répulsives entre ions identiques
Globalement les forces attractives l'emportent sur les forces répulsives : l'ensemble de ces forces constitue la liaison ionique
Dans le cas du chlorure de sodium $(NaCl)$, un ion chlorure $(Cl^{-})$ et un ion sodium $(Na^{+})$ qui s'attirent, se trouvent sur le côté d'un carré, alors que deux ions chlorure ou deux ions sodium qui se repoussent, se trouvent sur une diagonale du carré

Commentaires
Gy (non vérifié)
sam, 02/13/2021 - 10:17
Permalien
Notification
Fallou (non vérifié)
jeu, 02/18/2021 - 19:45
Permalien
Merci bcp
Hane (non vérifié)
jeu, 02/18/2021 - 19:47
Permalien
Pc
Hane (non vérifié)
jeu, 02/18/2021 - 19:47
Permalien
Pc
fatbintou seconde SB (non vérifié)
mar, 03/16/2021 - 21:57
Permalien
avis
Anonyme (non vérifié)
mar, 03/16/2021 - 23:56
Permalien
merci beaucoup
Astou (non vérifié)
sam, 04/09/2022 - 12:39
Permalien
Pourquoi vous n'avez pas
Astou (non vérifié)
sam, 04/09/2022 - 12:39
Permalien
Pourquoi vous n'avez pas
Anonyme (non vérifié)
mer, 02/08/2023 - 21:48
Permalien
Merci
Anonyme (non vérifié)
lun, 05/15/2023 - 09:06
Permalien
Merci les gars vous faites du
divin (non vérifié)
mar, 03/26/2024 - 07:20
Permalien
privee
Abdou (non vérifié)
dim, 02/23/2025 - 22:08
Permalien
Éléve
Anonyme (non vérifié)
dim, 02/08/2026 - 14:56
Permalien
METTER DES exos merci
Ajouter un commentaire