Les chaines carbonées insaturées : les alcanes et les alcynes - 1er s
Classe:
Première
Il existe, parmi les hydrocarbures un groupe de composé qui porte le nom d'hydrocarbures instaurés $A$ égale nombre d'atomes de carbone, leur molécule contient moins d'atomes d'hydrogène que les molécules d'alcanes.
Ainsi, la formule de L'éthane étant $C_{2}H_{6}$ nous étudions :
$-\ $ L'éthylène $C_{2}H_{6}$ (atomes d'hydrogène de moins) qui fait partie des alcènes.
$-\ $ L'acétylène ou l'éthyne $C_{2}H_{2}$ (atomes d'hydrogène de moins) qui fait partis des alcynes.
Ces hydrocarbures instaurés sont beaucoup plus réactifs que les alcanes.
En particulier ils se prêtent à un type de réaction : les réactions d'addition.
I. Structures des alcènes et des alcynes
1. Exemple d'alcènes : l'éthylène ou l'éthène
L'éthylène ou l'éthène est le premier terme d'une série d'hydrocarbures insaturée appelée alcène.
L'éthylène est gazeux dans les $CNTP$ et sa formule brute est $C_{2}H_{4}.$
Grâce aux méthodes physique on a pu déterminer la géométrie de la molécule.
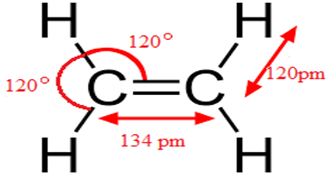
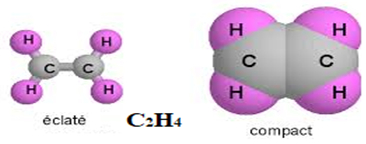
La plane est molécule, chaque atome se trouve dans un triangle, on dit que le carbone est trigonal $HCH=HCC=120^{\circ}$ et la double liaison $(C=C)$ a pour longueur $134\,pm.$
Les liaison covalentes $(C=C)$ ne sont pas équivalentes.
Elles sont constituées de la liaison covalente $\delta$(sigma) solide et dure, et de la liaison covalente $^\pi$ (pi) fragile.
2. Exemple d'alcyne : l'acétylène ou éthyne
L'acétylène ou l'éthyne, le premier terme d'une série d'hydrocarbure instaurée appelée alcyne, est gazeux dans les $CNTP.$
Sa formule brute est $C_{2}H_{2}.$
Grâce aux méthodes des physiques on a pu déterminer la géométrie de la molécule.
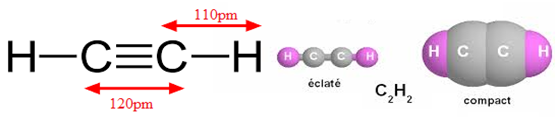
Chaque atome de carbone est lié à deux atomes par une simple liaison et une triple liaison.
On dit que l'atome de carbone est digonal.
La triple liaison possède deux liaison $\pi$ (pi) fragile et une liaison $\delta$ (sigma) solide.
Les centres des atomes sont alignés, la molécule d'acétulène est linéaire.
Remarque :
$d\ (C\equiv C)=120\,pm<d(C=C)=134\,pm<d(C-C)=154\,pm$
II. Nomenclature
1. Formules générales
Les alcènes sont des hydrocarbures instaurés à chaines ouvertes renfermant une double liaison.
Leur formule générale s'écrit : $C_{n}H_{2n}$ avec $n\geq 2.$
Les alcynes sont des hydrocarbures instaurés à chaine ouverte renfermant une triple liaison : leur formule générale s'écrit : $C_{n}H_{2n-2}$ avec $n\geq 2.$
2. Règles de la nomenclature
$-\ $ On utilise les mêmes règles de nomenclatures que les alcanes, mais la chaine la plus longue comportant une liaison multiple.
$-\ $ La chaine est numérotée de telle sorte que le premier atome de carbone de la liaison multiple porte l'indice le plus petit.
$-\ $ L'indice sera placé entre le préfixe indiquant le nombre d'atomes de carbone de la chaine principale et le suffixe qui indique la nature composé insaturé.
La terminaison « ane » est remplacée par « ène » pour les alcènes et « yne » pour les alcynes.
Exemple :
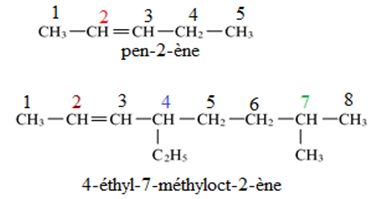
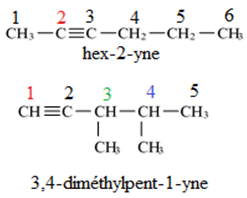
3. Isomérie
3.1 Isomérie de chaine
Les alcènes et les alcynes comme les alcanes peuvent présenter l'isomérie de chaine, de telle isomérie diffère par la chaine carbonée.
Exemple :
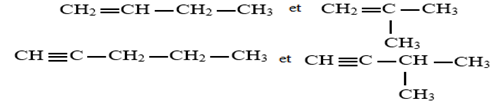
3.2 Isomérie de position
Les alcènes et les alcynes peuvent présenter l'isomérie de position : dans ce cas les isoméries différent par la position de la liaison multiple.
Exemples :
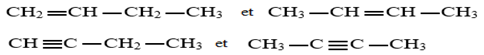
4. Stéréoisomérie
Des stéréoisomères sont des isomères qui diffèrent par la position de leurs atomes dans l'espace.
Il existe chez les alcènes un autre type de stéréo-isomère appelé isomère de configuration.
Exemple :
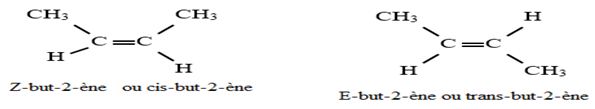
Remarque :
L'isomère $Z–E$ était autrefois appelée cis-trans lorsque les substituants de deux atomes de carbone doublement liés sont les mêmes.
III. Propriétés des alcènes et alcynes
1. Propriétés Physiques
Dans les conditions normales les alcènes de $C_{2}$ à $C_{4}$ sont gazeux, de $C_{5}$ à $C_{18}$ sont liquides, les autres sont solides ».
De même les alcynes de $C_{2}$ à $C_{4}$ sont gazeux, de $C_{5}$ à $C_{15}$ sont liquides, les autres sont solides.
Les alcènes et les alcynes ne sont généralement pas solubles dans l'eau ou le sont peu.
2. Propriétés Chimiques
2.1 Propriétés de destruction
2.1.1 Combustion dans le dioxygène
Les alcènes et les alcynes, comme les alcanes, brulent dans le dioxygène.
Lorsque la quantité de dioxygène est suffisante la combustion est complète.
On obtient de l'eau et du dioxyde de carbone
Les équations s'écrivent :
$C_{n}H_{2n}\ +\ \dfrac{3n}{2}O_{2}\ \rightarrow\ nCO_{2}\ +\ nH_{2}O$
$C_{n}H_{2n-2}\ +\ \dfrac{3n-1}{2}O_{2}\ \rightarrow\ nCO_{2}\ +\ (n-1)H_{2}O$
2.1.2 Combustion dans le dichlore
On obtient un dépôt de carbures et un dégagement de chlorure d'hydrogène.
Les équations s'écrivent :
$C_{n}H_{2n}\ +\ nCl_{2}\ \rightarrow\ nC\ +\ 2nHCl$
$C_{n}H_{2n-2}\ +\ (n-1)Cl_{2}\ \rightarrow\ nC\ +\ (2n-2)HCl$
2.2 Réactions d'addition
2.2.1 Hydrogénation
Il s'agit d'une fixation du dihydrogène sur un alcène ou sur un alcyne : c'est une réaction d'addition.
Les réactions d'hydrogénation se font en présence de catalyseurs comme le platine $(Pt)$, le nickel $(Ni)$, le palladium $(Pd)$
$\bullet\ $ Cas des alcènes
$C_{n}H_{2n}\ +\ H_{2}\ \stackrel{Ni}{\longrightarrow}_{\Delta}\ C_{n}H_{2n+2}$
Exemple :
$H_{2}C=CH_{2}\ +\ H_{2}\ \stackrel{Ni}{\longrightarrow}_{\Delta}\ C_{2}H_{6}$
$\bullet\ $ Cas des alcynes
$C_{n}H_{2n-2}\ +\ 2H_{2}\ \stackrel{Ni\ ou\ Pt}{\longrightarrow}_{\Delta}\ C_{n}H_{2n+2}$
$C_{n}H_{2n-2}\ +\ H_{2}\ \stackrel{Pd}{\longrightarrow}_{\Delta}\ C_{n}H_{2n}$
Exemple :
$HC\equiv CH\ +\ 2H_{2}\ \stackrel{Ni\ ou\ Pt}{\longrightarrow}_{\Delta}\ C_{2}H_{6}$
$HC\equiv CH\ +\ H_{2}\ \stackrel{Pd}{\longrightarrow}_{\Delta}\ H_{2}C=CH_{2}$
Remarque :
L'hydrogénation des alcynes conduit à des alcanes lorsque le platine $(Pt)$ ou le nickel $(Ni)$ sont utilisés comme catalyseurs
En revanche, elle conduit à des alcènes lorsque le palladium $(Pd)$ désactivé.
Et on parle de semi-hydrogénation
2.2.2 Addition du dichlore ou chloration
$\bullet\ $ Addition du dichlore sur l'éthylène ou éthène
Cette réaction est appelé chloration et se produit aussi bien à l'obscurité qu'en présence de lumière et conduit à la formation d'un composé unique
L'équation de la réaction s'écrit :
$CH_{2}=CH_{2}+Cl_{2}\ \rightarrow\ CH_{2}Cl-CH_{2}Cl$
$\bullet\ $ Addition du dichlore sur l'acétylène ou éthyne
Cette réaction dépend de la quantité du dichlore
Avec une molécule du dichlore, on obtient :
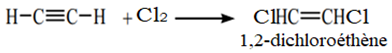
Avec deux molécules de dichlore, on obtient :
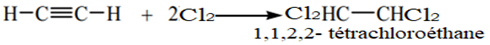
2.2.3 Addition hydracide halogéné $HX$
$\bullet\ $ Addition sur l'éthylène
$CH_{2}=CH_{2}+HCl\rightarrow\ CH_{3}-CH_{2}Cl$
$\bullet\ $ Addition sur le propène
Dans le cas des alcènes dissymétriques, on peut envisager la formation de deux produits isomères dont l'un est prépondérant
$CH_{3}-CH_{2}=CH_{2}+HCl\longrightarrow\left\lbrace\begin{array}{ll} CH_{3}-CH_{2}-CH_{2}&(1)\\ CH_{3}-CHCl-CH_{3}&(2) \end{array}\right.$
$(2)$ est majoritaire
$\bullet\ $ Règle de Markownikow
Lors de l'addition d'un hydracide $HX$ $(X=Cl\;,\ Br\;,\ F\;,\ I/\ldots)$ sur un alcène ou un alcyne dissymétriques, l'hydrogène se fixe de façon prépondérante sur le carbone de la liaison le plus hydrogéné
Remarque :
L'alcène ou l'alcyne est dissymétrique si les groupes d'atomes de part et d'autre de la double ou de la triple liaison sont différents
2.2.4 Addition d'eau ou hydratation
$\bullet\ $ Cas des alcènes
L'addition d'eau sur les alcènes est généralement à haute température en présence de catalyseurs comme l'acide sulfurique $(H_{2}SO_{4})$ ou l'acide phosphorique $(H_{3}PO_{4})$
Exemple :
$CH_{3}-CH_{2}=CH_{2}+H_{2}O\longrightarrow\left\lbrace\begin{array}{ll} CH_{3}-CH_{2}-CH_{2}OH&(1)\\ CH_{3}-CHOH-CH_{3}&(2) \end{array}\right.$
$(2)$ est majoritaire (règle Markownikow)
$-\ $ Cas des alcynes
L'addition d'eau sur un alcyne conduit à la formation d'une cétone.
En particulier pour l'acétylène (éthyne) il se forme non par une cétone mais un aldéhyde.
Exemples :
$CH_{3}-C\equiv C-CH_{3}+H_{2}O\stackrel{H_{g}^{2+}}{\longrightarrow}CH_{3}-CO-CH_{2}-CH_{3}$ : Butan $-2-$ ol
$HC\equiv CH+H_{2}O\stackrel{H_{g}^{2+}}{\longrightarrow}CH_{3}-CHO$ : Ethanal
Remarque :
L'addition d'eau sur un alcène ou un alcyne se fait aussi suivant la réglé de Markownikow.
On notera aussi la formule de l'eau et de la forme $HX$ $(HO=X)$
2.3 Réaction de polymérisation
2.3.1 Définition
La polymérisation est l'addition des uns des autres des molécules insaturées identiques ou des molécules insaturées différentes
Le composé initial est appelé monomère et le produit obtenu est le polymère.
Remarque :
Le polymère est caractérisé par :
$-\ $ Le motif : groupes d'atomes qui se répètent dans la molécule
$-\ $ L'indice de polymérisation ou le degré de polymérisation : c'est le nombre de molécules additionnées
2.3.2 Exemples de réactions de polymérisation
$-\ $ Polyéthylène $(PE)$
$n\left(H_{2}O=CH_{2}\right)\longrightarrow\left(H_{2}O-CH_{2}\right)_{n}$
En fait il existe deux variétés :
$-\ $ polyéthylène "basse densité" $PEBD$, souple, à chaînes ramifiées, dit haute pression $(1000$ atm, $200^{\circ}C)$
$-\ $ polyéthylène "haute densité" $PEHD$, dur, peu ramifié, dit basse pression $(10$ atm, $100^{\circ}C).$
$-\ $ Polypropylène $(PP)$
$n\left(H_{2}O=CH-CH_{3}\right)\longrightarrow\left(-H_{2}O-CH- \shortmid CH_{3}\right)_{n}$
Exemple : Tissu en Méraklon
$-\ $ Polytétrafluoéthylène $(PTFE)$ (Teflon)
$n\left(F_{2}C=CF_{2}\right)\longrightarrow\left(-F_{2}C-CF_{2}-\right)_{n}$
Utilisé dans des tissus imperméables qui respirent de type Goretex
$-\ $ Polystyrène $(PS)$
$\left(nCH_{2}=CH-C_{6}H_{5}\right)\longrightarrow-\left(-CH_{2}-CH\left(C_{6}H_{5}\right)\right)_{n^{-}}$
Les principales utilisations du polystyrène dans la vie courante sont :
$-\ $les boîtiers de $CD$ en $PS$ cristal
$-\ $les couverts et verres en plastique en $PS$ choc
$-\ $les emballages alimentaires (comme les pots de yaourt)
$-\ $les emballages des appareils fragiles en $PSE$
$-\ $Isolation thermique des bâtiments sous forme expansée ou extrudée.

Commentaires
Coumba Kâ (non vérifié)
ven, 03/26/2021 - 21:44
Permalien
Super trop utile et
Zakaria konate (non vérifié)
ven, 04/02/2021 - 15:14
Permalien
Demande de documents
Kara inoussou (non vérifié)
jeu, 12/09/2021 - 09:48
Permalien
Leçon
Sharon (non vérifié)
jeu, 09/08/2022 - 10:09
Permalien
Votre cours est très riche
Anonyme (non vérifié)
mer, 01/25/2023 - 23:36
Permalien
Les alcènes et les alcyneq
Anonyme (non vérifié)
jeu, 03/28/2024 - 01:58
Permalien
Enfaite ya pas un moyen pour
Ajouter un commentaire