Les composés oxygénés - 1er s
Classe:
Première
Un composé organique oxygéné est un corps pur organique dont la molécule comporte les éléments carbone, oxygène et hydrogène
Un groupement d'atomes de carbone, oxygène et hydrogène d'une molécule qui sont agencés d'une certaine façon et qui ont des propriétés identifiables.
On étudiera dans ce chapitre les fonctions alcool, aldéhyde, cétone, acide carboxylique et ester
I. Présentation des composés oxygénés
1. L'atome d'oxygène
L'oxygène a pour numéro atomique $Z=8$ et sa structure électronique $(K)^{2}(L)^{6}$
Son schéma de Lewis est : 

L'atome d'oxygène peut donc établir soit deux liaisons simples, soit une double liaison
2. Les liaisons de covalence établies par les atomes d'oxygène
Avec le carbone et l'hydrogène, les types d'enchainements possibles sont :
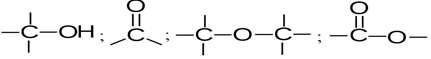
Chacun des groupements ainsi constitués confèrent aux molécules qui le contiennent un ensemble de propriétés.
On définit alors une fonction et le groupement constitué porte le nom groupe fonctionnel
II. Composés dont la molécule comporte un atome d'oxygène
1. Les alcools et les éthers-oxydes
Ce sont des composés organiques oxygénés comportant un seul un atome d'oxygène
Leur formule brute générale est : $C_{n}H_{2n+2}O_{2}$
1.1 Les alcools
1.1.1 Définition
Les alcools sont des composés organiques oxygénés comportant le groupe fonctionnel hydroxyle $(-OH)$ lié à un carbone tétragonal appelé carbone fonctionnel
La formule générale d'un alcool est : $R-OH\text{ ou }C_{n}H_{2n+1}OH$
1.1.2 Les classes d'alcools
Un alcool est dit primaire, secondaire ou tertiaire selon que le carbone du groupe fonctionnel $($atome de carbone lié au groupe $–OH)$ est lié respectivement à un zéro ou un atome ; deux atomes ; ou trois atomes de carbone
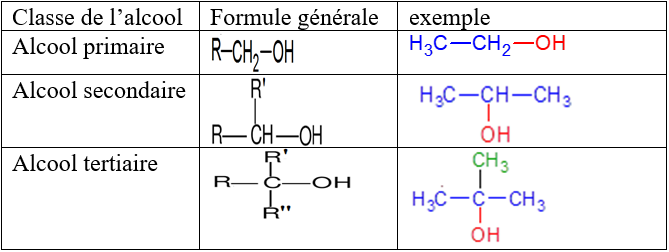
Remarque
$R$, $R'$ et $R''$ sont des groupes alkyles
1.1.3 Nomenclature
Le nom d'un alcool dérive de celui de l'alcane correspondant en remplace le $« e »$ final de l'alcane par la terminaison $« ol »$, précédée, si nécessaire, de l'indice de position du groupe hydroxyle dans la chaîne carbonée principale.
Exemples
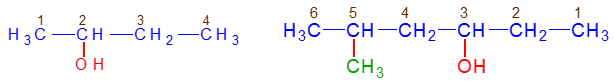
$\text{Butan}-2-ol\qquad\qquad 5-\text{méthylhexan}-3-ol$
1.2 Les éthers-oxydes
1.1.1 Définition
Un éther-oxyde est un composé organique oxygéné contenant un atome d'oxygène lié à deux atomes de carbone à structure tétraédrique
La formule générale d'un éther-oxyde est : $R-O-R’’$ où $R$ et $R’’$ sont des groupes alkyles
1.1.2 Nomenclature
Pour un éther-oxyde, on considère le plus petit groupe $(R$ par exemple$)$ pour former le substituant alcoxy et on nomme le composé comme substituant de l'autre $R’$ de la molécule
Exemples
$CH_{3}-CH_{2}-O-CH3$ : Méthoxyéthane ou oxyde d'éthyle et de méthyle,
$CH_{3}-CH(CH_{3})-O-CH_{3}$ : Méthoxyméthyl $-2-$ propane ou oxyde de méthyle et de $2-$ propyle.
$CH_{3}-CH(CH_{3})-CH_{2}-O-CH_{3}$ : méthoxy $-2-$ méthylpropane ou oxyde de méthyle et de $(2-$ méthyl$)$ propyle.
1.1.3 Quelques propriétés des éthers-oxydes
Les éthers-oxydes sont pour la plus plupart à l'état liquide
A température ordinaire, ils sont beaucoup plus volatils et beaucoup moins solubles dans l'eau
2. Les aldéhydes et les cétones
Les aldéhydes et les cétones sont des composés carbonylés de formule brute générale $C_{n}H_{2n}O$
Un dérivé carbonylé est un composé organique oxygéné qui comporte le groupe carbonyle 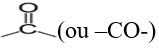
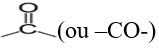
Le carbone doublement lié à l'oxygène peut être lié à un ou (des atomes) de carbone ou un atome d'hydrogène
L'atome de carbone du groupement carbonyle est appelé carbone fonctionnel.
Il est trigonal
2.1 Les aldéhydes
2.1.1 Définition
Un aldéhyde est un composé organique oxygénée qui contient le groupe caractéristique 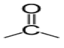 , appelé groupe carbonyle, directement lié à au moins un atome d'hydrogène :
, appelé groupe carbonyle, directement lié à au moins un atome d'hydrogène :
 , appelé groupe carbonyle, directement lié à au moins un atome d'hydrogène :
, appelé groupe carbonyle, directement lié à au moins un atome d'hydrogène :
Les aldéhydes ont pour formule générale : 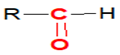

où $R$ est un groupe alkyle
Remarques :
$-\ $ Dans un aldéhyde, le groupe carbonyle est toujours situé à l'extrémité de la chaîne carbonée
$-\ $ La formule semi-développée générale d'un aldéhyde peut s'écrire : $RCHO$ ou $R‒CHO$
Exemples
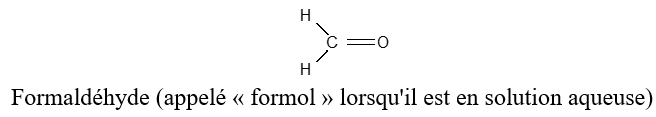
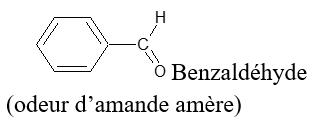
2.1.2 Nomenclature
Le nom d'un aldéhyde dérive de celui de l'alcane correspondant en remplaçant le $« e »$ final de l'alcane par la terminaison $« al ».$
Exemples
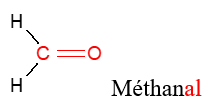
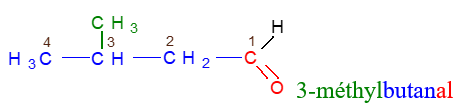
2.2 Les cétones
2.2.1 Définition
Une cétone est un composé organique oxygénée qui contient le groupe carbonyle $-C=O$, directement lié à deux atomes de carbone
La formule générale est : 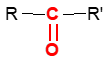 où $R$ et $R'$ sont des groupes alkyles
où $R$ et $R'$ sont des groupes alkyles
 où $R$ et $R'$ sont des groupes alkyles
où $R$ et $R'$ sont des groupes alkylesRemarques
$-\ $ Dans une cétone, le groupe carbonyle ne peut pas être situé à l'extrémité de la chaîne carbonée, contrairement à un aldéhyde ;
$-\ $ La formule semi-développée générale d'une cétone peut s'écrire : $RCOR’$ ou $R‒CO‒R’.$
Exemples

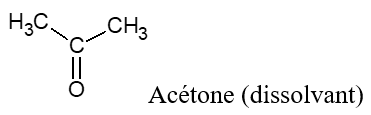
2.2.2 Nomenclature
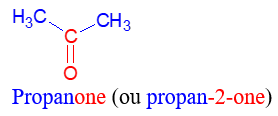
Le nom d'une cétone dérive de celui de l'alcane correspondant en remplaçant le $« e »$ final de l'alcane par la terminaison $« one »$, précédée, si nécessaire, de l'indice de position du groupe carbonyle dans la chaîne carbonée principale
Exemples
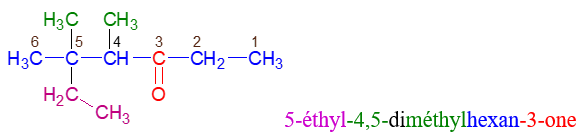
2.3 Tests des aldéhydes et des cétones
Pour repérer la présence d'un aldéhyde ou d'une cétone dans un milieu réactionnel, il est possible d'utiliser des tests d'identification : l'ajout d'un réactif particulier provoque la formation d'un précipité ou un changement de couleur du milieu
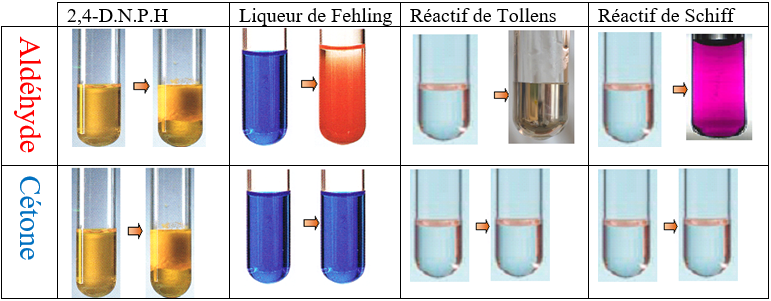
$\bullet $ Test à la $D.N.P.H.$
La $D.N.P.H.$ $(2.4-$ dinitrophénylhydrazine$)$ réagit en présence du groupe carbonyle $─CO─$ et donne un précipité jaune.
La $D.N.P.H.$ réagit avec les cétones et les aldéhydes
$\bullet $ Test à la liqueur de Fehling
La liqueur de Fehling est obtenue en mélangeant une solution aqueuse acidifiée de sulfate de cuivre $(CuSO_{4}\;,\ 5H_{2}O)$ et une solution aqueuse basique de tartrate de sodium et de potassium $(KNaC_{4}H_{4}O_{6}\;,\ 4H_{2}O).$
Elle contient des ions cuivre $(II)Cu^{2+}$ (de couleur bleue en solution aqueuse).
A chaud, en milieu basique, l'aldéhyde réduit les ions $Cu^{2+}$ en oxyde de cuivre $I(Cu_{2}O_{(s)})$ qui forme un précipité rouge brique.
L'équation de la réaction (d'oxydoréduction) est la suivante :
$R-CHO+2Cu^{2+}+5HO^{-}\rightarrow R-COO^{-}+Cu_{2}O+3H_{2}O$
$\bullet $ Test de Tollens
Le réactif de Tollens est une solution de nitrate d'argent en milieu ammoniacal : elle est obtenue en mélangeant une solution aqueuse de nitrate d'argent $($ à $5\%)$ avec une solution concentrée d'ammoniaque.
Elle contient des ions argent $Ag^{+}$ (incolores).
En milieu basique, les ions $Ag^{+}$ sont réduits par l'aldéhyde et forment un dépôt d'argent solide (« miroir d'argent ») selon la réaction suivant :
$$R-CHO+2Ag^{+}+3HO^{-}\rightarrow\;R-COO^{-}+2Ag+2H_{2}O$$
$\bullet $ Test au réactif de Schiff
Les aldéhydes peuvent être facilement mis en évidence par le réactif de Schiff.
Un papier filtre imbibé de réactif de Schiff rosit dès qu'il entre en contact avec des vapeurs d'un aldéhyde (très volatile).
Dès qu'on verse quelques gouttes d'éthanal dans le réactif de Schiff, celui-ci se colore en rose.
Remarques
$-\ $ La $D.N.P.H.$ est commun aux aldéhydes et aux cétones.
$-\ $ La liqueur de Fehling, le réactif de Tollens et le réactif de Schiff sont aux aldéhydes
II. Composés dont la molécule comporte deux atomes d'oxygène
Les acides carboxyliques et les esters sont des composés organiques oxygénés de formule brute générale $C_{n}H_{2n}O_{2}$
1. Les acides carboxyliques
1.1 Définition
Un acide carboxylique est un composé organique oxygéné qui contient le groupe carboxyle $«‒COOH »$ ou 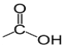 directement lié à un atome de carbone
directement lié à un atome de carbone
 directement lié à un atome de carbone
directement lié à un atome de carbone
La formule générale d'un acide carboxylique est :
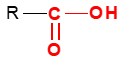
Remarques :
$-\ $ Dans un acide carboxylique, le groupe carboxyle est toujours situé à l'extrémité de la chaîne carbonée ;
$-\ $ La formule semi-développée générale d'un acide carboxylique s'écrire : $RCOOH$ ou $R‒COOH$ ou $RCO_{2}H$
Exemple :

1.2 Nomenclature
Le nom d'un acide carboxylique dérive de celui de l'alcane correspondant en remplaçant le $« e »$ final de l'alcane par la terminaison $« oïque »$ et le tout précédé par le mot $« acide ».$
Exemples :
$HCOOH$ Acide méthanoïque (ou acide formique)
$CH_{3}-COOH$ Acide méthanoïque (ou acide acétique)
$HOOC-COOH$ Acide éthanedioïque (ou acide oxalique)
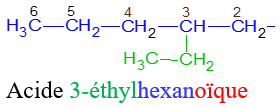
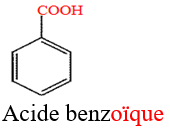
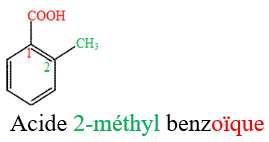
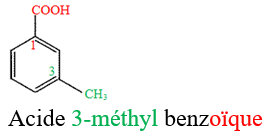
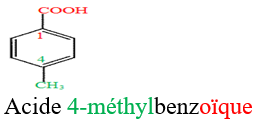
1.3 Test d'identification des acides carboxyliques
Les acides carboxyliques sont caractérisés par la présence du groupe carboxyle $–COOH$ dans leur molécule.
Un acide carboxylique provoque la décoloration du papier $pH$ (teinte acide)
Il provoque aussi le passage de la teinte verte à la teinte jaune pour le bleu de bromothymol $(BBT)$
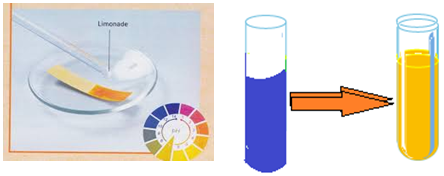
Remarque :
Le groupe hydroxyle $(–OH)$ du groupement carboxyle n'est pas un groupe hydroxyle car il est lié à un atome de carbone, lui-même lié par une liaison covalente double à un atome d'oxygène.
2. Les esters
2.1 Définition
Un ester est un composé organique oxygéné qui possède le groupe fonctionnel 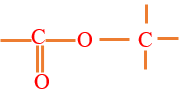

La formule générale d'un ester est : 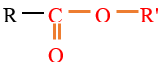
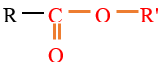
2.2 Nomenclature
Le nom de l'ester s'obtient en faisant suivre le nom du groupe carboxylate de celui du groupe alkyle $-R$
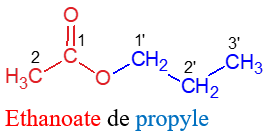
Exemples


Commentaires
Seybata Diagne (non vérifié)
jeu, 05/20/2021 - 15:09
Permalien
Je une meilleure moyenne en physique chimie
Seybata Diagne (non vérifié)
jeu, 05/20/2021 - 15:10
Permalien
Je veux une meilleure moyenne en physique chimie
Amadou Sangaré (non vérifié)
sam, 03/09/2024 - 16:40
Permalien
Connaitre
Ajouter un commentaire