Les acides carboxyliques et dérivés - Ts
Classe:
Terminale
A. Les acides carboxyliques
I. Généralités
1. Définition
Les acides carboxyliques sont des composés oxygénés dont la chaine carbonée comporte deux atomes d'oxygène
Leur formule générale est : 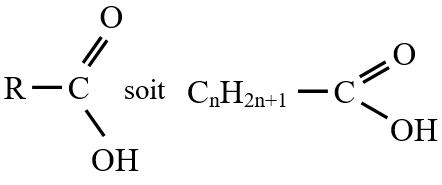
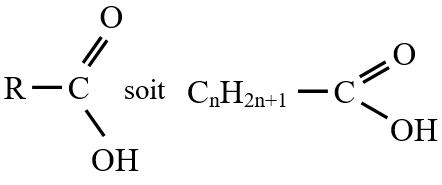
$\left(C_{n}H_{2n+1}COOH\text{ ou }C_{n}H_{2n}O_{2}\right)$
ou 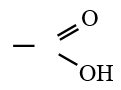 est le groupe fonctionnel appelé groupe carboxylique
est le groupe fonctionnel appelé groupe carboxylique
 est le groupe fonctionnel appelé groupe carboxylique
est le groupe fonctionnel appelé groupe carboxylique2. Nomenclature
Le nom de l'acide dérive de celui de l'alcane de même chaine carbonée en remplaçant le « e » par oïque, le tout précédé du mot acide
Le carbone du groupe fonctionnel porte toujours le numéro $1$
Exemples :
$HCOOH$ : Acide méthanoïque

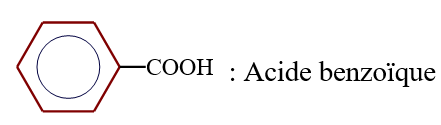

Remarque :
$-\ $ Un composé organique peut posséder deux groupes carboxyles positionnés soit aux extrémités d'une chaine aliphatique, soit sur deux carbones d'un groupe aromatique
Ces diacides sont dénommés dioïques ou dicarboxyliques
Exemples :
$HOOC-COOH$ : Acide éthanedioïque (ou acide oxalique)
$HOOC-\left(CH_{2}\right)_{4}-COOH$ : Acide hexanedioïque (ou acide adipique)
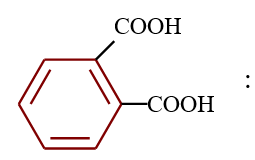
Acide benzène $-1.2-$ dioïque (acide orthophtalique)
Les acides gras sont des acides à chaines linéaires saturées ou non possédant un nombre d'atomes de carbone pair et tel que $4\leq n\leq 22$
$CH_{3}-\left(CH_{2}\right)_{16}-COOH$ : Acide stéarique
$CH_{3}-\left(CH_{2}\right)_{7}-CH=CH-\left(CH_{2}\right)_{7}-COOH$ : Acide oléique
II. Propriétés des acides carboxyliques
1. Propriétés physiques
Dans les conditions ordinaires de température et de pression, tous les acides carboxyliques sont liquides ou solides.
Les acides carboxyliques de $C_{1}$ à $C_{4}$ sont très solubles dans l'eau.
La solubilité dans l'eau décroit quand le nombre d'atomes de carbone augmente
Les acides carboxyliques ont des températures d'ébullition relativement élevées
2. Propriétés chimiques
2.1. Propriétés acides
2.1.1. Action sur l'eau
Les acides carboxyliques sont des acides faibles.
Toutes les solutions aqueuses d'acide carboxylique sont acides
Les acides carboxyliques réagissent sur l'eau : la réaction est limitée par la réaction inverse
$R-COOH\ +\ H_{2}O\ \leftrightarrows\ R-COO^{-}\ +\ H_{3}O^{+}$
acide carboxylique ion carboxylique ion hydronium
Exemple :
$HCOOH\ +\ H_{2}O\ \leftrightarrows\ HCOO^{-}\ +\ H_{3}O^{+}$
acide méthanoique ion méthanoate
2.1.2. Action sur les bases
Une solution aqueuse d'acide carboxylique peut-être dosée par une base forte
L'équation-bilan s'écrit :
$R-COOH+OH^{-}\rightarrow R-COO^{-}+H_{2}O$
Exemple :
$CH_{3}-CH_{2}-COOH+OH^{-}\rightarrow CH_{3}-CH_{2}-COO^{-}+H_{2}O$
acide propanoique ion propanoate
La réaction est totale.
Une indicateur coloré peut servir d'indicateur de fin de réaction
c) Action sur les métaux
Les acides carboxyliques donnent de nombreux sels avec certains métaux (zinc, aluminium...)
La réaction est une oxydoréduction
Exemple :
$2CH_{3}-COOH+Zn\rightarrow\left(CH_{3}CO_{2}\right)_{2}Zn+H_{2}$
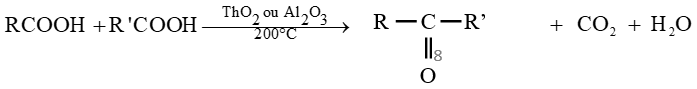
2.2. La décarboxylation
La décarboxylation est une élimination du dioxyde de carbone des molécules d'acides
C'est une réaction qui permet de mettre en évidence le groupement carboxyle
Elle se fait, le plus souvent, à température élevée en présence de catalyseur
Les équations-bilans s'écrivent :
$R-COOH\stackrel{Ni\text{ à }200^{\circ}}{\longrightarrow}RH\ +\ CO_{2}$
Alcane
Exemples :
$CH_{3}-COOH\stackrel{Ni\text{ à }200^{\circ}}{\longrightarrow}CH_{4}\ +\ CO_{2}$
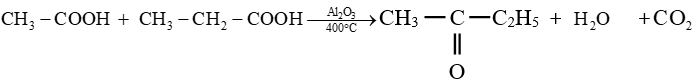
$CH_{3}-COOH+HCOOH\stackrel{Al_{2}O_{3}\text{ à }400^{\circ}}{\longrightarrow}CH_{3}-CH_{2}-CHO+CO_{2}+H_{2}O$
Remarques :
$-\ $ Le dernier exemple constitue un cas particulier car la réaction aboutit à la formation d'un aldéhyde
$-\ $ Un diacide peut se « décarboxyler » pour donner un monoacide
La décarboxylation de l'acide propanedioïque, par exemple, peut donner l'acide éthanoïque
L'équation-bilan de la réaction s'écrit :
$HOOC-CH_{2}-COOH\stackrel{140^{\circ}}{\longrightarrow}CH_{3}COOH\ +\ CO_{2}$
B. Les dérivées des acides carboxyliques
La formule générale d'un dérivé de l'acide carboxylique est :
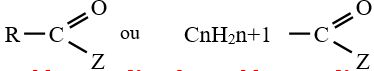
I. Les chlorures d'acyle ou chlorures d'acide
1. Formule générale
Lorsque $Z$ est un atome de chlore, le dérivé d'acide carboxylique est un chlorure d'acyle (ou d'acide) de formule :
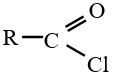
2. Nomenclature
Le chlorure d'acyle est appelé chlorure de suivi du nom de l'alcane ayant la même chaine carbonée auquel on remplace la terminaison $« e »$ par oyle
Exemples :
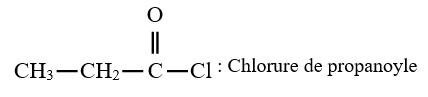
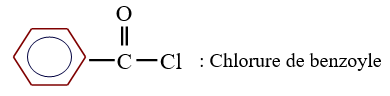

3. Préparation des chlorures d'acyle
Les chlorures d'acyle sont obtenus en traitant les acides carboxyliques par :
$-\ $ le pentachlorure de phosphore $PCl_{5}$
$-\ $ le trichlorure de phosphore $PCl_{3}$
$-\ $ le chlorure de thionyle $SOCl_{2}$
Les équations-bilans s'écrivent :
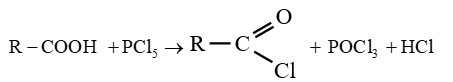
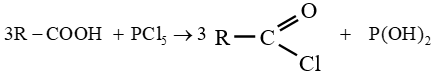
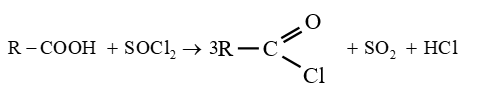
Soit en résumé :
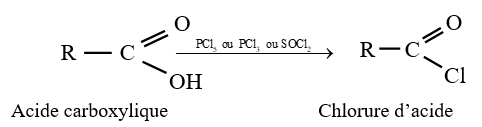
4. Hydrolyse des chlorures d'acide
Les chlorures d'acyle s'hydrolysent facilement en donnant l'acide carboxylique correspondant.
La réaction est exothermique
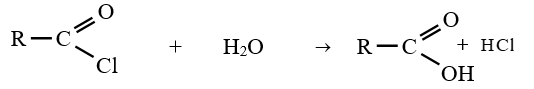
Exemple :
$CH_{3}-COCl\ +\ H_{2}O\ \rightarrow\ CH_{3}-COOH\ +\ H_{2}O$
II. Les anhydrides d'acide
1. Formule générale :
Lorsque $Z$ est un groupe 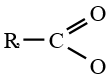 le dérivé d'acide carboxylique est un anhydride d'acide de formule générale :
le dérivé d'acide carboxylique est un anhydride d'acide de formule générale :
 le dérivé d'acide carboxylique est un anhydride d'acide de formule générale :
le dérivé d'acide carboxylique est un anhydride d'acide de formule générale : 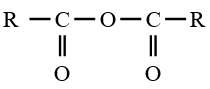 $\left(C_{n}H_{2n-3}O_{3}\quad n\geq 2\right)$
$\left(C_{n}H_{2n-3}O_{3}\quad n\geq 2\right)$2. Nomenclature
L'anhydride d'acide est appelé anhydride, suivi du nom de l'acide carboxylique auquel on élimine le mot acide
Exemples :
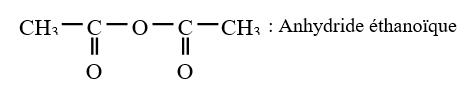
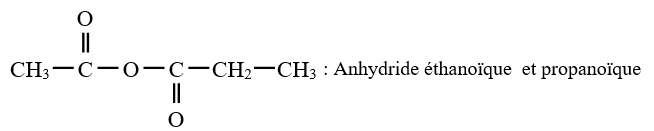
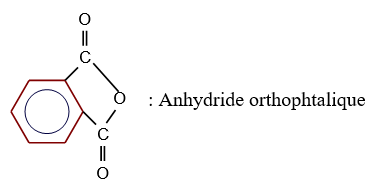
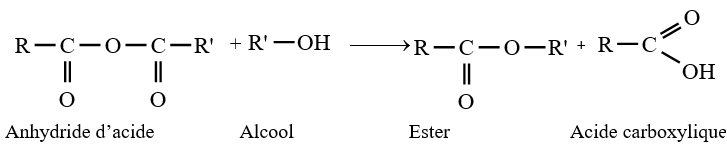
3. Préparation des anhydrides d'acide
Les anhydrides d'acide peuvent être obtenus :
3.1 Par élimination à partir d'eau de deux fonctions carboxyliques
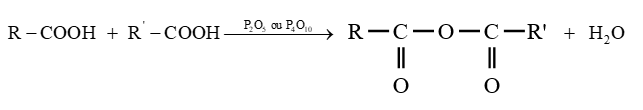
3.1.1 Déshydratation intermoléculaire
Un déshydratant énergétique telque pentoxyde de diphosphore $P_{2}O_{5}$ ou decaoxyde de tétraphosphore $P_{4}O_{10}$ permet d'éliminer une molécule d'eau entre deux molécules d'acides carboxyliques.
On parle de déshydratation intermoléculaire
L'équation-bilan de la réaction s'écrit :
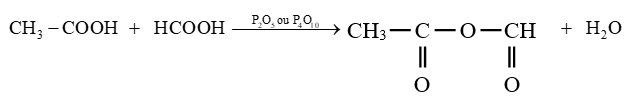
Exemple :
3.1.2 Déshydratation intramoléculaire
Dans le cas d'un diacide si les deux groupes carboxyliques sont suffisamment proches de l'un de l'autre, il peut y avoir élimination d'une molécule d'eau à partir d'une seule molécule d'acide.
On parle de déshydratation intramoléculaire
C'est le cas pour l'acide benzène $-1.2-$ dioïque
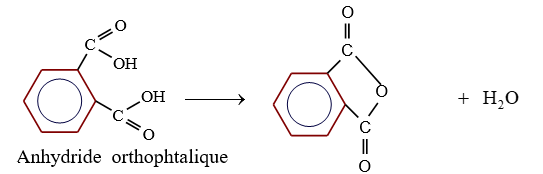
2.2 Par action d'un chlorure d'acyle sur un acide ou sur un ion carboxylate
Les anhydrides d'acide peuvent obtenus par action d'un chlorure d'acide sur un acide ou sur un ion carboxylate
Les équations-bilans des réactions s'écrivent :
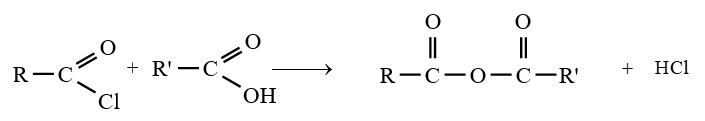
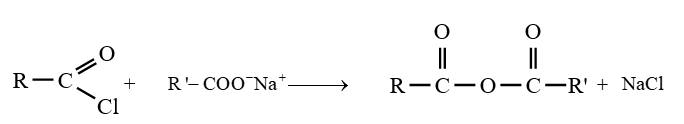
Remarque :
Dans la pratique, les anhydrides d'acide sont surtout préparés par action des chlorures d'acide sur les acides carboxyliques ou les ions carboxylates
III. Les esters
1. Formule générale
Lorsque $Z$ est un groupe $O-R'$, le dérivé d'acide carboxylique est un ester de formule générale :
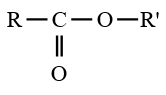 $\left(C_{n}H_{2n}O_{2}\text{ avec }n\geq 2\right)$
$\left(C_{n}H_{2n}O_{2}\text{ avec }n\geq 2\right)$2. Nomenclature
Le nom de l'ester s'obtient en faisant suivre le nom du groupe carboxylate de celui du groupe alkyle $-R$
Exemples :
$CH_{3}-CH_{2}-COO-C_{2}H_{5}$ : Propanoate d'éthyle
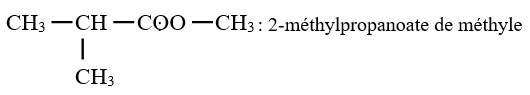
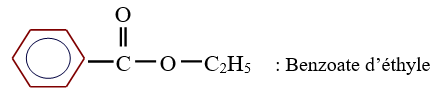
3. Estérification
Un ester peut être préparé par plusieurs méthodes :
$-\ $ par action d'un acide carboxylique sur un alcool : on parle d'estérification directe
$-\ $ par action d'un chlorure d'acyle ou d'un anhydride sur un alcool : on parle d'estérification indirecte
3.1 Estérification directe
C'est une réaction entre un acide et un alcool
Il s'agit d'une réaction très lente, athermique, réversible (donc limitée)
L'équation-bilan de la réaction s'écrit :
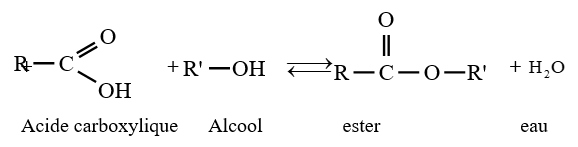
Exemple :
$CH_{3}-COOH+CH_{3}-CH_{2}-CH_{2}OH\rightarrow CH_{3}-COO-CH_{2}-CH_{2}-CH_{3}+H_{2}O$
$\bullet\ $ Rendement d'une estérification
On appelle rendement d'une transformation chimique le rapport entre la quantité de matière (respectivement la masse) du produit effectivement obtenu et la quantité de matière (respectivement la masse) théorique que l'on obtiendrait si la réaction était totale
$$\boxed{\dfrac{n_{\text{obtenu}}}{n_{\text{max}}}=\dfrac{m_{\text{obtenu}}}{m_{\text{max}}}}$$
Remarque
Le rendement de l'estérification dépend peu du choix de l'acide.
En revanche il dépend beaucoup de la classe de l'alcool
Pour un mélange équimolaire d'acide et d'alcool, ce rendement est de $67\%$ pour un alcool primaire, $60\%$ pour un alcool secondaire et $5\%$ pour un alcool tertiaire
$\bullet\ $ Constante d'estérification
$$\boxed{K_{\text{estérification}}=\dfrac{[\text{ester}][\text{eau}]}{[\text{acide}][\text{alcool}]}}$$
3.2 Estérification indirecte
Si l'estérification directe des alcools par les acides carboxyliques est limitée et lente, en revanche la réaction d'estérification par des chlorures d'acyle ou des anhydrides est totale et rapide
Les équations-bilans des réactions s'écrivent :
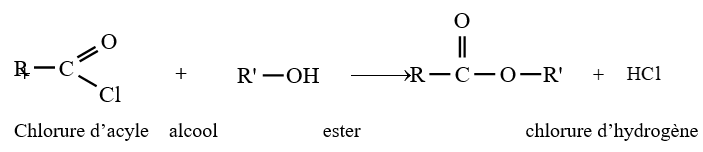
Exemples :
$CH_{3}-COCl+CH_{3}OH\rightarrow CH_{3}-COOCH_{3}+HCl$
Chlorure d'éthanoyle méthanol éthanoate de méthyle chlorure d'hydrogène
$\left(CH_{3}-CO\right)_{2}O+CH_{3}-CHOH-CH_{3}\rightarrow CH_{3}-COO-CH\left(CH_{3}\right)-CH_{3}-COOH$
Anhydride acétique Propan $-2-$ ol Acétate de méthyléthyle ou d'isopropyle Acide acétique
4. Cas des polyesters
On peut avoir une réaction d'estérification entre :
$-\ $ un acide carboxylique et un polyalcool
$-\ $ un polyacide et un polyalcool
Exemples :
$-\ $ Les corps gras sont des polyesters plus précisément des triesters du glycérol
L'équation-bilan de la réaction s'écrit :
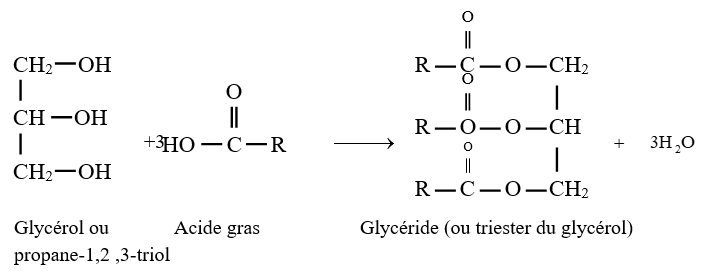
$-\ $ La réaction de polycondensation entre l'éthane $-1.2-$ diol et le diacide conduit à la formation des chaines de polyesters
$nHO-CH_{2}CH_{2}-OH+nHOOC-C_{6}H_{4}-COOH\rightarrow -\left(O-CO-C_{6}H_{4}-COO-CH_{2}CH_{2}\right)_{n}-\ +\left(2n-1\right)H_{2}O$
Remarque :
Une réaction de polycondensation se distingue d'une polymérisation par le fait que la jonction entre les différents maillons de la macromolécule est accompagnée de la formation d'une molécule annexe
4. Hydrolyse
L'hydrolyse d'un ester est son action sur l'eau : c'est une réaction inverse de l'action de l'acide sur un alcool
Comme l'estérification, c'est une réaction lente et limitée : elle conduit à un équilibre chimique
L'équation-bilan de la réaction s'écrit :
$R-COOR'+H_{2}O\rightarrow R-COOH+R'-OH$
Remarque :
L'estérification et l'hydrolyse constituent une réaction lente et réversible conduisant à un équilibre chimique où les quatre composés coexistent dans des proportions constantes (en fait il s'agit d'un équilibre dynamique durant lequel les deux réactions continuent d'avoir lieu mais avec des vitesses égales)
5. Saponification
Les esters réagissent sur les bases fortes comme l'hydroxyde de sodium $(NaOH)$ ou l'hydroxyde de potassium $(KOH)$
La réaction donne un alcoolate et un carboxylate de potassium ou de sodium
L'équation-bilan de la réaction s'écrit :
$R-CO-O-R'+MOH\rightarrow R-COO^{-}M^{+}+R'-OH$
$\left(M=Na^{+}\;,\ K^{+}\right)$ Carboxylate de $M$ Alcool
(Savon)
La saponification conduit à la formation du savon lorsqu'elle est effectuée avec des esters particuliers
La saponification d'un triglycéride (corps gras) par l'hydroxyde de sodium par exemple donne le glycérol et un carboxylate de sodium
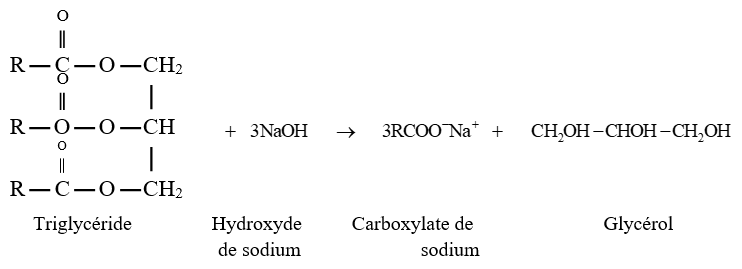
IV. Les amides
1. Formule générale
Lorsque $Z$ est un groupe fig571 le dérivé d'acide carboxylique est un amide de formule générale : fig572 $(R$ et $R'$ pouvant être des atomes d'hydrogène ou des groupes alkyles$)$
2. Nomenclature
Le nom d'un amide dérive de celui de l'alcane de même de chaine carbonée en remplaçant la terminaison $« e »$ par amide
Exemples :
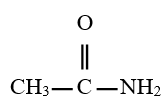
Ethanamide
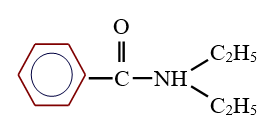
$N$, $N-$ diéthylbenzanamide
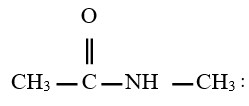
$N-$ éthyléthanamide
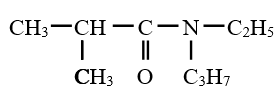
$N$, éthyl $-N-$ propyl $-2-$ méthylpropanamide
3. Préparation des amides
Les amides peuvent être obtenus à partir des acides
L'action de :
$-\ $ l'ammoniac, d'une amine primaire ou secondaire conduit à la formation d'un carboxylate d'ammonium ou alkylammonium
Ce carboxylate porté à haute température se déshydrate avec formation d'un amide
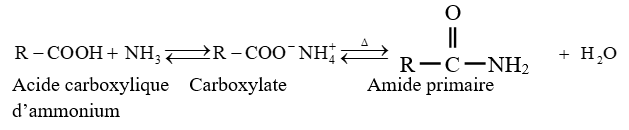
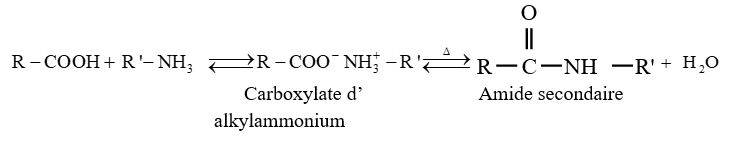
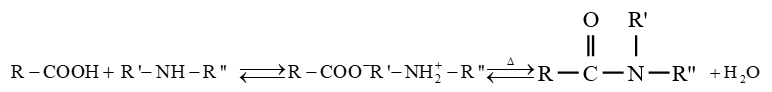
Ces réactions sont lentes et réversibles conduisant à un équilibre chimique ; ce qui limite les rendements
$-\ $ l'action de l'ammoniac ou d'une amine sur le chlorure d'acyle
La réaction d'un chlorure d'acyle sur l'ammoniac ou amine primaire ou secondaire est rapide et totale
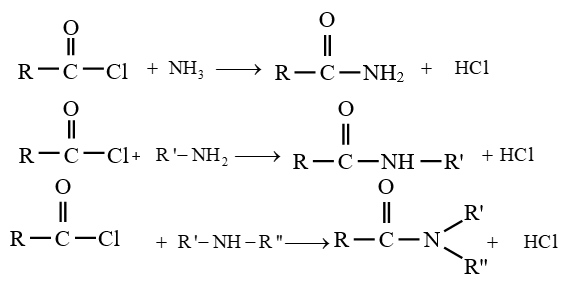
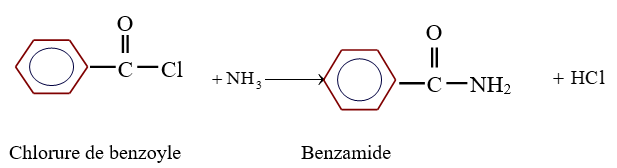
Exemple :
$-\ $ les amides peuvent être obtenus à partir des anhydrides d'acide.
La réaction est totale et rapide
Les équations-bilans des réactions s'écrivent :
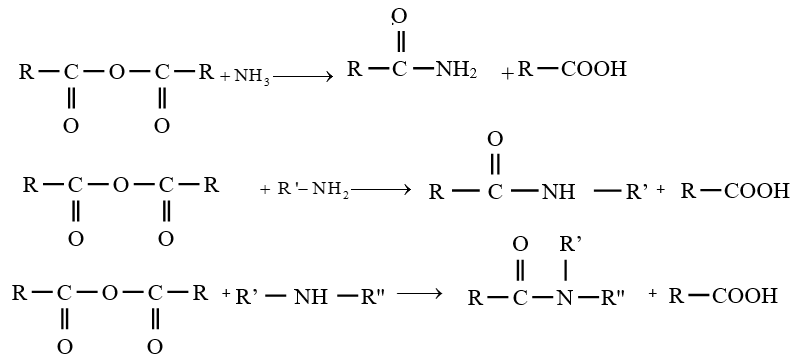
4. Les polyamides
Il s'agit des macromolécules formées par la répétition d'un motif élémentaire comportant la fonction amide
Ils sont obtenus par des réactions de polycondensation mettant en jeu un diacide et une diamine, soit aminoacide
Exemple :
Le « nylon $6-6$ » est un polyamide, produit de la réaction de polycondensation entre le chlorure d'hexanedioyle et l'hexane $-1.6-$ diamine
$nCOCl-\left(CH_{2}\right)_{4}-COCl+nH_{2}N-\left(CH_{2}\right)_{6}-NH_{2}\rightarrow\left(-CO-\left(CH_{2}\right)_{4}-CO-HN-\left(CH_{2}\right)_{6}-NH\right)_{n}-\ +2nHCl$
Remarque :
L'appellation du « nylon $6-6$ » précise que la réaction de polycondensation fait intervenir deux molécules renfermant chacune six atomes de carbone

Commentaires
Matar (non vérifié)
jeu, 07/15/2021 - 15:55
Permalien
Je voulais bien comprendre
Anonyme (non vérifié)
jeu, 04/24/2025 - 10:36
Permalien
Cours détaillé mais manque d
Ajouter un commentaire