Notions de solutions - 3e
Classe:
Troisième
Situation – problème
Keur Mbouki, village situé sur le bras de mer le Saloum, tire l'essentiel de ses revenus de la vente de sel produit localement.
Chaque année, pendant la saison sèche, la forte chaleur évapore progressivement l'eau de mer qui laisse alors se déposer une épaisse couche de sel.
La population récolte le sel de l'eau saturée restante L'apparition des nuages annonçant l'hivernage inquiète toujours ces populations car dès les premières pluies le sel disparaît pour de longs mois encore.
1- Indiquer les deux constituants de cette ‘’eau‘’ de mer.
2- Pourquoi le sel ne se dépose-t-il que pendant la saison sèche ?
3- Que font les premières pluies pour faire disparaître le sel ?
I. Mélanges et solutions
I.1 Procédons à quelques mélanges.
➭ eau + sel : dissolution du sel => mélange homogène = eau salée.
➭ lait + sucre : dissolution du sucre = > mélange homogène = lait sucré.
➭ eau + huile => mélange hétérogène : émulsion.
L'eau salée et le lait sucrée sont des mélanges homogènes : ce sont des solutions.
Le mélange eau + huile est un mélange hétérogène : ce n'est pas une solution.
I.2 Définition d'une solution.
Une solution est un mélange homogène.
N.B.
Les solutions sont souvent à l'état liquide mais on peut aussi parler de solutions solides (alliages) et de solutions gazeuses (l'air).
I.3 Composition d'une solution.
Une solution est constituée de deux parties :
➭ Le corps dissous appelé soluté : sel, sucre...
➭ Le corps qui dissout appelé solvant : eau, lait...
N.B.
Une solution aqueuse est une solution dont le solvant est l'eau.
II. La solubilité.
II.1 Aspect qualitatif.
Le polystyrène est insoluble dans l'eau mais soluble dans l'essence.
La solubilité d'un corps peut être considérée comme son aptitude à se dissoudre dans un autre.
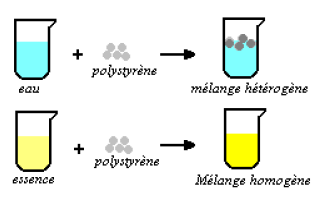
Exemple :
Les graisses sont solubles dans le tétrachlorure de carbone $CC_{14}.$
II.2 Aspect quantitatif.
Un soluté n'est pas indéfiniment soluble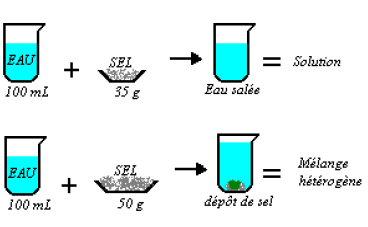 dans un solvant.
dans un solvant.
 dans un solvant.
dans un solvant.
La quantité maximale soluble de tout soluté est sa solubilité ; elle dépend de la température.
Exemple :
La solubilité du chlorure de sodium (sel de cuisine) est de $350\,g/L$ d'eau à $20°C.$
III. Qualités d'une solution.
III.1 Solution saturée.
Une solution est saturée quand le solvant ne peut plus dissoudre le soluté.
Tout rajout de soluté se traduit par un dépôt.
III.2 Solution non saturée.
Une solution est dite non saturée si le solvant peut encore dissoudre du soluté.
III.3 Solution concentrée.
Une solution concentrée est une solution plus ou moins proche de la solution saturée.
Pour mieux l'apprécier, il est nécessaire de connaître la quantité de soluté par rapport à celle du solvant.
On définit alors une grandeur caractéristique de toute solution : sa concentration $C.$
N.B.
On évalue la quantité :
➭ de soluté en grammes ou en moles
➭ de solvant en litres.
IV. La concentration d'une solution
IV.1 Concentration massique
La concentration massique $C$ d'une solution est la masse $m$ de soluté par volume $v$ de solution.
Elle est exprimée en $g/L=g.L^{-1}$
$$C = \dfrac{m}{v}$$
N.B.
La concentration molaire d'un soluté $A$ dans une solution donnée est notée : $[A]$
La concentration molaire d'une solution est aussi appelée sa molarité $M.$
Exemple :
Une solution molaire ou de molarité $1$ $M$ est une solution de concentration $1\ mol.L^{-1}$
$$1\,M = 1\,mol.L^{-1}$$
Application :
Enoncé
Trouver la concentration molaire de lasolution de soude obtenue en dissolvant $8\,g$ de cristaux d'hydroxyde de sodium $NaOH$ dans $200\,mL$ d'eau.
Solution :
La concentration molaire de la solution de soude est :
\begin{array} {lcl}
C_{NaOH}& =&\dfrac{n}{v}\\ \\
n_{NaOH}& = &\dfrac{m}{M}\\ \\
m_{NaOH}& = &8\ g
\end{array}
$M(NaOH) \ = \ M(Na) + M(O) + M(H)$
$M(NaOH) \ = 23 + 16 + 1 = 40 \ g/mol$
$n_{NaOH}=\dfrac{8}{40}=0,2\,mol$
$V = 200 \,mL= 200 \cdot 10^{-3}\,L = 0,2\,L$
$C_{NaOH}=\dfrac{0.2}{0.2}=1\,mol.L^{-1}$
Remarque :
On peut aussi déduire la concentration molaire (ou massique) de la concentration massique (ou molaire).
Concentration molaire $\ C_n = \dfrac{C_m}{M}$
Concentration massique $\ C_m = C_n.M$
V. Préparation d'une solution de concentration donnée
V.1 Par dissolution
Exemple pratique.
Dans un laboratoire, on veut obtenir $40\,mL$ d'eau salée de concentration $0.5\,mol/L$
a) $-\ $ Trouver les quantités respectives de soluté et de solvant à utiliser.
b) $-\ $ Indiquer le matériel et les produits nécessaires à cette opération.
c) $-\ $ Préciser la meilleure procédure
V.1.1 Les quantités respectives
$\bullet\ $ de solvant : quantité de solvant=volume de solution : $v=40\,mL$
On admet que la dissolution d'un corps dans un liquide ne modifie pas le volume de solution obtenue.
$\bullet\ $ de soluté : masse de soluté : $m=n\cdot M$ or $n=C\cdot v$ donc $m=C\cdot v\cdot M$
La masse de chlorure de sodium $NaCl$ est alors $m_{NaCl}=C\cdot v\cdot M$
$C_{NaCl}=0.5\,mol\cdot L^{-1}$
$V=40\,mL=4\cdot10^{-2}\,L$
$M(NaCl)=58.5\,g/mol$
$m_{NaCl}=0.5\times 4\cdot 10^{-2}\times 58.5=1.17\,g$
N.B.
La masse de soluté à prendre est égale au produit de la concentration molaire de la solution par le volume désiré que multiplie la masse molaire du soluté.
$m=C\cdot v\cdot M$
V.1.2 Le matériel et les produits
$1$ bêcher $40\,mL$ : pour contenir la solution.
$1$ balance : pour mesurer la masse de soluté.
$1$ éprouvette graduée : pour mesurer le volume de solvant.
$1$ agitateur : pour faciliter la dissolution du soluté.
L'eau $=$ le solvant
Le sel $NaCl=$ le soluté.
V.1.3 Procédure.
Dissoudre la masse de soluté mesurée dans un minimum de solvant et compléter au volume désiré en ajoutant du solvant.
V.2 Par dilution.
V.2.1 Définition
Diluer une solution c'est y ajouter du solvant :
on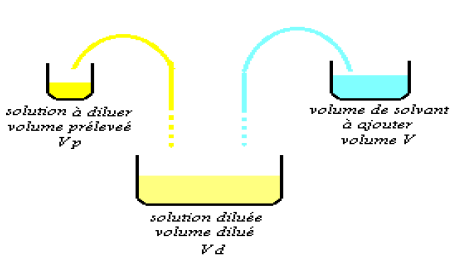 diminue alors sa concentration.
diminue alors sa concentration.
$C_p$ : concentration de la solution prélevée
$n_p$ : nombre de moles prélevées
$C_d$ : concentration de la solution diluée
$n_d$ :nombre de moles dans la solution diluée.
V.2.2 Principe de la dilution
Au cours d'une dilution, la quantité de soluté ne varie pas.
$n_p = n_d ⇔ C_pv_p= C_dv_d$
Source:
irempt.ucad.sn

Commentaires
Sadio DIOCOU (non vérifié)
sam, 12/11/2021 - 10:48
Permalien
Télécharger des exercices sur les lentilles minces
Khalisa Bâ (non vérifié)
dim, 01/16/2022 - 14:56
Permalien
Renforcement du niveau dans les matières scientifiques
mia (non vérifié)
sam, 09/06/2025 - 13:04
Permalien
permalien
Pages
Ajouter un commentaire