Mélanges et corps purs - 4e
Classe:
Quatrième
Activité 1 :
Eau limpide, Eau potable, mélanges
On dispose de béchers contenant :
1) de l'eau de robinet
2) de l'eau boueuse
3) de l'eau salée
4) de l'eau minérale
5) de l'eau de puits
a) Observer et décrire le contenu de chaque bécher.
b) Marquer d'une croix les cases qui permettent de caractériser les contenus par les mots limpide, potable, pur, mélange.
$$\begin{array}{|l|c|c|c|c|} \hline &\text{limpide}&\text{potable}&\text{pure}&\text{mélange}\\ \hline \text{Eau de robinet}& & & &\\ \hline \text{Eau boueuse}& & & &\\ \hline \text{Eau salée}& & & &\\ \hline \text{Eau de puits}& & & & \\ \hline \end{array}$$
Activité 2 :
Vaporisation d'une eau minérale
Verser $2\;cm^{3}$ d'eau minérale environ dans un tube à essai, puis chauffer jusqu'à l'évaporation totale.
Observer les parois du tube à essai et noter les constats

$L'évaporation\ de\ l'eau\ de\ mer\ dans\ les\ marais\ salants\ permet\ de\ recueillir\ des\ quantités\ énormes\ de\ sel$
$dans\ les\ régions\ de\ Kaolack\ et\ de\ Fatick$
I- Notion de mélange
I-1. Notion de mélange
Les eaux naturelles (l'eau boueuse, l'eau des fleuves, des océans, l'eau de pluie, celles des puits et l'eau minérale) contiennent en quantités plus ou moins importantes des substances étrangères.
Ce sont des mélanges.
Un mélange est composé de plusieurs constituants différents.
On distingue deux types de mélanges : des mélanges dont on ne peut pas distinguer les différents constituants et d'autres dont on peut distinguer les constituants.
I-2. Mélanges homogènes
L'eau salée contient du sel. Le jus de bissap contient du sucre et du bissap dissouts dans l'eau. Cependant on ne pas distinguer l'eau du sel :
l'eau salée est un mélange homogène.
Un mélange est dit homogène si on ne peut pas distinguer à l'œil nu ses différentes parties.
Exemple :
jus de bissap, eau sucrée, eau minérale, air$\ldots$

$Bras\ de\ mer\ :\ Le\ Saloum$
$Des\ quantités\ énormes\ de\ sel\ sont$
$dissoutes\ dans\ l'eau\ de\ mer$
I- 3. Mélanges hétérogènes
Un mélange est dit hétérogène si on peut distinguer à l'œil nu ses différentes parties.
Exemples :
eau de ruissellement (eau boueuse), eau+huile, sable+ciment$\ldots$
II- Méthodes de séparation des mélanges
II- 1. Cas des mélanges hétérogènes
Dans une eau boueuse on distingue des particules solides en suspension dans l'eau.
On peut obtenir une eau limpide à partir de cette eau boueuse.
Il existe plusieurs méthodes physiques pour séparer les différents constituants du mélange hétérogène
II- 1.1. La décantation
Introduisons dans une ampoule à décanter un mélange eau plus huile.
Agitons puis laissons reposer le mélange.
Au bout d'un certain temps on observe une séparation entre l'huile et l'eau.
L'huile étant plus légère que l'eau, flotte au dessus de celle-ci.
On dit qu'on a décanté le mélange hétérogène.
La décantation consiste à laisser reposer le mélange.
Il se produit une séparation entre les différentes phases du mélange.
Remarque :
laissons décanter une eau trouble contenant des particules solides en suspension.
Au bout d'un certain temps on remarque que les particules solides se déposent au fond du récipient.
$\centerdot$ On complète la décantation par un transvasement pour récupérer la partie liquide (voir schéma).
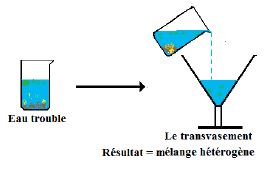
$\centerdot$ Au laboratoire, on utilise une ampoule à décanter pour séparer les constituants d'un mélange de liquides non miscibles (exemples mélange eau-huile)
II-1.2. La filtration
La filtration est un procédé qui permet de séparer les différents constituants d'un mélange hétérogène solide-liquide.
Pour cela on verse le mélange hétérogène à travers un papier filtre.
Le liquide qui traverse le filtre est appelé filtrat ; c'est un mélange homogène.
Les particules solides sont retenues par le papier filtre (voir schéma).
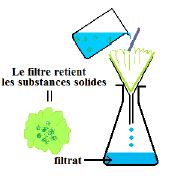
II- 2. Séparation des constituants des mélanges homogènes
On ne peut séparer les constituants d'un mélange homogène ni par la décantation, ni par la filtration.
D'autres procédés sont utilisés.
Ils sont basés sur les propriétés physiques telles que la température d'ébullition et la température de congélation.
II-2.1. La distillation
Dans un ballon on chauffe de l'eau salée.
Au cours du chauffage, la température augmente et garde une valeur constante égale à $100^{\circ}$C pendant l'ébullition.
La vapeur qui se dégage est liquéfiée dans un réfrigérant appelé aussi condenseur.
Le liquide recueilli dans le bécher est appelé distillat : c'est de l'eau pure.
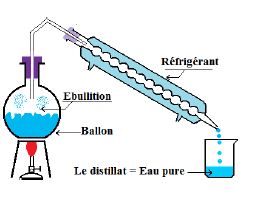
Distiller un liquide, c'est le vaporiser puis le liquéfier. La distillation permet de séparer les différents constituants d'un mélange homogène.
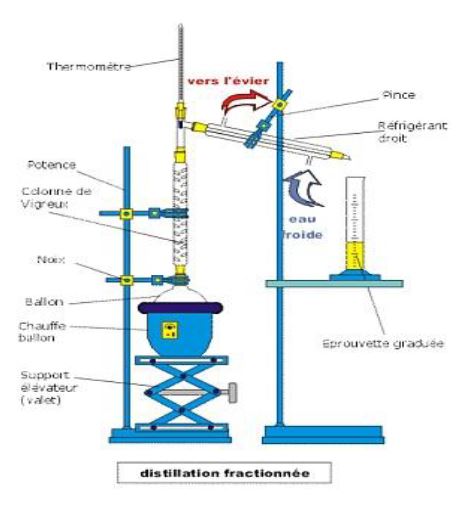
II-2.2. Autres méthodes de séparations
Il existe d'autres méthodes de séparation parmi lesquelles on peut citer :
$\centerdot$ Pour les mélanges solide-solide, on a :
le triage, le vannage, la ventilation, le tamisage, le criblage, la centrifugation$\ldots$
$\centerdot$ Pour les liquides : distillation fractionnée, congélation fractionnée,
Applications
La distillation fractionnée du pétrole ou des gaz naturels est effectuée par les sociétés de raffinage.
En chauffant le pétrole brut, à différents étages qui correspondent à des températures différentes, on récupère divers produits dont l'essence, le gasoil, le fuel, le kérosène, le mazout, le goudron.
II-2.3. Propriétés physiques des corps purs
a) Les constantes physiques d'un corps pur
Durant l'ébullition, la température de la vapeur d'eau reste constante à $100^{\circ}$C.
Cette température correspond à la température d'ébullition de l'eau ; c'est une constante physique pour l'eau.
Il existe d'autres constantes physiques pour l'eau parmi lesquelles on peut citer :
la température de fusion, la température d'ébullition la masse volumique$\ldots$,
Le tableau ci-dessous donne quelques valeurs des constantes physiques de l'eau
$$\begin{array}{|c|c|c|} \hline \text{Température d'ébullition}&\text{Température de fusion}&\text{Masse volumique}\\ \hline 100^{\circ}C&0^{\circ}C&1000\;kg\cdot m^{-3}\\ \hline \end{array}$$
Tout corps pur est caractérisé par ses constantes physiques.
Exemples :
Valeurs des constantes physiques de quelques corps purs
$$\begin{array}{|c|c|c|c|} \hline &\text{Aluminium}&\text{éthanol}&\text{eau}\\ \hline \text{Température}&2518.9&78&100\\ \text{d'ébullition}(^{\circ}C)& & &\\ \hline\text{Température de}&660&-117&0\\ \text{congélation}(^{\circ}C)& & &\\ \hline \text{Masse volumique}&2700&810&1000\\ \left(kg/m^{3}\right)& & &\\ \hline \end{array}$$
b) Critères de pureté
Pour vérifier la pureté d'un corps pur, on mesure ses constantes physiques.
On compare les résultats avec les valeurs données dans les tables des constantes physiques.
III- Autres exemples de mélanges
III- 1. Un mélange gazeux : l'air
L'air qui nous entoure nous permet de respirer et de faire la combustion de plusieurs corps, en particulier pour la cuisson des aliments que nous mangeons.
III- 1.1. Expérience
Une bougie allumée est plantée dans une cuve contenant de l'eau, puis coiffée d'une éprouvette graduée. L'éprouvette est remplie d'air.
Au bout de quelques instants
$-\ $ La bougie s'éteint
$-\ $ L'eau de la cuve remonte à 1/5 du volume de l'éprouvette.
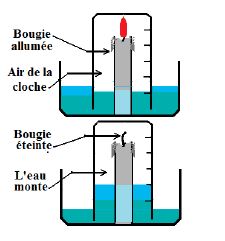
La bougie est éteinte du fait que le dioxygène, constituant de l'air qui entretient la combustion est totalement consommée.
L'eau de la cuve est remontée dans l'éprouvette pour remplacer le dioxygène consommé.
III- 1.2. Conclusion
L'air est constitué de 1/5 de dioxygène et 4/5 de diazote.
D'autres expériences permettent de montrer que l'air sec est un mélange gazeux dont la composition volumique est :
$\centerdot\ 78\%$ de diazote
$\centerdot\ 21\%$ de dioxygène
$\centerdot\ 1\%$ de gaz rares
III- 2. mélanges de solides
D'autres procédés physiques de séparation sont utilisés lorsque tous les constituants du mélange sont des solides.
$-\ $ triage mécanique : mélange sable+grain de sel
$-\ $ magnétique : fer+sable
IV- Analyse et synthèse de l'eau
IV- 1. Analyse de l'eau
IV- 1.1. Analyse de l'eau pure
a) Expérience
On réalise le montage ci-contre
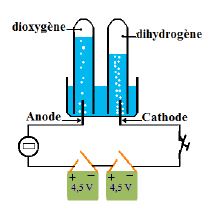
Le circuit comprend :
$\centerdot$ deux piles de $4.5\;V$ montées en série
$\centerdot$ une lampe à incandescence
$\centerdot$ une cuve à électrolyseur contenant de l'eau pure et deux tubes essais remplis d'eau pure et renversés sur les électrodes.
b) Observations
La lampe reste éteinte car l'eau pure ne conduit pratiquement pas le courant électrique.
On ajoute une solution de soude dans l'électrolyseur, la lampe s'allume et on constate que :
des bulles de gaz se dégagent au niveau des électrodes.
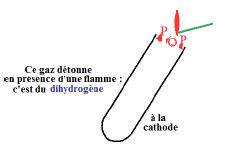
Le gaz qui se dégage à l'électrode reliée à la borne négative (cathode) détonne en présence d'une flamme :
c'est du dihydrogène (voir schéma).
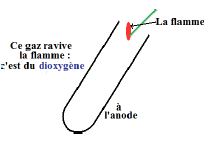
Le gaz qui se dégage à l'électrode reliée à la borne positive (anode) rallume une bûchette en incandescence :
c'est du dioxygène (voir schéma).
Le volume de dihydrogène est le double de celui de dioxygène.
On peut expérimentalement vérifier que la quantité de soude initialement ajoutée se retrouve intégralement à la fin de l'électrolyse.
Par contre la quantité d'eau a diminué.
c) Interprétation des résultats
Au passage du courant électrique l'eau s'est décomposée pour donner du dioxygène et du dihydrogène qui sont d'autres corps purs.
La décomposition de l'eau par le courant électrique est appelé électrolyse de l'eau. Ce procédé est une transformation chimique.
d) Conclusion
L'eau est un corps pur qu'on peut décomposer en d'autres corps :
l'eau est un corps pur composé.
Par contre le dihydrogène et le dioxygène ne peuvent pas être décomposés en d'autres corps purs :
ce sont des corps purs simples.
Définitions
Un corps pur simple est un corps pur qu'on ne peut pas décomposer en d'autres corps purs.
Exemples :
dihydrogène, dioxygène, cuivre, zinc, plomb, soufre...
Un corps pur composé est un corps qu'on peut décomposer en plusieurs corps purs simples
Exemples :
eau pure, dioxyde de carbone, oxyde d'aluminium...
IV- 2. Synthèse de l'eau pure
IV- 2.1. Synthèse qualitative : Expérience de CAVENDISH
a) Protocole expérimentale

Un courant de dihydrogène est produit par l'action d'une solution d'acide sulfurique sur de la grenaille de zinc.
A l'aide d'une flamme on effectue la combustion du dihydrogène dans le dioxygène de l'air contenu dans une éprouvette.
b) Observation
Une buée de vapeur d'eau se forme sur la paroi de l'éprouvette
c) Interprétation
Le dihydrogène brûle dans le dioxygène pour donner de l'eau.
La formation de l'eau à partir de dihydrogène et de dioxygène est appelée synthèse de l'eau.
IV- 2.2. Synthèse quantitative : Synthèse à l'eudiomètre
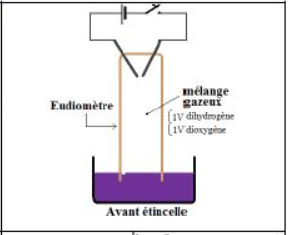
On introduit dans un eudiomètre, renversé dans une cuve contenant du mercure, un mélange gazeux constitué de $1$ volume de dihydrogène et $1$ volume de dioxygène.
Une étincelle électrique déclenche la combustion du mélange.
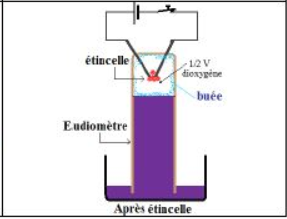
Après le passage de l'étincelle électrique, le mercure remonte dans l'eudiomètre et il se forme une buée sur la paroi intérieur : c'est de la vapeur d'eau.
Il reste dans l'eudiomètre un volume $V/2$ de gaz.
Ce gaz peut rallumer une brindille en incandescence : c'est du dioxygène
NB :
Un volume $V$ de dihydrogène s'est combiné avec un volume $V/2$ de dioxygène pour donner de l'eau.
Conclusion
Dans l'eau on ne trouve donc que l'oxygène et le l'hydrogène.
L'eau est un corps pur composé.
L'essentiel du cours
Mélanges
Un mélange est un ensemble composé de plusieurs constituants différents.
Mélanges hétérogènes
Des constituants du mélange peuvent être distingués à l'œil nu.
Mélanges homogènes
Les constituants du mélange homogène ne peuvent pas être distingués à l'œil nu.
Les corps étrangers sont dissous.
On a une solution.
Méthodes de séparation des mélanges
$\centerdot$ la décantation permet de séparer un mélange hétérogène liquide-liquide non miscibles en ses différents composants.
Pour cela on utilise une ampoule à décanter.
Si on a un mélange solide-liquide, les particules solides se déposent au fond du récipient.
$\centerdot$ la filtration permet de séparer les particules solides et le filtrat qui est un mélange homogène
$\centerdot$ La distillation permet de séparer les différents constituants d'un mélange homogène.
Le distillat est un corps pur.
Composition de l'air
L'air sec est un mélange gazeux contenant $78\%$ de diazote, $21\%$ de dioxygène et $1\%$ de gaz rares
Corps purs
Un corps pur est une substance dont les critères de pureté sont déterminés.
Ces valeurs sont des constantes physiques (température de fusion, température d'ébullition, masse volumique...)
Corps purs simple
Un corps pur simple est un corps pur que l'on ne peut pas décomposer en d'autres corps purs.
Corps purs composé
Un corps pur composé est un corps pur qui peut être décomposé pour donner d'autres corps purs
Source:
irempt.ucad.sn

Commentaires
Abou deh (non vérifié)
mar, 10/22/2019 - 14:47
Permalien
Je veux apprendre pour mieux apprendre
Yacine (non vérifié)
jeu, 12/17/2020 - 18:43
Permalien
Apprendre
Maguette (non vérifié)
jeu, 01/14/2021 - 23:22
Permalien
Pc
Maguette (non vérifié)
jeu, 01/14/2021 - 23:26
Permalien
Pc
Daro (non vérifié)
mar, 11/28/2023 - 16:48
Permalien
Apprendre
Fatma lo (non vérifié)
ven, 11/15/2024 - 20:21
Permalien
Pour mieux comprendre
Thiam (non vérifié)
dim, 12/20/2020 - 18:39
Permalien
Tivaouane
Mohamed derwich... (non vérifié)
jeu, 12/24/2020 - 10:51
Permalien
Etudier
Aminata samb (non vérifié)
dim, 01/03/2021 - 19:34
Permalien
Est de étudier
Aminata samb (non vérifié)
dim, 01/03/2021 - 19:34
Permalien
Est de étudier
OULIMATA DIEME (non vérifié)
lun, 01/18/2021 - 20:48
Permalien
MON OBJECTIF EST DE ETUDIERET DE REUSSIR POUR AIDER MES PARENTS
Anonyme (non vérifié)
jeu, 12/14/2023 - 21:01
Permalien
♥️♥️♥️
Ufhk (non vérifié)
sam, 11/29/2025 - 21:21
Permalien
Ok
OULIMATA DIEME (non vérifié)
lun, 01/18/2021 - 20:51
Permalien
MON OBJECTIF EST DE ETUDIERET DE REUSSIR POUR AIDER MES PARENTS
OULIMATA DIEME (non vérifié)
lun, 01/18/2021 - 20:51
Permalien
MON OBJECTIF EST DE ETUDIERET DE REUSSIR POUR AIDER MES PARENTS
Matou diallo (non vérifié)
lun, 01/18/2021 - 22:54
Permalien
Math
Matou diallo (non vérifié)
lun, 01/18/2021 - 23:12
Permalien
Anglais
Matou diallo (non vérifié)
lun, 01/18/2021 - 22:54
Permalien
Math
moustapha ba (non vérifié)
mer, 02/17/2021 - 15:08
Permalien
mon objectif est de etudier
Khadidiatou Camara (non vérifié)
mer, 03/24/2021 - 23:12
Permalien
Réussir
Kiné nguenene (non vérifié)
lun, 01/24/2022 - 20:08
Permalien
Étudié
Nguile (non vérifié)
lun, 03/14/2022 - 19:59
Permalien
Pc
YAYE MARIE (non vérifié)
ven, 02/03/2023 - 22:22
Permalien
de rendre fière à mes parents
Kilian (non vérifié)
mer, 12/27/2023 - 12:49
Permalien
Commence par savoir bien
Mbayr (non vérifié)
ven, 11/08/2019 - 23:23
Permalien
PC
Papa gora (non vérifié)
mer, 11/13/2019 - 20:40
Permalien
Apprendre
MARONE SARL (non vérifié)
jeu, 11/21/2019 - 22:07
Permalien
apprendre mieux et comprendre mieux les pc
YAYE MARIE (non vérifié)
ven, 02/03/2023 - 22:28
Permalien
c'est de comprendre
Niang (non vérifié)
ven, 11/22/2019 - 01:06
Permalien
Très intéressant mais il
fdini
ven, 11/22/2019 - 20:25
Permalien
Encore merci NIANG, sinon on
Encore merci NIANG, sinon on y est ; et bientôt on fera le complet sur les maths 5e
khadim mbaye (non vérifié)
ven, 11/22/2019 - 02:03
Permalien
remerciements
Khady (non vérifié)
lun, 12/16/2019 - 14:44
Permalien
Seul le travails paye il faux
Anonyme (non vérifié)
dim, 01/19/2020 - 18:21
Permalien
Merci
Dior (non vérifié)
lun, 01/27/2020 - 19:50
Permalien
Ok
Moulaye Couma (non vérifié)
ven, 03/27/2020 - 00:45
Permalien
Trop bon
Mamadou samba ramos (non vérifié)
mar, 06/30/2020 - 15:59
Permalien
PC apprendre pour mieux
Anonyme (non vérifié)
lun, 10/12/2020 - 00:55
Permalien
cool
Badji (non vérifié)
jeu, 11/26/2020 - 20:47
Permalien
Merci beaucoup pour ces
Badji (non vérifié)
jeu, 11/26/2020 - 20:47
Permalien
Merci beaucoup pour ces
rosalie (non vérifié)
jeu, 12/10/2020 - 21:06
Permalien
comprendre les lessons de pc
Ouly Diop (non vérifié)
ven, 12/18/2020 - 23:57
Permalien
Apprend pour réussit
Anonyme (non vérifié)
sam, 01/16/2021 - 14:58
Permalien
Je veux le devoir n2
Fatou Ndiaye (non vérifié)
dim, 01/17/2021 - 22:50
Permalien
Remerciement
Alassane diame sarr (non vérifié)
jeu, 01/21/2021 - 02:19
Permalien
Être la meilleure en pc
Alassane diame sarr (non vérifié)
jeu, 01/21/2021 - 02:19
Permalien
Être la meilleure en pc
Khady Seck (non vérifié)
sam, 04/09/2022 - 13:32
Permalien
Etre la meilleur de tous les matiers
Mamadou ba (non vérifié)
mar, 01/26/2021 - 00:02
Permalien
Avoir des exercices
fatou ndiaye (non vérifié)
mar, 03/16/2021 - 20:51
Permalien
Apprendre pour mieux
fatou ndiaye (non vérifié)
mar, 03/16/2021 - 20:56
Permalien
seule le travail qui conte l
fatou ndiaye (non vérifié)
mar, 03/16/2021 - 20:56
Permalien
seule le travail qui conte l
Pages
Ajouter un commentaire