Classification qualitative des couples oxydant - réducteur ion métalique/métal - 1er s
Classe:
Première
I. Classement de deux couples
1. Classement relatif des couples $Cu^{2+}/Cu$ et $Zn^{2+}/Zn$
1.1 action des ions $Zn^{2+}$ sur le métal cuivre $Cu$
$\bullet\ $ Expérience
Plongeons une lame cuivre dans une solution de sulfate de zinc $ZnSO_{4}$ initialement incolore $(ZnSO_{4}\ \rightarrow\ Zn^{2+}\ +\ SO_{4}^{2-}).$
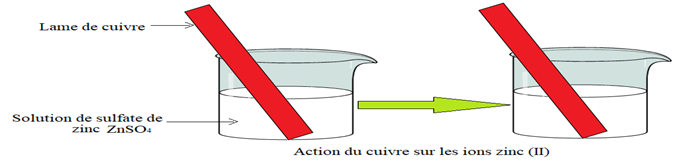
$\bullet\ $ Observation
Il ne se produit aucune réaction quelle que soit la durée de l'expérience.
$\bullet\ $ Interprétation
Le cuivre métallique $C_{u}$ ne réagit donc pas à priori avec les ions $Zn^{2+}$
1.2 Action des ions $Cu^{2+}$ sur le métal zinc $Zn$
$\bullet\ $ expérience
Plongeons une lame de zinc dans une solution de sulfate de cuivre $C_{u}SO_{4}$ initialement incolore
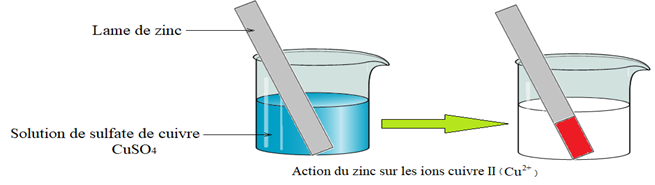
$\bullet $ Observation
On constate au bout de quelques minutes :
$-\ $ que la solution se décolore : il y a disparition progressive des ions $Cu^{2+}$
$-\ $ qu'il se forme sur la partie immergée de la lame de zinc un dépôt de cuivre rouge : les ions $Cu^{2+}$ sont donc passés à l'état de cuivre métallique
$\bullet\ $ Interprétation
Au cours de la réaction il y a eu transfert des électrons du zinc métallique vers les ions cuivre $(II)$ selon l'équation :
$$Zn\ +\ Cu^{2+}\ \rightarrow\ Zn^{2+}\ +\ Cu$$
1.3 Action des ions $Zn^{2+}$ sur les ions $Cu^{2+}$
Mélangeons dans un bécher une solution de sulfate de zinc et une solution de sulfate de cuivre.
$\bullet\ $ Observation
On n'observe aucune réaction, même au bout d'un temps très long
$\bullet\ $ Interprétation
Les ions $Cu^{2+}$ ne réagissent donc pas avec les ions $Zn^{2+}$
1.4 Sens de la réaction spontanée entre deux couples
La seule réaction spontanée entre les espèces chimiques qui constituent les couples $Cu^{2+}/Cu$ et $Zn^{2+}/Zn$ a lieu entre $Zn$ et $Cu^{2+}.$
Il s'agit d'une réaction d'oxydoréduction lors de cette réaction :
$Zn$ joue le rôle réduction d'oxydoréduction lors de cette réaction : $Zn$ joue le rôle réduction et $Cu^{2+}$ joue le rôle d'oxydant :
$\bullet\ $ le pouvoir oxydant de $Cu^{2+}$ est supérieur à celui de $Zn^{2+}$
$\bullet\ $ le pouvoir réduction de $Zn$ est supérieur à celui de $Cu$
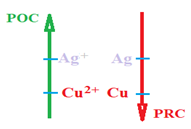
Les deux couples sont écrites comme suit
$POC$ (Pouvoir oxydant Croissant)
$PRC$ (Pouvoir Réducteur Croissant)
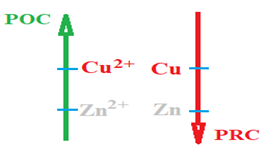
Pour chaque couple la forme oxydante est écrite à gauche, la forme réductrice à droite.
Le couple dont l'oxydant est le plus fort est écrit au-dessus du couple dont l'oxydant est le plus faible.
$-\ $ Équation-bilan
2. Classement relatif des couples $Ag^{+}/Ag$ et $Cu^{2+}/Cu$
2.1 Action des ions $Cu^{2+}$ sur le fil d'argent $Ag$
$\bullet\ $ Expérience
Plongeons un fil d'argent métallique dans une solution de solution de sulfate de cuivre $II$ $(CuSO_{4})$
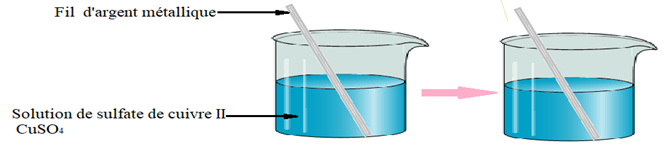
$\bullet\ $ Observation
On n'observe aucune réaction, même au bout d'un temps très long.
$\bullet\ $ Interprétation
Les ions $Cu^{2+}$ ne réagissent donc pas le métal argent.
2.2 Action des ions $Ag^{+}$ sur le métal cuivre $Cu$
$\bullet\ $ Expérience
Plongeons des copeaux métalliques de cuivre dans une solution de solution de de nitrate d'argent $(AgNO_{3})$

$\bullet\ $ Observation
$\bullet\ $ La solution se colore progressivement en bleu, caractéristique de la présence d'ions $Cu^{2+}$ dans la solution.
$\bullet\ $ Sur le cuivre, on observe un dépôt de métal argent.
$\bullet\ $ Interprétation
Les ions $Ag^{+}$ r&agissant avec le métal cuivre selon l'équation-bilan :
$$Cu\ +\ 2Ag^{+}\ \rightarrow\ Cu^{2+}\ +\ 2Ag$$
$Cu$ a joué un rôle de réduction, $Ag^{+}$ a joué le rôle d'oxydant.
2.3 Conclusion
Le cuivre est plus réduction que l'argent.
L'ion $Ag^{+}$ est plus oxydant que l'ion $Cu^{2+}$
3. Généralisation
Des expériences qualitatives assez précises faites dans des laboratoires spécialisés ont permis une classification électrochimique des différents métaux
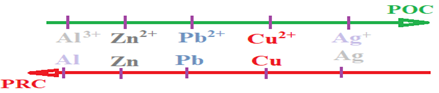
4. Place du couple $H_{3}O^{+}/H_{2}$ dans la classification
Dans des tubes à essais plaçons de la poudre, de la tournure ou des grains de métaux suivant :
$al$, $Zn$, $Fe$, $pb$, $Cu.$
Ajoutons dans chaque tube quelques gouttes de solution d'acide chlorhydrique.
Nous constatons que l'acide réagit avec l'aluminium, le zinc, le fer, le plomb, avec chaque fois dégagement de dihydrogène.
Par contre, il ne réagit pas avec cuivre.
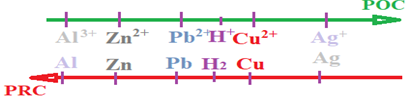
Ces expériences nous permettrons de conclure que l'aluminium, le zinc, le fer, le plomb sont plus réducteurs que l'hydrogène, mais que l'hydrogène est plus réducteur que le cuivre et l'argent.
Le couple $H_{3}O^{+}/H_{2}$ est donc placé dans la classification électrochimique entre les couples $Cu^{2+}/Cu$ et $Pb^{2+}/Pb.$
II. Tableau de classification qualitative des couples ion métallique/métal.
1. Principe de la classification électrochimique
Au cours d'une réaction naturelle, l'oxydant le plus fort $Ox_{1}$ réagit sur le rédacteur le plus fort $Red_{2}$ pour donner le réducteur le plus faible $Red_{1}$ et l'oxydant le plus faible $Ox_{2}.$
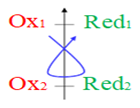
Cette règle est connue sous le nom de la règle $" gamma "$ $\gamma$
$n_{2}\left(Ox_{1}\ +\ n_{1}e^{-}\ \rightarrow\ Red_{1}\right)$
$$\Rightarrow\;n_{2}Ox_{1}\ +\ n_{1}\,Red_{2}\ \rightarrow\ n_{2}\,Red_{1}\ +\ n_{1}Ox_{2}$$
$n_{1}\left(Red_{2}\ \rightarrow\ Ox_{2}\ +\ n_{2}e^{-}\right)$
2. Présentation du tableau de la classification électrochimique des couples

3. L'intérêt de la classification
La classification des couples oxydant/réducteur permet de prévoir la seule réaction qui se produit naturellement entre deux couples donnés.
Remarques :
$-\ $ Plus fort est un oxydant, plus faible est son réducteur conjugué.
$-\ $ Un cation métallique oxyde les métaux conjugués des cations métalliques situés au-dessous de lui.
$-\ $ Un métal réduit les cations des métaux placés au-dessus de lui.
$-\ $ Un réducteur est d'autant plus fort qu'il cède facilement des électrons.
$-\ $ Un oxydant est d'autant plus fort qu'il accepte facilement des électrons.

Commentaires
Martiala BADOU (non vérifié)
jeu, 06/10/2021 - 14:22
Permalien
Intégrer le groupe
Anonyme (non vérifié)
lun, 02/26/2024 - 15:54
Permalien
C'est compréhensive les
Doumbia Sékou (non vérifié)
lun, 02/26/2024 - 16:01
Permalien
Les informations sont
Anonyme (non vérifié)
ven, 05/31/2024 - 12:05
Permalien
Blabla
Maguette (non vérifié)
mer, 05/14/2025 - 18:32
Permalien
Merci pour tout
Ajouter un commentaire