Classification quantitative des couples oxydant - réducteur ion métalique/métal - 1er s
Classe:
Première
I. Pile
1. Etude d'un exemple : La pile Daniell
1.1 Constitution et réalisation
La pile Daniell est formée de demi-piles :
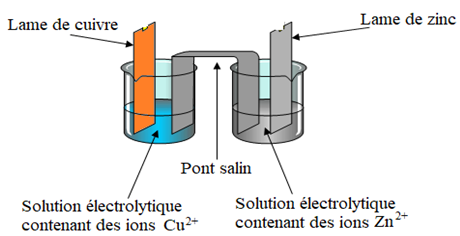
$-\ $ La demi-pile $Cu^{2+}/Cu$ est constituée par un récipient renfermant une solution de sulfate de cuivre $(II)$ à $0.10\,mol\cdot L^{-1}$ dans laquelle plonge une électrode de cuivre.
$-\ $ La demi-pile $Zn^{2+}/Zn$ est constituée par un récipient renfermant une solution de sulfate de zinc $(II)$ à $0.\,10mol\cdot L^{-1}$ dans laquelle plonge une +électrode de zinc.
Les deux solutions sont réunies par un pont salin.
Ce pont peut être réalisé par une lanquette de papier filtre imbibée d'une solution concentrée de nitrate de sodium $NaNO_{3}.$
Il peut aussi être réalisé par un tube en $U$ contenant une solution de chlorure (ou nitrate) de potassium.
1.2 Polarité et caractéristiques
1.2.1 Polarité
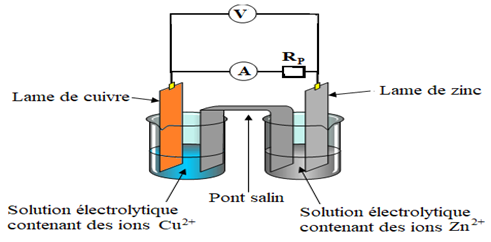
$\bullet\ $ L'ampèremètre (ou le voltmètre) branché aux deux électrodes indique la circulation du courant électrique (ou une tension), le branchement et le sens de déviation de l'aiguille montre que l'électrode de cuivre constitue la borne positive de la pile et l'électrode de zinc la borne négative.
1.2.2 Fonctionnement
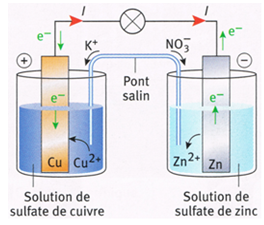
Lorsque la pile débite, les porteurs de charges sont de deux sortes :
$\bullet\ $ Dans le circuit extérieur à la pile, ce sont des électrons qui circulent dans les fils et les conducteurs de la borne négative $(-)$ vers la borne positive $(+)$
$\bullet\ $ Dans le pont salin et dans les solutions, ce sont des ions qui se déplacent.
Le mouvement des ions dans le pont salin permet aux solutions de rester électriquement neutres.
Dans la demi-pile où se forment des cations (électrode négative) le pont salin apportent des anions et dans la demi-pile où les cations sont consommés (électrode positive) le pont salin apporte des cations.
Le pont salin assure donc la neutralité électrique et la fermeture du circuit
$\bullet\ $ Si on relie les électrodes de la pile par un circuit comprenant en série, une résistance de protection $R_{p}$ et un ampèremètre (ou un voltmètre), celui-ci indique le passage d'un courant (ou d'une tension), la pile débite.
C'est un générateur.
$\bullet\ $ L'électrode de zinc est le pôle négatif $(-)$ constitue l'anode.
Elle donne des électrons $e^{-}$ au circuit :
$$Zn\ \rightarrow\ Zn^{2++}2e^{-}$$
Il y a oxydation du métal zinc $Zn$ en ions zinc $(II)$ $Zn^{2+}$
$\bullet\ $ L'électrode de cuivre est le pôle positif $(+)$ est la cathode.
Elle capte les électrons cédés :
$$Cu^{2+}\ +\ 2e^{-}\ \rightarrow\ Cu$$
Il y a réduction des ions cuivre $(II)$ $Cu^{2+}$ en métal cuivre $Cu$
Le bilan chimique s'écrit :
$$Zn\ +\ Cu^{2+}\ \rightarrow\ Zn^{2+}\ +\ Cu$$
Remarque :
La réaction d'oxydoréduction entre les ions cuivre $(II)$ $Cu^{2+}$ et le métal zinc $Zn$ s'accompagne d'une production de chaleur.
Elle est donc exothermique.
La pile transforme donc une partie de l'énergie chimique en énergie thermique ou calorifique
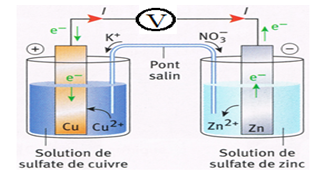
1.3 Notation conventionnelle
La pile Daniell est représentée par l'écriture :
$$(-)Zn/Zn^{2+}//Cu^{2+}/Cu^{+}(+)$$
La borne négative est placée à gauche, la borne positive à droite, la double barre symbolise le pont, les barres simples marquent la séparation électrique métallique-solution pour chaque demi-pile.
1.2.1 Force électromotrice
Un voltmètre de très grande résistance indique à l'absence du courant
Un voltmètre de très grande résistance indique à l'absence du courant que la force électromotrice $f.é.m.$ de la pile Daniell $(d.d.p$ : la différence de potentielle$)$ entre l'électrode de cuivre et l'électrode de zinc est approximativement :
$$E=U_{Cu/Zn}=V_{Cu}-V_{Zn}=1.1\,V$$
$V_{Cu}$ est le potentiel de l'électrode de cuivre
2. Généralisation
Une pile est composée de :
$-\ $ Deux compartiments séparés appelés demi-piles contenant chacun une électrode (matériau conducteur, en général des métaux ou du carbone) et une solution électrolytique
$-\ $ Un pont salin ou une paroi poreuse reliant les $2$ demi-piles.
Chaque demi-pile est composée des espèces d'un couple oxydant/réducteur.
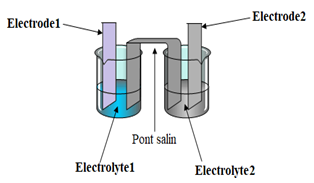
Le pont salin est constitué d'un tube en $U$ creux rempli d'une solution gélifiée conductrice concentrée (ou d'une simple feuille de papier imbibé d'une solution conductrice).
Les ions présents dans le pont salin $($en général $K^{+}$ et $Cl^{-}$ ou $NO_{3}^{-})$ n'interviennent pas dans la réaction d'oxydoréduction.
Leur rôle est de permettre le passage du courant dans la pile et d'assurer la neutralité électrique des solutions
Remarque :
Souvent le couple est formé d'un ion métallique $Mn^{+}$ et du métal $M.$
Si l'oxydant est un cation métallique $M^{n+}$ et le réducteur un métal $M$, la demi-pile associée à ce couple sera constituée d'une électrode de ce métal $M$ plongeant dans une solution aqueuse du cation $M^{n+}$
Exemple :
le couple $Cu^{2+}/Cu$
Dans certains cas, l'électrode est constituée d'un matériau conducteur inerte.
Si l'oxydant et le réducteur sont tous deux des ions en solution, la demi-pile associée à ce couple sera constituée d'un mélange de deux solutions en égales concentrations molaires des deux espèces, dans lequel plonge une électrode inattaquable $($désigné par $M)$, en platine ou en graphite.
Exemple :
le couple $Pt(H_{2})/H^{+}$
$\bullet\ $ Réactions aux électrodes et équation-bilan
Les couples mis en jeu sont : $Ox_{1}/Red_{1}$ et $Ox_{2}/Red_{2}$
A la borne négative $(-)$ ou anode, il y a oxydation du réducteur 1 :
$$a\,Red_{1}\ \rightarrow\ b\,Ox_{1}\ +\ n_{1}e^{-}$$
A la borne positive $(+)$ ou cathode, il y a réduction de l'oxydant 2 :
$$c\,Ox_{2}\ +\ n_{2}e^{-}\ \rightarrow\ d\,Red_{2}$$
Réactions aux électrodes :
$(a\,Red_{1}\ \rightarrow\ b\,Ox_{1}\ +\ n_{1}e^{-})\times n_{2}$
$(c\,Ox_{2}\ +\ n_{2}e^{-}\ \rightarrow\ d\,Red_{2})\times n_{1}$
Bilan :
$a\cdot n_{2}Red_{1}\ +\ c\cdot n_{1}Ox_{2}\ \rightarrow\ b\cdot n_{2}Ox_{1}\ +\ d\cdot n_{1}Red_{2}$
$\bullet\ $ Notation conventionnelle
La représentation formelle de la pile est obtenue en plaçant :
$-\ $ La borne négative ou 'électrode négative (anode) représentée à gauche et la borne positive ou l'électrode positive (cathode) représentée à droite.
$-\ $ Un trait vertical représentant une jonction entre deux phases (ici, métal-liquide).
$-\ $ Un double trait vertical représentant une jonction entre deux demi-piles
La pile est formellement représentée par : $(-)M/Mn^{+}//M^{p+}/M(+)$
$-\ $ La quantité de charge électrique $Q$ fourni par la pile
La quantité de charge électrique $Q$ fourni par la pile pendant un intervalle de temps $\Delta\,t$ qui débitait un courant $I$ vaut :
$$Q=I\Delta\,t=n_{e^{-}}F$$
$n_{e^{-}}$ est le nombre de moles d'électrons échangés et $F$ est le nombre de Faraday qui représente la charge d'une mole d'électrons, $F=96.5\cdot10^{3}C\cdot mol^{-1}.$
$\bullet\ $ Force électromotrice
La force électromotrice $f.é.m.$ de la pile $(d.d.p$ : la différence de potentielle$)$ entre les électrodes de métal est :
$$E=U_{M/M}=V_{M}-V_{M}$$
$F.é.m.$ de quelques métaux formants des piles
$-\ $ Entre $Ag$ et $Zn$ : $E=V_{Ag}-V_{Zn}=1.55\,V$
$-\ $ Entre $Ag$ et $Fe$ : $E=V_{Ag}-V_{Fe}=1.25\,V$
$-\ $ Entre $Fe$ et $Zn$ : $E=V_{Fe}-V_{Zn}=0.30\,V$
II. Demi-pile à hydrogène
1. Constitution de la demi-pile
Une électrode de platine platiné plonge dans une solution aqueuse d'acide chlorhydrique.
Le platine platiné est du platine recouvert d'une couche de platine très finement divisé appelé noir de platine à cause de son aspect et qui augmente et améliore le contact entre liquide, gaz et solide
Du dihydrogène gazeux "barbote" dans la solution d'acide chlorhydrique et les bulles de dihydrogène viennent au contact de l'électrode de platine platiné sur laquelle elles peuvent se fixer
Il y a contact entre le métal platine, les molécules de dihydrogène $H_{2}$ et les ions hydronium $H_{3}O^{+}$
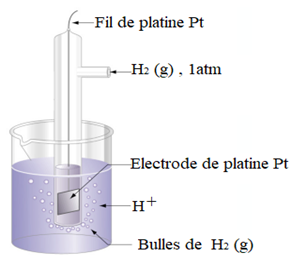
Ce dispositif constitue la demi-pile à hydrogène.
Remarque :
On utilise le platine car c'est un métal qui n'est pas attaqué par les solutions acides (c'est l'un des moins fort réducteur) et qui permet les échanges électroniques à sa surface.
Au niveau de l'électrode, on peut avoir la réaction :
$$2H_{3}O^{+}\ +\ 2e\ \rightarrow\ H_{2}\ +\ 2H_{2}O$$
2. Place du couple $H_{3}O^{+}/H_{2}$ dans l'échelle de classification électrochimique
Soit l'argent, le cuivre, le zinc et le dihydrogène
Mesurons la $d.d.p.$ des deux piles ci-dessous
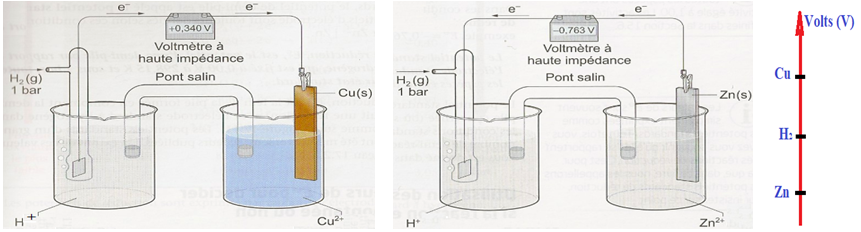
On constate :
$\begin{array}{lcl} E&=&V_{Cu}-V_{H_{2}}\\&=&0.340\,V>0\\\Rightarrow V_{Cu}-V_{H_{2}}&>&0\\\Rightarrow V_{Cu}&>&V_{H_{2}}. \end{array}$
Le potentiel du couple $Cu^{2+}/Cu^{+}$ a le potentiel le plus élevé que celui du couple $H^{+}/H_{2}$
$\begin{array}{lcl} E&=&V_{Zn}-V_{H_{2}}\\&=&-0.763\,V>0\\\Rightarrow V_{Zn}-V_{H_{2}}&<&0\\\Rightarrow V_{Zn}&<&V_{H_{2}}. \end{array}$
Le potentiel du couple $Zn^{2+}/Zn^{+}$ a le potentiel le moins élevé que celui du couple $H^{+}/H_{2}$
Le graphe ci-dessus indique la place du couple $H_{3}O^{+}/H_{2}$ se place entre celui du cuivre et celui du zinc
Il est possible à partir de la mesure des $f.é.m.$ de plusieurs piles d'effectuer un classement quantitatif des couples redox.
Remarque :
La mesure de la $f.é.m.$ d'une pile permet de connaitre la différence entre les potentiels redox des couples mis en jeu dans les deux demi-piles, mais ne permet pas de connaitre le potentiel redox associé à un couple.
III. Potentiel redox ou potentiel d'oxydoréduction
1. Force électromotrice d'une pile électrochimique ou tension à vide
On peut brancher sur une pile électrochimique un voltmètre entre la cathode et l'anode pour mesurer la tension à vide (courant débité nul).
Cette tension à vide, notée $E$ est appelée force électromotrice de la pile On écrira :
$$E=E^{+}-E^{-}=E_{\text{cathode}}-E_{\text{anode}}$$
$E^{+}$ est le potentiel de la cathode
$E^{-}$ est le potentiel de l'anode
2. Électrode standard d'hydrogène ou électrode de référence
Expérimentalement, seul $E$ est accessible.
Les potentiels d'électrode $E^{+}$ et $E^{-}$, on ne peut les mesurer, seules les différences de potentiel sont accessibles expérimentalement.
Le potentiel d'électrode ne peut être mesuré que par rapport à celui d'une électrode de référence.
L'électrode choisie comme référence est l'électrode standard à hydrogène $($noté $ESH)$ qui met en jeu le couple $H_{3}O^{+}/H_{2}$
Le couple $H_{3}O^{+}/H_{2}$ pris dans les conditions standards $(pH=0$ ; $P=1\,bar=10^{5}Pa)$ est le couple de référence.
L'électrode standard (ou normal) à hydrogène $(E.S.H)$ est la demi-pile de référence, son potentiel est choisi nul à toute température, on la note :
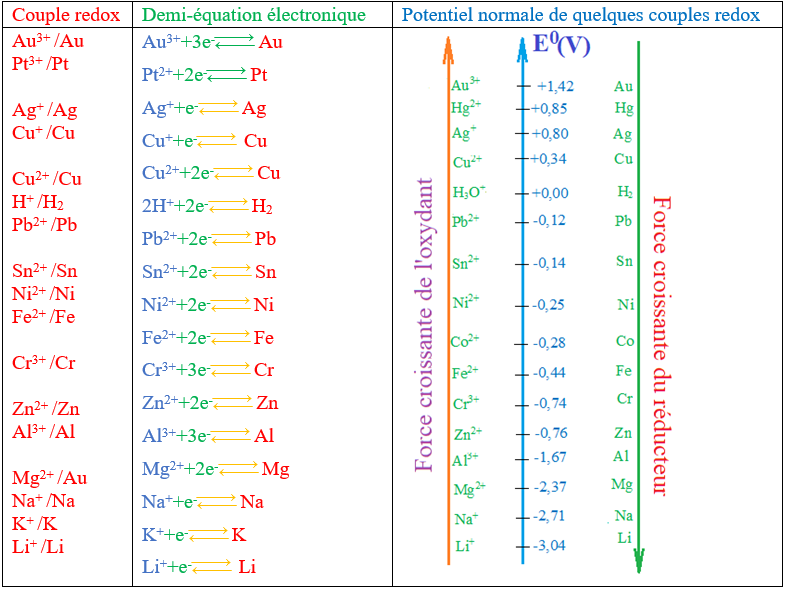
3. Potentiel normal d'un couple oxydant-réducteur
Le potentiel redox d'un couple $M^{n+}/M$ est égale à la $d.d.p$ en circuit ouvert entre l'électrode métallique $M$ et l'électrode de platine de la demi-pile standard
$$E_{M^{n+}/M}=V_{M}-V_{ESH}$$
Le potentiel redox est dit standard et noté $E^{\circ}$ lorsque les espèces oxydante et réductrice du couple considéré sont dans les conditions standards.
$$E^{\circ}=V_{M}-V_{ESH}=E^{\circ}_{M}-0\Rightarrow\,E^{\circ}=V_{M}$$
Remarque :
$-\ $ Plus le potentiel standard d'électrode du couple est élevé, plus l'oxydant du couple est fort et plus le réducteur est faible.
$-\ $ Plus le potentiel standard d'électrode du couple est faible, plus le réducteur du couple est fort et plus l'oxydant est faible

Commentaires
Anonyme (non vérifié)
jeu, 02/24/2022 - 08:06
Permalien
Pdf
Konan (non vérifié)
mer, 03/16/2022 - 12:07
Permalien
Je voudrais la correction des exercices sur ce cours
Ajouter un commentaire