Exercices sur les métaux 3e
Classe:
Troisième
Exercice 1
Indiquer le mots permettant de remplir correctement la grille ci-contre
Horizontalement :
2 – à l'air libre, il donne un oxyde plus réfractaire qui le protège même liquide.
4 – il est le meilleur conducteur d'électricité parmi les métaux usuels
Verticalement :
2 – c'est le plus lourd des métaux usuels, il possède trois (3) variétés d'oxydes
7 – son oxyde entre souvent dans la fabrication de peintures et de médicaments.
11 – sans protection, il est détruit par l'air libre.
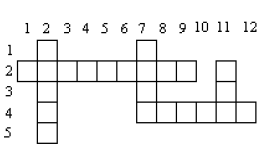
Exercice 2
Répondre par Vrai (V) ou Faux (F) en mettant une croix (X) sur la bonne réponse
1) Le bronze est :
un métal
un alliage
un corps métallique
un non métal
2) La corrosion d'un métal est :
la perte de son éclat métallique
le changement de son état physique
3) A l'air libre, ce métal sécrète sa propre protection :
le plomb
le fer
le cuivre
4) La rouille est :
la couche qui recouvre tout métal
Le résultat de la corrosion du fer
L'oxyde ferrique humide
Exercice 3
1) Pourquoi recouvre-t-on le fer de peinture ?
2) Qu'est-ce que le fer blanc ? le fer galvanisé ?
3) Que se passe-t-il quand on expose, à l'air libre,
3-1) l'aluminium
3-2) le zinc
3-3) quelle différence y a-t-il entre la corrosion de ces métaux et celle du fer ?
Exercice 4
1) Décrire l'action de l'air sur le zinc à froid puis à chaud.
2) Quelle masse d'oxyde de zinc obtient-on en brûlant complètement $13\;g$ de zinc dans du dioxygène pur ?
Exercice 5
Un morceau de fer de masse $20\;g$ est abandonné à l'air libre il s'enrouille. Ramassé, décapé et poli, le morceau perd 1/4 de sa masse initiale. Sachant que la rouille formée se compose de 5 moles d'eau pour une mole d'oxyde ferrique soit $Fe_{2}O_{3}\;;\ 5H_{2}O$, trouvez :
1) La masse de fer oxydé et en déduire la masse d'oxyde ferrique formé.
2) La masse d'eau contenue dans la rouille formée.
3) La masse de rouille formée
4) La masse du morceau de fer rouillé avant son nettoyage.
Exercice 6
Chauffé dans un courant de dioxygène, l'oxyde de plomb $PbO$ se transforme en minium $Pb_{3}O_{4}$.
1) Écrire l'équation bilan de la réaction.
2) Calculer la masse molaire du minium.
3) Sachant que dans les conditions de cette expérience, une mole de gaz occupe $22.4\;L$, quel volume de dioxygène faut-il pour obtenir $13.7\;kg$ de minium ?
Exercice 7
En brûlant le cuivre dans l'air, on obtient deux oxydes de cuivre.
1) Lesquels, écrivez les équations bilan respectives de leurs formations.
2) Calculer le volume de dioxygène nécessaire pour obtenir $7.2\;g$ d'oxyde cuivreux.
3) Quelle est la masse de cuivre ainsi oxydé ?
Prendre :
$O=16\;g/mol\;;\ Pb=207\;g/mol\;;\ Fe=56g/mol\;;\ Cu=64\;g/mol\;;\ H=1\;g/mol\;;\ Zn=65\;g/mol$
Activité
1) Compléter le tableau
$$\begin{array}{|l|c|c|c|c|c|} \hline \text{Métal}&\text{Al}&\text{Zn}&\text{Fe}&\text{Pb}&\text{Cu}\\ \hline \text{Couleur}& & & & &\\ \hline \text{Comportement à l'air humide}& & & & &\\ \hline \text{Utilisation usielle}& & & & &\\ \hline \end{array}$$
2) Décris une expérience qui permet de distinguer une lame de fer et une lame de cuivre
Exercice 8 Oxydation de métal à chaud
A chaud, le dioxygène réagit avec le fer pour donner de l'oxyde magnétique de fer $\left(Fe_{3}O_{4}\right).$
Dans les mêmes conditions, le dioxygène réagit avec l'aluminium pour donner de l'oxyde d'aluminium ou alumine $\left(Al_{2}O_{3}\right).$
Écris l'équation-bilan de chaque réaction.
Exercice 9 Attaque de métal par l'acide chlorhydrique
Équilibre les équations suivantes :
$Zn\ +\ H^{+}\ \rightarrow\ H_{2}\ +\ Zn^{2+}$
$Al\ +\ H^{+}\ \rightarrow\ H_{2}\ +\ Al^{3+}$
$Fe\ +\ H^{+}\rightarrow\ H_{2}\ +\ Fe^{2+}$
Exercice 10 Action de l'acide chlorhydrique sur les métaux
1) Dans un tube à essais contenant de la grenaille de zinc, on introduit une solution diluée d'acide chlorhydrique.
a) Quel est le nom et la formule du gaz produit lors de la réaction ?
b) Décris une expérience simple permettant d'identifier ce gaz.
c) Écris l'équation globale de la réaction qui se produit.
2) On introduit maintenant la solution diluée d'acide chlorhydrique dans des tubes à essais contenant successivement de la limaille de fer, de la poudre d'aluminium, de la tournure de cuivre et du plomb.
a) Dans quels tubes observe-t-on une réaction ?
b) Écris l'équation ionique des réactions qui se produisent.
Exercice 11
Explique pourquoi on utilise le zinc et non le fer pour couvrir les toits des maisons.
Exercice 12
On dispose de trois pots :
Le premier en fer, le second en cuivre et le troisième en zinc.
On veut conserver de l'acide sulfurique dilue dans l'un de ces pots.
1) La conservation est impossible avec deux de ces pots.
Lesquels ?
Justifiez.
2) Écris les équations bilans ioniques globales des réactions chimiques qui se produisent avec les métaux des pots inutilisables.
Exercice 13
Ibrahima dispose de $3$ lames fraichement décapées de fer, de cuivre et de zinc.
1) Quel est l'aspect physique de chacune d'elles ?
2) On expose les $3$ lames à l'air libre, quelles sont les réactions susceptibles de se produire avec chacun de ces métaux ?
Quels sont les produits qui se forment éventuellement ?
3) Pour chaque métal, écris l'équation-bilan ou les équations-bilans des réactions qui se produisent lors de l'oxydation à chaud.
Exercice 14
Fatou fait réagir complètement $3.25\,g$ de zinc avec une solution décimolaire d'acide chlorhydrique.
1) Écris l'équation-bilan de la réaction.
2) Quel volume de la solution d'acide a-t-elle utilisé ?
Quel volume de dihydrogène obtient-elle ?
On donne :
$M(Zn)=65g\cdot mol^{-1}\;;\ V_{M}=24L\cdot mol^{-1}$
Exercice supplémentaire
Une violente explosion est survenue dans un entrepôt de matériaux lorsqu'un employé a actionné par erreur l'interrupteur du circuit électrique qui permet d'allumer la lampe.
Dans ce local, sont stockés les matériaux suivants :
du cuivre, du fer, de l'aluminium, du zinc et de l'acide chlorhydrique.
Lors de l'enquête menée par un inspecteur de police scientifique, l'employé signale que plusieurs bidons d'acide chlorhydrique étaient mal fermés et laissaient échapper un liquide.
Expliquer qui pourrait être à l'origine de l'explosion ?
$\begin{array}{c}\blacktriangleright\,\boxed{\text{Correction des exercices}}\end{array}$
Source:
irempt.ucad.sn & ADEM

Commentaires
max diaw (non vérifié)
dim, 04/21/2019 - 05:13
Permalien
Vriement ça c'est tres
Babacar ndao (non vérifié)
ven, 09/11/2020 - 22:39
Permalien
hh
ousmane fall (non vérifié)
mer, 05/22/2019 - 22:57
Permalien
Ça ses importante
Anonyme (non vérifié)
lun, 02/17/2020 - 09:33
Permalien
Les solutions
Anonyme (non vérifié)
lun, 02/17/2020 - 10:04
Permalien
C'est très bien
Anonyme (non vérifié)
jeu, 02/27/2020 - 23:35
Permalien
Bjour je voulais la
Adji mbene ngom (non vérifié)
mar, 07/07/2020 - 23:31
Permalien
Remerciements
Adji mbene ngom (non vérifié)
mar, 07/07/2020 - 23:31
Permalien
Remerciements
Rokhaya niang (non vérifié)
dim, 07/26/2020 - 18:20
Permalien
Reussir les sciences physiques
Anonyme (non vérifié)
sam, 08/29/2020 - 19:06
Permalien
Gènial
Mbene (non vérifié)
sam, 08/29/2020 - 19:06
Permalien
Etude
Anonyme (non vérifié)
mer, 05/26/2021 - 22:12
Permalien
Je voudrais la correction d
Sadio diouf (non vérifié)
ven, 06/10/2022 - 09:25
Permalien
Exercice
Aminata Sow (non vérifié)
lun, 04/08/2024 - 15:00
Permalien
Demande de correction
Mouhamed Faye (non vérifié)
mar, 06/01/2021 - 17:45
Permalien
demande d'exercices
Mouhamed Faye (non vérifié)
mar, 06/01/2021 - 17:45
Permalien
demande d'exercices
Babs (non vérifié)
jeu, 05/19/2022 - 16:12
Permalien
Merci broh
Diouf (non vérifié)
jeu, 05/02/2024 - 22:14
Permalien
Travail
Mbaye Ndion (non vérifié)
sam, 05/11/2024 - 22:21
Permalien
Merci
pedri (non vérifié)
ven, 04/11/2025 - 22:06
Permalien
demander la correction
Ajouter un commentaire