Généralités sur les solutions aqueuses - 2nd S
Classe:
Seconde
I. Dissolution
1. Exemples de dissolution
1.1 Expériences

Les morceaux de sel (solution de chlorure de sodium) ou de sucre (saccharose) se dissolvent dans l'eau pour former des mélanges homogènes
Le sucre et sel sont appelés solutés
L'eau est le solvant
1.2 Conclusion
On dit que le sucre et le sel se sont dissous dans l'eau : c'est le phénomène de dissolution
Les mélanges homogènes obtenus sont appelés solutions
2. Définitions
$-\ $ Une solution est un mélange homogène constitué de soluté(s) et de solvant
$-\ $ Le soluté est l'espèce dissoute.
Il peut être solide, liquide ou gaz.
$-\ $ Le solvant est l'espèce qui dissout.
Lorsque le solvant est l'eau, la solution obtenue est dite solution aqueuse
3. Solution ionique et solution non ionique
3.1 Expérience : conductibilité d'une solution
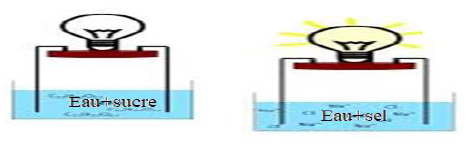
Observation
$-\ $ Aucun courant ne passe dans le circuit comportant la solution aqueuse de saccharose (sucre)
$-\ $ Par contre, le courant passe dans le circuit comportant la solution de chlorure de sodium (sel)
Interprétation
Le passage du courant dans la solution de chlorure de sodium est rendu possible par l'existence, dans la solution, d'ions (conducteurs de courant) ; l'eau sucrée ne renferme des molécules (non conducteurs de courant)
Conclusion
$-\ $ l'eau sucrée ne conduit pas le courant électrique ; elle est isolante.
$-\ $ la solution aqueuse de chlorure de sodium est conductrice de courant électrique ; elle est ionique
Remarque
La solution ionique est électriquement neutre : le nombre de charges positives portées par les cations est égal au nombre de charges négatives portées les anions
3.2 Définitions
$-\ $ Une solution qui conduit le courant électrique est une solution ionique ou électrolyte
$-\ $ Une solution non ionique ne conduit pas le courant électrique
II. Rôle du solvant et effets thermiques
1. Rôle du solvant
1.1 Rôle ionisant et dispersant
L'eau détruit la liaison covalente entre le chlore et hydrogène et génère des ions $(H^{+}\;,\ Cl^{-})$ : c'est un solvant ionisant
Les ions sont distribués de façon homogène dans la solution : l'eau est un solvant dispersant
1.2 Rôle dissociant et dispersant
L'eau sépare et disperse les ions d'un composé ionique ou les molécules d'un composé ionique : c'est un solvant dissociant et dispersant
Remarque
Une solution ionique peut être obtenue par dissolution :
$-\ $ de composés ioniques dans l'eau
Exemple :
$NaCl\stackrel{Eau}{\longrightarrow}\ Na^{+}\ +\ Cl^{-}$
$-\ $ de composés moléculaires dans l'eau
Exemples :
$HCl\ +\ H_{2}O\ \longrightarrow\ H_{3}O^{+}\ +\ Cl^{-}$ (totale)
$NH_{3}\ +\ H_{2}O\ \longrightarrow\ NH_{4}^{+}\ +\ OH^{-}$ (partielle)
1.3 Rôle hydratant
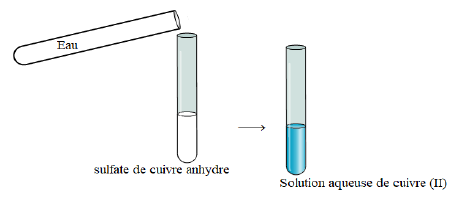
Le sulfate est incolore lorsqu'il est anhydre (sans eau) et bleui lorsqu'il hydraté
Dans une solution aqueuse ionique, les ions se retrouvent entourés par un cortège de molécules de solvant : ils sont solvates.
Lorsque le solvant est l'eau, on dit que les ions sont hydratés.
On dit que l'eau est un solvant hydratant
2. Effets thermiques
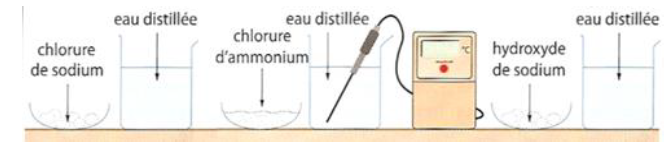
Observation
$-\ $ La dissolution de l'hydroxyde de sodium s'accompagne d'élévation de température
$-\ $ La dissolution du chlorure d'ammonium absorbe de la chaleur
$-\ $ La dissolution de chlorure de sodium ne fait pas varier la température
Conclusion
$-\ $ Lorsque la dissolution d'un composé ionique s'accompagne d'une augmentation de la température, la dissolution est dite exothermique
$-\ $ La dissolution d'un composé ionique peut également s'accompagner d'une diminution de la température ; la dissolution est dite endothermique ;
$-\ $ Si aucun effet thermique n'apparait lors d'une transformation chimique, la dissolution est dite athermique
III. Grandeurs caractéristiques d'une solution aqueuse
1. Concentrations d'une solution
1.1 Concentrations molaires
La concentration molaire volumique ou concentration molaire est la quantité de matière de soluté(s) dissoute dans un litre de solvant
1.1.1 Concentration molaire volumique d'une solution
Si le soluté est un corps que l'on dissout dans le solvant la concentration molaire du soluté est définie :
$$\boxed{C_{A}=\dfrac{n_{A}}{V}}$$
$n_{A}$ en moles (mol)
$V$ en litres $(L)$
$C$ en moles par litres $(mol\cdot L^{-1})$
1.1.2 Concentration molaire volumique d'une espèce chimique en solution
La concentration molaire d'une espèce chimique $A$ en solution, notée $[A]$ est définie par le rapport :
$$\boxed{[A]=\dfrac{n_{A}}{V}}$$
$n_{A}$ en moles (mol)
$V$ en litres $(L)$
$[A]$ en moles par litres $(mol\cdot L^{-1})$
Exemple :
Exprimer les concentrations des ions d'une solution aqueuse de sulfate de sodium $Na_{2}SO_{4}$ de concentration $C$
Équation de dissolution :
$Na_{2}SO_{4}\stackrel{H_{2}O}{\longrightarrow}\ 2Na^{+}\ +\ SO_{4}^{2-}$
$C$ $2C$ $C$
$$\left[Na^{+}\right]=2C\ ;\ \left[SO_{4}^{+}\right]=C$$
1.2 Concentration massique
C'est la masse d'une substance $A$ dissoute dans un litre de solution
$$\boxed{C_{m}(A)=\dfrac{m_{A}}{V}}$$
$m_{A}$ en grammes $(g)$
$V$ en litres $(L)$
$C_{m}(A)$ en grammes par litres $(g\cdot L^{-1})$
Remarque :
Il existe une entre la concentration molaire et la concentration massique
$$C_{m}(A)=C_{A}M_{A}$$
2. Solubilité et saturation
2.1 Expérience
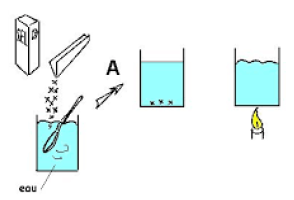
Observation :
$-\ $ L'eau ne peut dissoudre le sel en moment donné
$-\ $ En chauffant le mélange (hétérogène), le sel se dissout
Conclusion :
L'eau ne peut plus dissoudre le sel : on dit que la solution est saturée à cette température
La quantité maximale de sel pouvant se dissoudre dans un volume donné dépend de la température
2.2 Définition
La solubilité est la quantité maximale de soluté(s) que l'on peut dissoudre dans un volume donné de solvant à une température donnée
Elle s'exprime en grammes par litre $(g\cdot L^{-1})$
La solubilité dépend de la température
$$\begin{array}{|c|c|c|} \hline\text{Composés}&\text{Solubilité en }g\cdot L^{-1}\text{ à }20^{\circ}C&\text{Solubilité en }g\cdot L^{-1}\text{ à }80^{\circ}C\\ \hline NaCl&250&384\\ \hline KNO_{3}&316&1690\\ \hline \end{array}$$
Remarque :
La solubilité reflète la capacité d'une espèce chimique à se dissoudre dans un solvant donné : plus on peut dissoudre une quantité importante d'une substance dans un liquide et plus sa solubilité est grande.
IV. Préparation de solutions
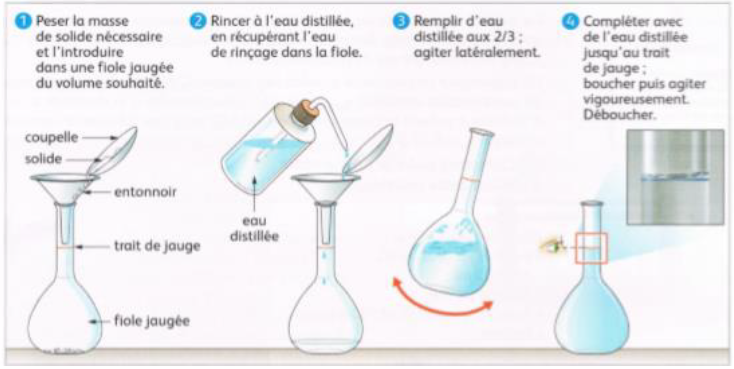
1. Préparation d'une solution par dissolution
Pour préparer une solution aqueuse par dissolution :
$-\ $ On pèse une masse $m$ du soluté à l'aide d'une balance
$-\ $ On le verse dans une fiole jaugée de volume $V$
$-\ $ On ajoute de l'eau distillée dans la fiole $($aux $2/3$ environ$)$, on bouche et on agite pour dissoudre entièrement le soluté dans l'eau (le solvant)
$-\ $ On complète soigneusement la fiole jaugée avec de l'eau distillée jusqu'au trait de jauge.
$-\ $ On bouche et on agite.
La solution est prête.
2. Préparation d'une solution par dilution
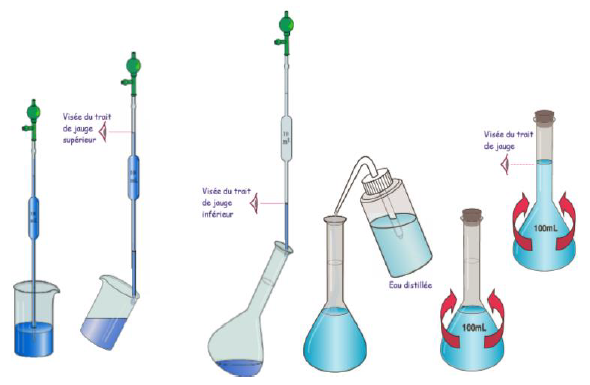
2.1 Principe de la dilution
Pour fabriquer la solution fille de concentration $C_{fille}$, il faut prélever, à l'aide d'une pipette jaugée, un volume $V_{mère}$ de la solution mère de concentration $C_{mère}$, le verser dans une fiole jaugée de volume $V_{fille}$ et enfin rajouter de l'eau afin de rabaisser la concentration.
On obtient une solution fille de volume $V_{fille}$ et de concentration $C_{fille}.$
Au cours d'une dilution, il y a conservation de la quantité de matière : $n(soluté)_{mère}=n(soluté)_{fille}$, ce qui se traduit par :
$$C_{mère}V_{mère}=C_{fille}V_{fille}$$
2.1 Facteur de dilution
C'est un nombre qui caractérise la dilution réalisée.
On le note $F.$
Il est défini par la relation :
$$F=\dfrac{C_{mère}}{fiille}=\dfrac{V_{fiille}}{V_{mère}}$$
Remarque :
On dilue $x$ fois signifie que le facteur de dilution vaut $x$ $($et pas qu'on réalise $x$ dilutions successives$)$
On réalise une dilution au $x^{ième}$ (dixième, cinquième, vingtième) signifie que le facteur de dilution vaut $x$

Commentaires
Natacha Mallet (non vérifié)
ven, 06/18/2021 - 11:13
Permalien
Explication
Anonyme (non vérifié)
dim, 03/16/2025 - 23:08
Permalien
c'est un excellent cours
Alioune kane (non vérifié)
lun, 07/05/2021 - 17:13
Permalien
Encouragement
Mame Mbacké Diouf (non vérifié)
jeu, 06/23/2022 - 22:18
Permalien
Remerciements
Madieng Cisse (non vérifié)
dim, 08/28/2022 - 17:08
Permalien
Félicitations
Ajouter un commentaire