Le composés aromatiques : le benzène - 1er s
Classe:
Première
I. Structure
1. Exemple du Benzène
Le benzène est un hydrocarbure instauré liquide, incolore non miscible dans l'eau.
La formule brute est $C_{6}$ $H_{6}.$
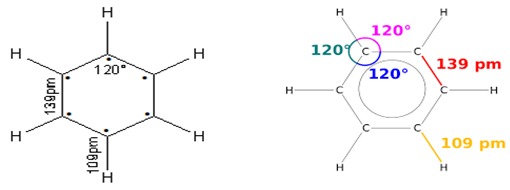
L'étude expérimentale de la molécule par des méthodes physiques montre que la molécule est plane et cyclique.
Les six atomes de carbones occupent chacun le sommet d'un hexagone (six côtés, six sommets).
La longueur de liaisons $(C\ –\ C)$ de la molécule de benzène est intermédiaire entre celle d'une liaison et celle d'une liaison double.
Les longueurs de liaisons $(C\ -\ C)$ sont identiques $d_{c-c}=140\,pm$
$$d(C=C)\ <\ d(C-C)\ <\ d(C-C)$$
$$\text{Alcène}\;(134\,pm)\ \text{Benzène}\;(140\,pm)\ \text{Alcane}\;(154\,pm)$$
$\bullet $ Géométrie de la molécule
Les six électrons disponibles forment le nuage électronique en faisant une liaison collective entre (sextet) les six atomes de carbone.
L'ensemble des six atomes ainsi liés et appelé noyau benzénique » ou encore appelé « noyau aromatique »
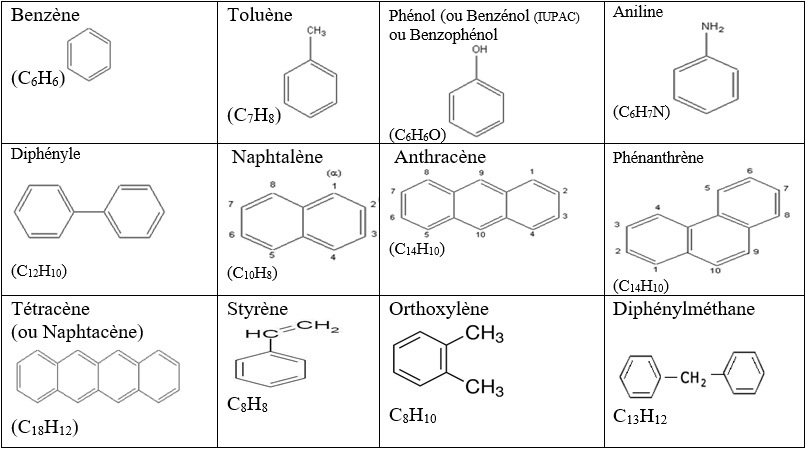
2. Exemple d'autres composés aromatiques
On appel composé aromatiques tout composé comportant d'un ou plusieurs noyaux benzéniques confèrent à la molécule des propriétés particuliers.
Il n'existe pas de nomenclature systématique.
On les nomme en générale comme des dérivés substitués du benzène.
II. Propriétés du Benzène
1. Propriétés physiques du benzène
C'est un liquide incolore dans des conditions ordinaires de température et de pression.
Il est caractérisé par une température de fusion de $5.5^{\circ}C$ et une température d'ébullition à $80^{\circ}C.$
Il est insoluble dans l'eau, c' est un bon solvant (il dissout les coups gras l'iode, le soufre...) et soluble dans l'alcool et dans l'éther.
2. Propriétés chimiques
2.1. Réaction de combustion
Les réactions de combustion sont des réactions de destruction ; c'est-à-dire une réaction au cours de laquelle le squelette carboné de la molécule est complètement détruit.
$C_{6}H_{6}+\dfrac{15}{2}\rightarrow 6CO_{2}+3H_{2}O$
ou $2C_{6}H_{6}+15O_{2}\rightarrow 12CO_{2}+6H_{2}O$
L'équation montre que la quantité de dioxygène (coefficients stœchiométriques) nécessite une quantité importante de dioxygène pour obtenir une combustion complète.
2.2. Réactions de substitution
Une réaction de substitution sur le benzène consiste à remplacer un ou des atome(s) d'hydrogène par un atome ou un groupe d'atomes, tout en conservant le noyau benzénique.
2.2.1 Coloration du Benzène
Afin d'éviter une réaction d'addition, on opère à l'abri de la lumière.
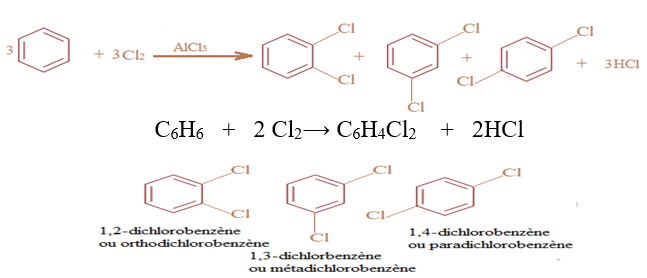
En présence d'un catalyseur, le chlorure d'aluminium, $AlCl_{3}$, le dichlore réagit avec le benzène suivant une réaction de substitution :
$-\ $ Lorsque le dichlore n'est pas en excès, on obtient une mono substitution
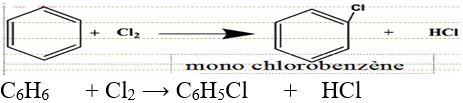
$-\ $ Lorsque le dichlore est en excès et que la réaction se poursuit, on obtient une di, tri, tétra, penta puis une hexasubstitution.
La réaction de disubstitution fournit un mélange de trois isomères.
Exemples
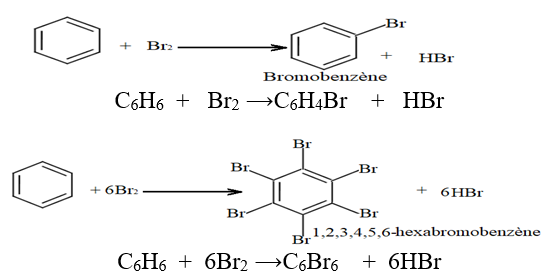
2.2.2 Bromation du Benzène
En l'absence de lumière la réaction se fait dans l'obscurité mais elle nécessite un catalyseur comme le bromure de fer $III$ $(FeBr_{3}).$
Si le dibrome est un excès on peut obtenir des dérives polysubstitués bromés du benzène.
Exemples
2.2.3 Nitration du Benzène
L'acide nitrique $HNO_{3}$ concentré réagit sur le benzène en présence de l'acide sulfurique comme catalyseur
L'équation de la réaction s'écrit :
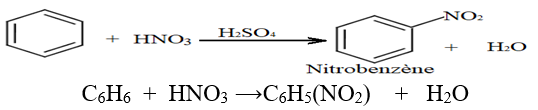
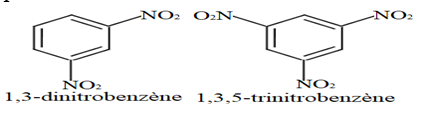
A température élevée $(90^{\circ})$ il est possible d'obtenir le dinitrobenzène et du trinitrobenzène
2.2.4 Sulfonation du Benzène
La sulfonation du benzène peut être effectuée en portant à reflux un mélange de benzène et d'oléum $(SO_{3}\;,\ H_{2}SO_{4})$
L'équation de la réaction s'écrit :
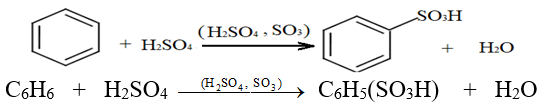
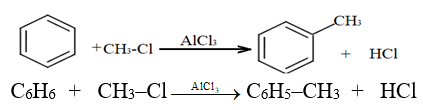
2.2.5 Alkylation
Il s'agit de greffer une chaine alkyle sur le cycle benzénique.
On utilise $AlCl_{3}$ ou $AlBr_{3}$ comme catalyseur.
Exemple :
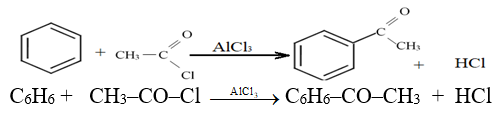
2.2.6 Alcoylation
Il s'agit d'une synthèse de cétone aromatique.
Le réactif alcylant est un halogénure d'acyle ou en anhydride d'acide.
La réaction nécessite l'utilisation d'un catalyseur comme le chlorure d'aluminium $AlCl_{3}$
Exemple :
2.3 Réactions d'addiction
Elles sont difficiles à réaliser et s'effectuent en une seule étape et avec un changement de la structure de la molécule.
2.3.1 Hydrogénation
Elle nécessite la présence de catalyseur très réactif comme le nickel $(Ni)$, le platine $(Pt).$
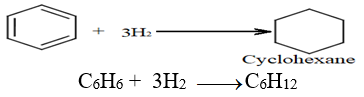
La molécule ne présente plus son caractère aromatique (destruction du noyau benzénique), on passe de la configuration à plusieurs conformations dont celle du bateau et chaise.
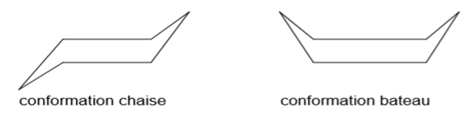
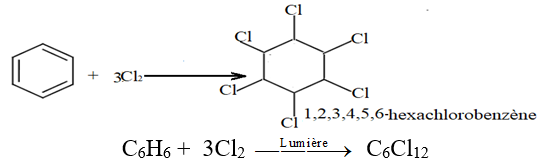
2.3.2 Addition du dichlore
L'addition du dichlore sur le benzène est une réaction photochimique (présence de lumière) on obtient l'hexachlorohexane.

Commentaires
Laplace (non vérifié)
ven, 10/29/2021 - 13:11
Permalien
Cours
Wafeu (non vérifié)
sam, 06/11/2022 - 04:23
Permalien
Demande de telechargement
Monsieur koï (non vérifié)
sam, 12/02/2023 - 08:29
Permalien
Mon objectifs c'est de faire mon travail
Mansour THIAM (non vérifié)
mer, 03/01/2023 - 10:17
Permalien
Pour etudier
Konan (non vérifié)
mer, 01/10/2024 - 23:25
Permalien
C'est un bon document
Anonyme (non vérifié)
ven, 05/09/2025 - 13:58
Permalien
une très bonne explication, j
Ajouter un commentaire