Les amines - Ts
Classe:
Terminale
I. Généralités
1. Définition
Les amines sont des composés azotés dont la chaine carbonée comporte au moins un atome d'azote
Leur formule générale est : 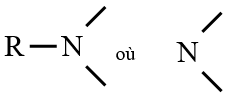
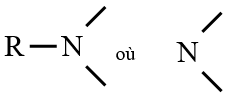
est le groupe fonctionnel des amines
2. Les classes d'amine
La classe d'une amine est liée au nombre de groupe alkyle (ou aryle) portés par l'atome d'azote
Il existe trois classes d'amines :
$-\ $ les amines primaires : $R-NH_{2}$
$-\ $ les amines secondaires : $R-NH-R'$
$-\ $ les amines tertiaires : $R-NR'-R''$
$R\;,\ R'\text{ et }R''$ peuvent être identiques ou différents.
Si l'un d'eux est au moins un groupe aryle $\left(C_{6}H_{5^{-}}\right)$, il s'agit d'une amine benzénique (on dit aussi aromatique)
3. Nomenclature
a) Cas des amines aliphatiques
$-\ $ Les amines primaires sont nommées en ajoutant la terminaison amine éventuellement précédée du numéro de l'atome de carbone portant le groupe caractéristique entre tirets
Exemples :
$CH_{3}-CH_{2}-NH_{2}$ : Éthanamide ou éthylamine
$CH_{3}-CH\left(NH_{2}\right)-CH_{3}$ : propan $-2-$ amine
$CH_{3}-CH_{2}-CH_{2}-CH\left(CH_{3}\right)-CH_{2}-CH_{2}NH_{2}$ : $3-$ méthylhéxan $-1-$ amine
$-\ $ Les amines secondaires et tertiaires sont constituées comme dérivant de l'amine primaire correspondant à la chaine carbonée la plus longue
Le nom de cette amine est précédé du nom ou des noms des substituants sur l'atome d'azote énuméré dans l'ordre alphabétique et précédé du préfixe $N-$
Pour les amines secondaires et tertiaires, lorsque les substituants alkyles sont identiques, on ajoute le suffixe « amine » au nom du radical alkyle privé du « e » final et précédé du suffixe multiplicatif adéquat
Exemples :
$CH_{3}-CH_{2}-CH_{2}-NH-CH_{3}$ : $N-$ méthylpropane $-1-$ amine
$CH_{3}-CH_{2}-NH-CH_{2}-CH_{3}$ : $N-$éthyléthanamine ou diéthylamine
$CH_{3}-CH\left(C_{6}H_{5}\right)-CH_{2}-NH-CH_{2}-CH_{3}$ : $N-$ éthyl $-2-$ phénylpropanamine
$CH_{3}-CH_{2}-CH_{2}-N\left(CH_{3}\right)-CH_{2}-CH_{3}$ : $N-$ éthyl $-N-$ méthylpropanamine
$CH_{3}-CH_{2}-N\left(C_{2}H_{5}\right)-CH_{2}-CH_{2}-CH_{3}$ : $N\;,\ N-$ diéthyl léthanamine ou triéthylamine
b) Cas des amines aromatiques
Pour les amines aromatiques nous donnerons quelques exemples
$C_{6}H_{5}-NH_{2}$ : Phénylamine ou aniline
$C_{6}H_{5}-NH-C_{6}H_{5}$ : Diphénylamine
$C_{6}H_{5}-N\left(CH_{3}\right)_{2}$ : $N\;,\ N-$ diméthylaniline
II. Propriétés des amines
1. Propriétés basiques d'une amine :
a) Ionisation dans l'eau
L'action des amines sur l'eau est limitée, elle se fait avec libération de l'ion hydroxyde $OH^{-}$
$R-NH_{2}+H_{2}O\longrightarrow R-NH_{3}^{+}+OH^{-}$
$R-NH-R'+H_{2}O\longrightarrow R-NH_{2}^{+}-R'+OH^{-}$
$R-NR'-R'+H_{2}O\longrightarrow R-NH^{+}R'-R''+OH^{-}$
b) Action des amines sur quelques ions métalliques
Les solutions d'ammoniac et d'amines aliphatiques donnent des propriétés avec certains ions métalliques tels que :
$-\ $ les ions $Cu^{2+}$
$-\ $ les ions $Fe^{2+}\;,\ Fe^{3+}\;,\ Al^{3+}\ldots$
2. Réaction d'alkylation
On appelle alkylation toute réaction au cours de laquelle un groupe alkyle se fixe sur une molécule
Les équations-bilans s'écrivent :
$NH_{3}+R-X\ \rightarrow\ R-NH_{2}+HX$
$R_{1}-NH-R_{2}+R-X\ \rightarrow\ R_{1}-NR-R_{2}+HX$
$R_{1}-NR_{3}-R_{2}+R-X\ \rightarrow\ \left[ R_{1}-NRR_{3}-R_{2}\right]^{+}+X^{-}$
$\left(X=Cl\;,\ Br\;,\ I\ldots\right)$
Exemple :
$CH_{3}-CH\left(CH_{3}\right)-CH_{2}Br+NH_{3}\ \rightarrow\ CH_{3}-CH\left(CH_{3}\right)-CH_{2}NH_{2}+HBr$ : $2-$ méthylpropan $-1-$ amine

Commentaires
Cissé Mor 2 (non vérifié)
mer, 11/24/2021 - 11:12
Permalien
Remarque
Ajouter un commentaire