Série d'exercices : Électrolyse, bilan quantitatif - 1er s
Classe:
Première
Exercice 1
Le bilan de l'électrolyse d'une solution aqueuse de chlorure d'étain $(II)$, chlorure stanneux, est :
$Sn^{2+}\ +\ 2Cl^{-}\ \rightarrow\ Sn\ +\ Cl_{2}$
1. Faire un schéma annoté du montage.
2. Montrer que ce bilan est celui d'une oxydoréduction non spontanée.
3. A quelle condition l'électrolyse se produit-elle ?
4. Réactions aux électrodes :
4.1 Écrire l'équation de la réaction ayant lieu à l'anode.
4.2 Écrire l'équation de la réaction ayant lieu à la cathode.
5. La solution de chlorure d'étain $(II)$ utilisée est acidifiée par de l'acide chlorhydrique (pour empêcher que $Sn^{2+}$, instable, ne se transforme en $Sn^{4+}$).
Expliquer pourquoi on observe la réduction de l'ion étain $(II)$ alors que l'ion hydrogène $H^{+}$ est un oxydant plus fort que l'ion étain $(II)$ $Sn^{2+}.$
Données : Potentiels standard
$E^{\circ}\left(Cl_{2}/Cl^{-}\right)=1.36\,V$
$E^{\circ}\left(H^{+}/H_{2}\right)=0.00\,V$
$E^{\circ}\left(Sn^{2+}/Sn\right)=-0.14\,V$
Exercice 2
On effectue l'électrolyse d'une solution aqueuse de nitrate d'argent $\left(Ag^{+}+NO_{3}^{-}\right)$ acidifiée avec une solution d'acide nitrique $\left(H^{+}+NO_{3}^{-}\right).$
Les électrodes sont inattaquables.
1. Écrire les équations-bilans des réactions possibles aux électrodes.
Parmi celles-ci, lesquelles devraient se produire ?
2. On constate qu'il se forme un dépôt d'argent.
Sur quelle électrode ce métal se dépose-t-il ?
3. Écrire l'équation-bilan de cette électrolyse.
4. A partir de quelle tension aux bornes de l'électrolyseur, cette électrolyse se produit-elle ?
5. L'électrolyse dure $21.0$ minutes et l'intensité du courant est maintenue égale à $0.80\,A.$
5.1 Quelle est la quantité de matière d'argent déposé sur une des électrodes ?
5.2 En déduire la masse d'argent.
6. Déterminer le volume de gaz formé sur l'autre électrode.
Données :
$V_{m}=25\,L\cdot mol^{-1}$
$E^{\circ}\left(H^{+}/H_{2}\right)=0.00\,V$
$E^{\circ}\left(Ag^{+}/Ag\right)=0.80\,V$
$E^{\circ}\left(NO_{3}^{-}/NO\right)=0.96\,V$
$E^{\circ}\left(O_{2}/H_{2}O\right)=1.23\,V$
$1\,F=96500\,C$
$M(Ag)=108\,g\cdot mol^{-1}$
Exercice 3
On effectue l'électrolyse d'une solution de bromure de sodium entre des électrodes inattaquables de graphite.
1. Écrire toutes les réactions pouvant se produire aux électrodes.
2. Quelle est la réaction la plus facile à réaliser ?
3. Mêmes questions pour une solution de sulfate de sodium $\left(Na^{+}\;,\ SO_{4}^{2-}\right)$
4. Mêmes questions si les électrodes sont en cuivre.
Données : utiliser la classification rédox complète du chapitre précédent
Exercice 4
On souhaite protéger une lame de fer parallélépipédique en le recouvrant de zinc $Zn.$
Pour ce faire on réalise un électrolyse à électrode soluble.
Le bain est une solution concentrée de chlorure de zinc $\left(zn^{2+}+2Cl^{-}\right).$
1. Faire un schéma de dispositif.
2. Quelle réaction s'opère à chaque électrode ?
3. En déduire l'équation bilan de la réaction d'électrolyse.
4. Comment varie la concentration molaire de $\left[Zn^{2+}\right]$ ?
5. On désire déposer une épaisseur de $50\,\mu m$ de zinc sur l'intégralité de la surface de la lame de fer
a) Calculer la masse de zinc correspondante.
On donne la masse volumique de zinc $\rho_{Zn}=7.14\,g\cdot cm^{-3}$ ; dimension de la plaque de fer : (Longueur $L=7\,cm$ ; Largeur $l=2.5\,cm$ ; Hauteur $h=0.2\,cm$)
b) Calculer la durée de l'électrolyse si on applique un courant électrique d'intensité $I=0.5\,A$
On donne $F=96500\,C\cdot mol^{-1}$ ; masse molaire de zinc $MZn=65\,g\cdot mol^{-1}$
Exercice 5
$-\ $ Les couples oxydant/réducteur : $Cu^{2+}/Cu$ et $Cl_{2}/Cl$
$-\ $ Masses molaires : $M(Cu)=63.5\,g\cdot mol^{-1}$
$-\ $ Nombre d'Avogadro : $N_{j}=6.02\cdot10^{23}mol^{-1}.$
$-\ $ Charge élémentaire de l'électron : $e=1.6\cdot10^{-19}C.$
Dans un tube en forme de $U$ on verse une solution aqueuse de chlorure de cuivre $II$ $CuCl_{2}\left(Cu^{2+}+2Cl^{-}\right).$
On plonge dans chaque branche du tube une électrode inattaquable de graphite.
On relie les deux électrodes aux bornes d'un générateur de tension continue, Lorsque $I'$ interrupteur est fermé, on observe :
$-\ $ un dépôt rouge de cuivre $Cu$ au niveau de l'électrode relié à la borne négative du générateur ;
$-\ $ un dégagement du dichlore $Cl_{2}$ (gaz) au niveau de $I'$ électrode reliée a la borne positive du générateur.
1) Représenter un schéma du montage électrique de l'électrolyse et précisé le sens du courant et le sens de circulation des électrons dans le circuit extérieur
2) a) Écrire les demi-équations des transformations aux niveaux des électrodes ainsi l'équation de la réaction bilan de l'électrolyse.
Préciser si cette réaction est spontanée ou imposée.
b) Dire en le justifiant si $I'$ électrode de droite représente $I'$ anode ou la cathode.
3) L'électrolyse fonctionne pendant $\Delta t=10\,min$, tel que l'intensité du courant est constante de valeur $I=0.5\,A.$
a) Déterminer la quantité d'électricité $Q$ échangée.
b) En déduire la quantité d'électricité $Q'$ équivalent à la charge transporté par $n$ moles d'électron qui a circule pendant cette durée (la quantité de matière d'électrons $n_{e})$
c) Déterminer la relation qui existe entre la quantité de matière du cuivre formé $n(Cu)$ et la quantité de matière $n_{e}$ d'électrons qui a circule pendant la même durée.
d) En déduire la masse du cuivre déposée
Exercice 6 : Nickelage d'un objet
On veut recouvrir de nickel un objet en cuivre par une électrolyse à « anode soluble ».
On se placera dans les conditions standards.
a) Écrire l'équation de la réaction entre les ions nickel $(II)$ et le cuivre avec les nombres stœchiométriques entiers les plus petits possibles.
b) Peut on recouvrir de nickel l'objet en cuivre en l'immergeant dans une solution de sulfate de nickel $\left((Ni^{2+}\;,\ SO_{4}^{2-}\right)$ ?
Justifier.
c) L'objet en cuivre est placé à la cathode de l'électrolyse et baigne dans une solution de sulfate de nickel $(II).$
L'autre électrode étant en nickel.
c) 1) Écrire les réactions pouvant se produire aux électrodes
c) 2) Quelle est l'électrolyse la plus facile à réaliser ?
À partir de quelle tension imposée par le générateur, peut-elle commencer ?
c) 3) Pourquoi l'électrolyse est dite à « anode soluble ».
Expliquer pourquoi l'objet à recouvrir est placé à la cathode.
d) Comment évolue la concentration des ions $Ni^{2+}$ et $SO_{4}^{2-}$ dans l'électrolyte ?
e) On dépose sur l'objet en cuivre, une masse de nickel de $6.23\,g.$
e) 1) Quelle quantité d'électricité doit traverser l'électrolyseur pour cela ?
e) 2) Quelle est la durée de l'électrolyse avec une intensité constante et égale à $2.0\,A$ ?
f) Quelle a été la variation de masse de l'électrode en nickel ?
Données : masses atomiques molaires $(g/mol)$ :
$Cu=63.5$ ; $Ni=58.7$
$E^{\circ}\left(Ni^{2+}/Ni\right)=-0.26\,V$ ;
$E^{\circ}\left(Cu^{2+}/Cu\right)=+0.34\,V$ ;
$E^{\circ}\left(S_{2}O_{8}^{2-}/SO_{4}^{2-}\right)=+2.01\,V$ ;
$E^{\circ}\left(O_{2}/H_{2}O\right)=+1.23\,V$ ;
$E^{\circ}\left(H_{2}O\text{ ou }H^{+}/H_{2}\right)=0.00\,V$
Exercice 7
On veut réaliser l'électrolyse d'une solution de sulfate de cuivre.
On dispose d'un générateur ;
d'une électrode en graphite ;
d'une électrode en cuivre ;
d'un interrupteur d'un ampèremètre.
1) a) Quelle électrode vais-je placer à la cathode ?
à l'anode ?
b) Quelle est la couleur de la solution de sulfate de cuivre ?
Quel est l'ion responsable de cette coloration ?
2) Fais le schéma du montage puis indique sur celui-ci l'anode, la cathode et les observations qu'on peut noter après un certain temps de fonctionnement
3) lorsque l'intensité du courant dans le circuit est voisine de $1.5\,A$, la masse de la cathode varie de $3\,cg$ par minute.
a) S'agit-il d'une augmentation ou d'une diminution ?
Justifier la réponse
b) Écris l'équation de la réaction qui a lieu
4) a) Au bout d'une heure de fonctionnement quelle sera cette variation ?
b) On note une variation de masse de $1.2\,g$ à la cathode. Pendant combien de temps s'est déroulé l'expérience ?
Exercice 8
L'Hermione est une frégate qui a transporté La Fayette aux États-Unis.
Construite en $1779$, elle a coulé en $1793$ au large des côtes françaises.
Les canons et l'ancre de cette épave ont été remontés à la surface en $2005$ et ont subi un traitement électrolytique de $45$ mois avant leur exposition à l'air libre.
Un technicien du laboratoire chargé de leur traitement explique :
« Exposées à l'air, ces pièces gorgées de sel seraient victimes de la corrosion si elles ne bénéficiaient d'un traitement par électrolyse qui dure plusieurs années et permet, dans un premier temps, de libérer l'objet de la gangue de sédiments et coquillages qui l'emprisonne, puis de supprimer les traces de sel, avant de le sécher et traiter pour qu'il se conserve parfaitement. »
Aide :
A leur sortie de l'eau, les vestiges sous-marins sont recouverts de concrétions atteignant plusieurs centimètres d'épaisseur formant une épaisse croûte (on parle d'une gangue) autour des objets.
Le schéma de principe du traitement est le suivant :
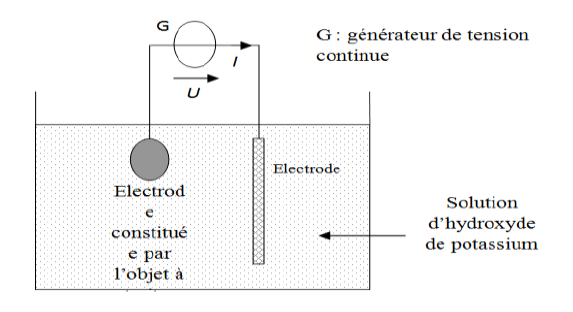
1) Le bain électrolytique est une solution d'hydroxyde de potassium.
L'hydroxyde de potassium est un solide qui, comme l'hydroxyde de sodium, est une base forte.
a) Donner la formule brute de l'hydroxyde de potassium.
b) Écrire le bilan de la réaction de dissolution de l'hydroxyde de potassium dans l'eau.
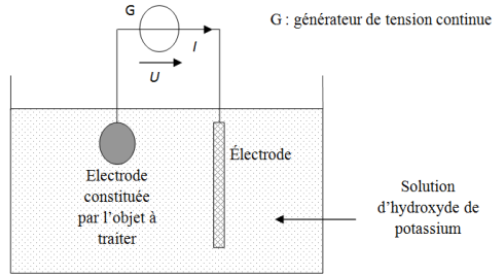
2) Compléter le document 2 du document-réponse en indiquant les polarités du générateur et le sens de déplacement des électrons.
3) La réaction se produisant à l'électrode reliée à la borne positive du générateur est-elle une oxydation ou une réduction ? Justifier la réponse.
4) A l'une des électrodes, on observe un dégagement de dihydrogène.
La pression exercée par le dihydrogène permet de décoller plus facilement la gangue.
a) Quelle est l'équation de la réaction électrochimique qui se produit à cette électrode ?
b) Écrire alors le bilan global de la réaction qui a eu lieu lors de la restauration de ces vestiges sachant que les couples oxydoréduction mis en jeu sont : $Cl_{2}/Cl^{-}$ et $H_{2}O/H_{2}$
Données :
Document 2 :
Indiquer les polarités et le sens de déplacement des électrons

Commentaires
Gael (non vérifié)
lun, 01/31/2022 - 07:20
Permalien
Je voudrais télécharger
Faysal Mourafiq (non vérifié)
jeu, 05/05/2022 - 01:32
Permalien
bonjour mon professeur, j'ai
Mfoumpu (non vérifié)
dim, 01/19/2025 - 06:40
Permalien
Comprend
Ajouter un commentaire