Série d'exercices : Les composés aromatiques - 1er s
Classe:
Première
Exercice 1
1. Nommer les composés aromatiques
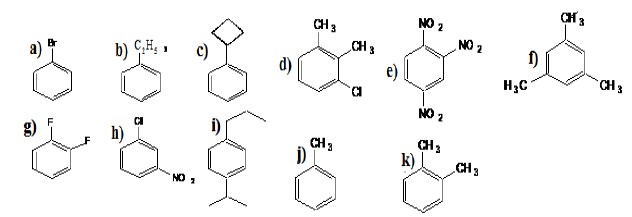
2. Donner la formule semi-développée des composés aromatiques
2.1 $1\;,\ 3.5-\text{triméthylbenzène}$
2.2 $1-$bromo$-4-$chlorobenzène
2.3 Fluorobenzène
2.4 $1.4-$dibromo$-2-$méthylbenzène
2.5. Hexylbenzène
Exercice 2
On considère un mélange de composés aromatiques renfermant le benzène et le styrène.
$1-\ $ Donner la formule développée du styrène.
$1-\ $ Dans $10\,cm^{3}$ du mélange, on introduit un peu de bromure de fer $III$ puis, goutte à goute et en agitant, du dibrome pur tant que la coloration brun-rouge ne persiste pas.
Le dégagement qui se produit est envoyé barboter dans une solution de nitrate d'argent, ou il provoque la formation d'un précipité blanc jaunâtre.
On admettra que les conditions opératoires ne permettent pas de polysubtitutions sur les noyaux benzéniques.
Le volume de dibrome versé est $V_{Br2}=8.4\,cm^{3}.$
Le précipité obtenu est filtré, séché et pesé ; sa masse est $m=19.1\,g$
a) Écrire les équations-bilan de toutes les réaction mises en jeu dans cette manipulation.
b) Déterminer les compositions molaire et volumique du mélange étudié.
c) Déterminer la masse volumique du styrène
Données :
Masse molaires en $g\cdot mol^{-1}$,
les masses molaires : $C\ :\ 12\;,\ H\ :\ 1\;,\ O\ :\ 16\;,\ N\ :\ 14\;,\ Ag\ :\ 108\;,\ Br\ :\ 80$
Masse volumique du benzène est : $\mu_{b}=880\,kg\cdot m^{-3}$
Masse volumique du dibrome : $\mu_{Br2}=3250\,kg\cdot m^{-3}$
Exercice 3
1) Le Xylène est le nom courant du diméthylbenzène.
Combien a-t-il d'isomère ?
Les nommer.
2) Le propène peut fixer une molécule de chlorure d'hydrogène.
Quelles sont les formules semi-développées des deux produits que l'on obtient ?
En fait, on obtient un seul corps : le plus symétrique des deux.
Donner son nom systématique.
3) Traité par le corps obtenu en 2) en présence de chlorure d'aluminium anhydre, le metaxylène donne réaction de substitution au cours de laquelle un groupe isopropyle $\left(CH_{3}\right)_{2}CH-$ remplace un atome d'hydrogène du cycle benzénique.
Combien d'isomères peut-on obtenir ?
Compte tenu de "l'encombrement" du groupe isopropyle quel sera l'isomère le plus abondant ?
4) La nitration de cet isomère conduit à un produit dont la composition massique centésimale est la suivante :
$C\ :\ 46.6\%\ ;\ H\ :\ 4.6\%\ ;\ N\ :\ 14.8\%\ ;\ O\ :\ 33.9\%.$
Détermine sa formule brute.
Sa masse molaire et sa formule semi-développée.
On donne : $M_{H}=1$ ; $M_{C}=12$ ; $M_{N}=14$ ; $M_{O}=16$ en $g/mol.$
Exercice 4
Le toluène de formule brute $C_{7}H_{8}$ est un composé aromatique.
C'est un liquide qui sert à la fabrication des colorants, des solvants et des explosifs tel que le $2\;,\ 4\;,\ 6-$trinitrotoluène connu sous le nom de $T.N.T.$
$1-\ $ Écrire les formules semi-développées du toluène et de $T.N.T$ puis donner le nom systématique du toluène.
$2-\ $ Le $T.N.T$ est synthétisé par action de l'acide nitrique $HNO_{3}$ sur le toluène en présence de l'acide sulfurique.
a) Écrire l'équation bilan de cette réaction.
Est-ce une réaction d'addition ou de substitution ?
b) Calculer la masse de toluène nécessaire à la synthèse de une tonne de $T.N.T.$
c) Lorsqu'il explose, le $T.N.T$ se décompose en donnant le diazote, la vapeur d'eau, le monoxyde de carbone et le carbone et un dégagement de chaleur.
Écrire l'équation bilan de la réaction d'explosion et calculer la masse de carbone produit par l'explosion de $100$ de $T.N.T.$
$3-\ $ A un mélange équimolaire de dichlore et de toluène dans un flacon placé à l'obscurité, on y ajoute le chlorure d'aluminium anhydre.
Le mélange de dichlore et de toluène d'un autre flacon $F_{1}$ exposé à la lumière contient un excès de dichlore.
a) Après la disparition de la coloration verte, on introduit dans chaque flacon le papier $pH.$
Qu'observe-t-on ?
b) Donner la formule semi-développée et le nom du composé organique formé dans le flacon $F_{2}$
Est-il un composé aromatique ?
c) Trois composés chlorés se forment dans le flacon $F_{1}.$
Écrire leurs formules semi-développées et les nommer
Données :
masse molaire moléculaire en $C\ :\ 12\;,\ H\ :\ 1.0\;,\ Cl\ :\ 35.5\;,\ O\ :\ 16\;,\ N\ :\ 14$
Exercice 5
Un composé $A$, de formule brute $C_{8}H_{10}$, possède les propriétés suivantes : en présence de brome, et avec du fer, $A$ donne un produit de substitution contenant $43\%$ de brome ; par hydrogénation de $A$, en présence d'un catalyseur on obtient $C_{8}H_{16}$
1) Que peut-on déduire, quant à la nature du produit ?
Montrer que l'action du brome est une monosubstitution
2) Proposer les différentes formules développées de $A$ et (il y en a quatre) et donner leurs noms
3) Afin de choisir et de préciser la formule développée de $A$, on effectue une déshydrogénation de $A$ en $B.$
Ce dernier corps a pour formule $C_{8}H_{8}$ et décolore l'eau de brome.
Préciser alors la formule de $B.$
4) On indique que $B$ est une styrène.
Préciser la formule de $A.$
5) Combien existe-il de dérivés monobromés de $A.$ (bromation sur le cycle aromatique) ?
Écrire les formules semi-développées de ceux-ci.
On donne les masses atomiques : $M_{Br}=80\,g\cdot mol^{-1}$ ; $M_{H}=1.0\,g\cdot mol^{-1}$ ; $M_{C}=12\,g\cdot mol^{-1}$
Exercice 6
On effectue la nitration du toluène (méthyl-benzène).
1) Dans les conditions de l'expérience on obtient un dérivé nitré, le trinitrotoluène (connu sous le nom de $T.N.T$).
Écrire l'équation-bilan de la réaction.
2) Quelle est la masse de toluène nécessaire pour obtenir une masse de $1\,Kg$ de trinitrotoluène, le rendement étant de $90\%.$
Exercice 7
En présence de chlorure d'aluminium, le benzène réagit sur le chloroéthane pour donner un dégagement de chlorure d'hydrogène et un hydrocarbure $A$, dont le pourcentage massique en en carbone est de $90.6\%.$
1) Quelle est la formule brute de $A$ ?
2) Écrire l'équation-bilan de la réaction et la formule développée de $A.$
Par chauffage en présence d'un catalyseur, $A$ se déshydrogène facilement en $B.$
Le produit obtenu comporte $92.3\%$ (en masse) de carbone.
Quelle est sa formule développée ?
Ce corps se polymérise très facilement.
3) Quel est le motif du polymère obtenu ?
Exercice 8
En présence de trace de chlorure d'aluminium anhydre utilisé comme catalyseur, le chlorure de méthyle réagit sur le noyau benzénique du benzène pour donner un composé plus connu sous le nom de toluène.
1) Écrire et compléter la réaction suivante en précisant le catalyseur :
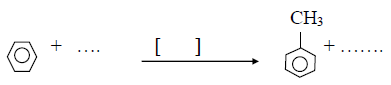
On procède à la combustion de $136\,g$ de toluène.
Quel est le volume d'air nécessaire si la combustion précédente se faisait à la température de $27^{\circ}C$ et à la pression normale ?
On rappelle que l'air contient $20\%$ d'oxygène.
Exercice 9
Par substitution du brome sur le benzène, on fabrique du $1.2–$dibromobenzène.
1) Écrire les deux réactions qui permettent d'aboutir à ce produit.
Préciser les conditions expérimentales.
On veut fabriquer une masse $m=5.0\,g$ de $1.2–$dibromobenzène.
Sachant que le rendement global de la réaction est égal à $40$, calculer :
2.1. La masse de benzène nécessaire.
2.2. Le volume de dibrome (supposé gazeux) utilisé.
Données :
$Br\ :\ 80\,g/mol\ ;\ C\ :\ 12\,g/mol\ ;\ H\ :\ 1\,g/mol\ ;\ V_{m}=24\,L/mol$
Exercice 10
Un hydrocarbure $A$, a pour formule brute $C_{9}H_{12}.$
$-\ $ Par hydrogénation, en présence d'un catalyseur, $A$ donne un corps de formule $C_{9}H_{18}.$
$-\ $ En présence de dibrome et de trichlorure d'aluminium, $A$ conduit à un produit de substitution $B$ contenant $40.2\%$ en masse de brome.
1) Montrer que $A$ renferme un noyau benzénique.
2) Montrer que le brome ne se substitue qu'une fois sur $A.$
3) Écrire toutes les formules semi-développées de $A.$
4) Il n'existe qu'un seul dérivé mononitré de $A.$
En déduire la formule semi-développée de $A.$

Commentaires
Ndeye (non vérifié)
jeu, 02/20/2020 - 20:20
Permalien
Demande
coly (non vérifié)
mar, 02/25/2020 - 01:47
Permalien
correction
Lelou (non vérifié)
sam, 04/03/2021 - 09:17
Permalien
Correction de l'exo 10
Sahou (non vérifié)
mer, 03/09/2022 - 10:40
Permalien
Correction exercice 10
Fulbert AHOUANTO (non vérifié)
dim, 12/08/2024 - 19:04
Permalien
Correction de l'exercice 10
Baba Thioune (non vérifié)
lun, 05/02/2022 - 03:17
Permalien
J'aimerais avoir la
Baba Thioune (non vérifié)
lun, 05/02/2022 - 03:17
Permalien
J'aimerais avoir la
Dié ndoumbé wade (non vérifié)
jeu, 05/05/2022 - 21:23
Permalien
Les corrections
Edouard Keïta (non vérifié)
jeu, 02/29/2024 - 16:04
Permalien
Élève
Edouard Keïta (non vérifié)
jeu, 02/29/2024 - 16:04
Permalien
Élève
Sabiou yassey (non vérifié)
sam, 03/02/2024 - 23:00
Permalien
Correction des exercices
Sabiou yassey (non vérifié)
sam, 03/02/2024 - 23:00
Permalien
Correction des exercices
Gansonré (non vérifié)
lun, 02/24/2025 - 23:10
Permalien
Aziz
Al Amine (non vérifié)
dim, 02/05/2023 - 15:05
Permalien
Élève
Ousseynou Gueye (non vérifié)
sam, 02/25/2023 - 13:32
Permalien
Correction exo 10
charifa (non vérifié)
mer, 02/22/2023 - 18:16
Permalien
correction
Ane (non vérifié)
mer, 11/22/2023 - 18:39
Permalien
La correction de l'exercice 10
Hachiringasi (non vérifié)
ven, 06/07/2024 - 15:13
Permalien
Correction
Ndeye Anta guiro (non vérifié)
jeu, 04/10/2025 - 23:04
Permalien
Je veux la correction de l’exercice 10et 5
Coulibaly lamine (non vérifié)
lun, 01/13/2025 - 07:51
Permalien
Pour avoir le procédé des
RODRINA (non vérifié)
lun, 02/17/2025 - 17:51
Permalien
Devoir
Lomez (non vérifié)
ven, 03/20/2020 - 22:51
Permalien
Duaw
laura (non vérifié)
jeu, 04/30/2020 - 10:48
Permalien
je voudrais avoir le corrigé
Marie Rose Diatta (non vérifié)
mer, 06/16/2021 - 22:48
Permalien
Pc
Kadiatou (non vérifié)
lun, 06/27/2022 - 00:01
Permalien
Exercice 2
Kadiatou (non vérifié)
lun, 06/27/2022 - 00:01
Permalien
Exercice 2
Amir (non vérifié)
dim, 03/20/2022 - 23:44
Permalien
Demande de correction
Haboubacar yahaya (non vérifié)
sam, 02/13/2021 - 12:26
Permalien
Être un étudiant sur le domaine de sciences
Souleymane Mous... (non vérifié)
sam, 03/20/2021 - 08:37
Permalien
Connais
cheick (non vérifié)
jeu, 02/10/2022 - 12:33
Permalien
correction
Traoré (non vérifié)
sam, 03/05/2022 - 20:00
Permalien
Première D
Boureïma oumaro... (non vérifié)
sam, 03/12/2022 - 21:06
Permalien
Multiplier ma connaissance
Amadou (non vérifié)
dim, 04/17/2022 - 03:16
Permalien
Savoir
Sokhna mouhamed... (non vérifié)
lun, 05/09/2022 - 07:05
Permalien
Pc
Abson (non vérifié)
mar, 05/24/2022 - 19:44
Permalien
Correction exercice7
DOSSO Moussa (non vérifié)
lun, 12/18/2023 - 07:04
Permalien
Je veux la correction de l'exercice 7
mahamedinoussz@... (non vérifié)
jeu, 12/01/2022 - 06:15
Permalien
Étude
Sambe (non vérifié)
dim, 02/05/2023 - 20:21
Permalien
Correction des exos
Boureima Kailou... (non vérifié)
dim, 06/01/2025 - 12:09
Permalien
Correction d'exercices sur Benzène
Guissou (non vérifié)
jeu, 02/16/2023 - 16:07
Permalien
Corrigé d'exercice
Gallo Murphy (non vérifié)
jeu, 03/16/2023 - 21:43
Permalien
oui
Massa (non vérifié)
dim, 11/19/2023 - 21:19
Permalien
J'aimerais avoir la correction de l'exercice 1
Claire (non vérifié)
mer, 01/17/2024 - 21:35
Permalien
Réponse
Amany Charles (non vérifié)
mer, 01/24/2024 - 12:47
Permalien
Corrigé du chapitre benzène
Amadou (non vérifié)
dim, 02/25/2024 - 13:58
Permalien
Comprendre
Mamyta diallo (non vérifié)
ven, 03/08/2024 - 07:41
Permalien
Étude
Sia (non vérifié)
sam, 02/17/2024 - 18:32
Permalien
je demande correction de l'exercice
Amadou (non vérifié)
dim, 02/25/2024 - 13:56
Permalien
Comprendre
Dieynaba Kane (non vérifié)
dim, 03/24/2024 - 23:11
Permalien
Élève
kouame (non vérifié)
jeu, 02/20/2020 - 21:13
Permalien
devoir de pc ressort 1ereC énergie potentielle et mécaniques
Pages
Ajouter un commentaire