Série d'exercices sur Acide fort - base forte Réaction acide fort - base forte - Ts
Classe:
Terminale
Exercice 1
La combustion complète d'un échantillon d'acide butyrique $(A)$ de masse $m=1.35\,g$ fournit $2.7\,g$ de dioxyde de carbone $CO_{2}$ et $1.1\,g$ d'eau.
1) Calculer la masse de carbone d'hydrogène et d'oxygène contenue dans cette échantillon.
2) a) En déduire la composition massique centésimale (pourcentage de carbone, d'hydrogène et d'oxygène)
b) Montrer que la formule brute de $(A)$ est $C_{4}H_{8}O_{2}$, sachant que sa masse molaire est $M=88g\cdot mol^{-1}$
3) Une solution aqueuse $(s)$ obtenue en faisant dissoudre $0.1\,mol$ d'acide butyrique (acide faible) dans $500\,mL$ d'eau.
a) Rappeler la définition d'un acide de Bronsted
b) Écrire l'équation chimique de la réaction de cet acide dans l'eau
c) Quels sont les comptes acide base mis en jeu ?
d) Calculer la concentration molaire $C$ de la solution obtenue.
On donne :
$M_{H}=1\,g\cdot mol^{-1}$ ; $M_{c}=12\,g\cdot mol^{-1}$ ; $M_{O}=16\,g\cdot mol^{-1}.$
Exercice 2
on souhaite préparer $100\,mL$ d'une solution $S_{0}$ d'acide benzoique $C_{6}H_{5}COOH$ de concentration molaire volumique $C_{0}=0.1\,mol\cdot L^{-1}$
1) Déterminer la masse de cristaux à peser pour préparer $S_{0}.$
2) La solution $S_{0}$ a un $pH=2.6$
a) Écrire l'équation bilan de la réaction de l'acide benzoique avec l'eau.
Monter que cet acide n'est pas un acide fort.
b) Déterminer le coefficient de dissociation $\alpha_{0}=\dfrac{\left[C_{6}H_{5}COO^{-}\right]}{C_{0}}$ de l'acide dans $S_{0}.$
3) On réalise une solution $S_{1}$ par dilution au $1/10$ de la solution $S_{0}.$
$S_{1}$ a un $pH=3.1.$
En déduire le coefficient $\alpha_{1}$ de l'acide dans la solution $S_{1}$ et conclure.
Exercice 3
Les mesures sont effectuées à $25^{\circ}C.$
Couples acide/base :
acide benzoique/ion benzoate : $pKa=4.2$
couples de l'eau : $H_{2}O/HO^{-}\ :\ pKa=14$
Étude du couple acide benzoique/ion benzoate : $C_{6}H_{5}COOH/C_{6}H_{5}COO^{-}.$
1) On mesure le $pH$ d'une solution $S_{1}$ d'acide benzoique de concentration $c_{1}=1.0\cdot 10^{-2}mol\cdot L^{-1}.$
Le $pH-$mètre indique $3.1.$
a) Pourquoi cette mesure permet-elle d'affirmer que l'acide benzoique est un acide faible dans l'eau ?
Justifier.
b) Écrire l'équation-bilan de la réaction de l'acide benzoique avec l'eau.
Donner l'expression de la constante d'acidité du couple considéré.
2) On mesure ensuite le $pH$ d'une solution $S_{2}$ de benzoate de sodium de concentration $c_{2}=1.0\cdot 10^{-2}mol\cdot L^{-1}.$
On trouve $pH=8.1.$
Le benzoate de sodium $\left(C_{6}H_{5}COONa\right)$ est un corps pur ionique dont les ions se dispersent totalement en solution.
a) Pourquoi la mesure du $pH$ réalisée permet-elle d'affirmer que l'ion benzoate est une base faible dans l'eau ?
Justifier.
b) Écrire l'équation-bilan de la réaction de l'ion benzoate avec l'eau.
Exprimer la constante de cette réaction et calculer sa valeur.
3) On ajoute à la solution $S_{1}$ quelques gouttes d'une solution de soude.
Le $pH$ prend alors la valeur $5.2.$
a) Indiquer, sans calcul, en utilisant une échelle de $pH$, quelle est l'espèce du couple qui prédomine dans la solution obtenue.
b) Noter, sur une échelle des $pKa$, les différents couples acide/base qui interviennent dans la solution $S_{1}$ et dans la solution de soude.
c) Écrire l'équation- bilan de la réaction acide/base qui se produit lors du mélange de la solution $S_{1}$ et de la solution de soude.
$-\ $ Calculer la constante de cette réaction.
$-\ $ En déduire si la réaction peut être considérée ou non comme totale.
4) On réalise une solution $S$ en mélangeant $20\,cm^{3}$ de solution $S_{1}$ et $20\,cm^{3}$ de solution $S_{2}.$
A partir de la réaction se produisent lors du mélange, déduire, sans calcul, que la concentration de l'acide benzoique, dans la solution $S$, est égale à celle de sa base conjuguée.
En déduire la valeur du $pH$ de la solution $S.$
Exercice 4
On donne $M(C)=12\,g\cdot mol^{-1}$, $M(H)=1\,g\cdot mol^{-1}$ et $M(O)=16\,g\cdot mol^{-1}.$
Un acide carboxylique $(A)$ à chaine linéaire, de masse molaire $M=88\,g\cdot mol^{-1}.$
1) a) Donner la formule brute d'un acide carboxylique et montrer que sa masse molaire s'écrit sous la forme $M=14n+32$ avec $n$ est le nombre de carbone contenu dans sa formule.
b) Déterminer la formule semi- développée et le nom de chaque isomère acide de $(A).$
2) L'isomère à chaine ramifié de $(A)$ est obtenu par une réaction chimique à partir d'un alcool $(B).$
a) Donner le nom de la réaction.
b) Écrire l'équation chimique de cette réaction.
c) Donner le nom de l'ester formé.
4) On dissout une masse $m$ d'acide $(A)$ dans de l'eau distillée afin de préparer $100\,mL$ de solution de concentration molaire $C=0.01\,mol\cdot L^{-1}.$
En mesurant le $pH$ de cette solution, on trouve qu'il est égal à $3.9.$
Calculer la masse $m.$
b) Calculer la concentration en ions $H_{3}O^{+}.$
L'acide $(A)$ est-il faible ou fort ?
On rappelle que $\left[H_{3}O^{+}\right]=10^{-pH}$
c) Écrire l'équation de dissolution de l'acide $(A)$ dans l'eau.
Exercice 5
On dispose du matériel et des produits suivants :
$-\ $ Pipettes de $5\,mL$, $10\,mL$ et $2\,mL$
$-\ $ Fioles jaugées de $500\,mL$, $250\,mL$ et $100\,mL$
$-\ $ Une solution de méthylamine de concentration $C_{1}.$
$-\ $ Une solution de base $B$ de concentration $C_{2}.$
$-\ $ Eau distillée - des flacons
Deux flacons $A$ et $B$ contenant l'un une solution $S_{1}$ de méthylamine et l'autre une solution $S_{2}$ de base $B.$
La mesure de $pH$ de la solution $S_{1}$ donne $pH_{1}=11.85$ et celui de $S_{2}$ est $pH_{2}=12.$
Afin de connaitre la force de chaque base, on effectue un prélèvement de chaque flacon que l'on soumet à une dilution au dixième.
La mesure des $pH$ donne $pH_{1}=11.35$ et celui de $pH_{2}=11.$
1) a) Montrer, en le justifiant que le méthylamine est une base faible alors que $B$ est une base forte.
b) Calculer $C_{2}.$
c) Déduire la démarche expérimentale à suivre, en précisant le matériel choisit pour effectuer la dilution au dixième.
2) Établir que le $pH$ de la solution $S_{1}$ vérifie la relation suivante $pH=\dfrac{1}{2}(pKa+pKe+log\,C).$
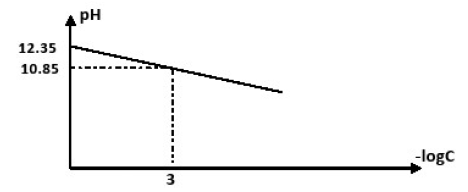
3) A l'aide d'un protocole expérimentale, on mesure le $pH$ d'une solution aqueuse de méthylamine pour différentes valeurs de sa concentration $C.$
Les résultats des mesures permettent de tracer la courbe $pH=f(-log\,C).$
Déduire de cette courbe la valeur de $pKa$ du couple $CH_{3}NH_{3}^{+}/CH_{3}NH_{2}$ ainsi que la concentration $C$ de la solution $S.$
Exercice 6
On considère quatre solutions acides, de même concentration $C=10^{-2}mol/L.$
Les $pH$ de ces solutions, mesurés à $25^{\circ}C$ sont indiqués dans le tableau suivant :
$$\begin{array}{|c|c|c|c|c|} \hline \text{Solution d'acide}&A_{1}H&A_{2}H&A_{3}H&A_{4}H\\ \hline pH&3.4&2&5.6&2.9\\ \hline \end{array}$$
1) a) Qu'appelle-t-on acide fort ?
Qu'appelle-t-on acide faible ?
b) En utilisant le tableau ci-dessus, préciser le(s) acide(s) faible(s) et le(s) acide(s) fort(s).
2) a) Pour chaque acide faible, calculer le coefficient de dissociation de l'acide dans l'eau.
Classer ces acides, selon leur force.
b) Écrire une relation entre la constante d'acidité $Ka$ du couple $AH/A^{-}$ et le coefficient de dissociation de l'acide dans l'eau.
c) Calculer la constante d'acidité $Ka$ de chaque acide faible.
Classer respectivement ces acides selon leur $Ka$ respectives.
3) on dilue $10$ fois la solutions $n^{\circ}1$ le $PH$ alors égale à $3.9.$
Quelle est la nouvelle valeur du coefficient de dissociation de l'acide $A_{1}H$
Comparer au coefficient de dissociation de l'acide $A_{1}H/A_{1}^{-}.$
Exercice 7
On prépare un volume $V_{1}=200\,mL$ d'une solution aqueuse $S$ d'hypo chlorate de sodium $ClONa$ de concentration $C_{0}=10^{-1}\,mol\cdot L^{-1}$, en dissolvant une masse $m$ de ce sel dans l'eau.
Le $pH$ de la solution obtenue est $pH_{0}=9.75.$
1) Déterminer la masse $m.$
$\left(M_{Cl}=35.5\ ;\ M_{O}=16\text{ et }M_{Na}=23\text{ en }g\cdot mol^{-1}\right).$
Écrire l'équation de la réaction qui accompagne la dissolution.
4) Donner l'expression de $K_{b}$ en fonction de $Ke$, $pH_{0}$ et $C_{0}$ puis calculer sa valeur.
5) On prélève un volume $v_{0}=10\,mL$ et on ajoute un volume $V$ d'eau.
Soit $C$ la concentration de la nouvelle solution.
a) Donner une relation entre $C$, $C_{0}$, $V_{0}$ et $V.$
b) Montrer que $pH=pH_{0}-\dfrac{1}{2}\log\left(1+\dfrac{V}{V_{0}}\right).$
c) Calculer le $pH$ de la solution pour $V=90\,mL$ et en déduire les concentrations de $ClO^{-}$ et $HClO.$
Exercice 8
Après plusieurs heures de pédalage sous la pluie, le groupe décide de s'arrêter déjeuner dans une auberge.
1. Il y a sur la table une bouteille d'eau et un soda.
Le $pH$ de l'eau minérale indiqué sur l'étiquette est $6.3.$
1.1 Montrer que la concentration en ion oxonium $[H_{3}O^{+}]$ de cette eau minérale est voisine de $5.0\cdot 10^{-7}mol\cdot L^{-1}.$
1.2 Calculer la quantité de matière d'ion oxonium $n(H_{3}O^{+})$ contenue dans cette bouteille de volume $V=1.5\,L.$
2. Sur l'étiquette du soda on peut lire, entre autre : conservateur : benzoate de sodium.
L'ion benzoate $C_{6}H_{5}-COO^{-}$ est une base, il fait partie du couple "acide benzoique/ion benzoate" dont le $pKa$ est $4.2.$
2.1 Donner la définition d'une base selon Bronsted.
2.2 Écrire la réaction susceptible de se produire entre l'ion benzoate et l'eau.
Nommer les produits obtenus.
2.3 Donner l'expression littérale de la constante d'acidité du couple acide benzoique/ion benzoate.
2.4 Le $pKa$ de ce couple est $4.2.$
Représenter sur un axe gradué en $pH$, le diagramme de prédominance de l'acide benzoique et de l'ion benzoate.
2.5 Le $pH$ de l'estomac est égal à $2.$
En s'aidant du diagramme précédent, dire ce qu'il advient de l'ion benzoate lorsque Rémi a avalé la boisson.
Reste-t-il sous forme d'ion benzoate ou se transforme-t-il en acide benzoique ?
Justifier.
Le repas étant très copieux, le restaurateur propose à Rémi une boisson facilitant la digestion en oubliant de lui dire qu'elle contient de l'alcool.
Rémi accepte...
Exercice 9
Toutes les solutions sont prises à $25^{\circ}C$, température à laquelle le produit ionique de l'eau pure est $Ke=10^{-14}.$
En dissolvant chacune des trois bases $B_{1}$, $B_{2}$ et $B_{3}$ dans de l'eau pure, on prépare respectivement trois solutions aqueuses basiques $(S_{1})$, $(S_{2})$ et $(S_{3})$ de concentrations initiales identiques $C_{1}=C_{2}= C_{3}.$
On oublie de coller une étiquette portant le nom de la solution sur chaque flacon.
Seule l'une des bases correspond à une base forte (l'hydroxyde de sodium $NaOH$).
Chacune des deux autres étant une base faible.
Pour identifier chaque solution, on mesure son $pH$ et on porte les résultats dans le tableau suivant :
$$\begin{array}{|c|c|c|c|} \hline &(S_{1})&(S_{2})&(S_{3})\\ \hline pH&11.1&13&10.6\\ \hline \end{array}$$
1) a) Classer les bases $B_{1}$, $B_{2}$ et $B_{3}$ par ordre de force croissance ; justifier le choix adopté.
b) En déduire celle des trois bases qui correspond à $NaOH$ ; déterminer la valeur de la concentration de sa solution.
2) a) Exprimer le $pKa$ d'une solution de base faible $B$ en fonction de son $pH$, de sa concentration initiale $c$ et du $pKe.$
$B$ est l'une des deux bases faibles utilisées dans l'expression décrite ci-dessus.
On supposera que, suite à la dissolution, la concentration de la base restante est pratiquement égale à $c.$
b) Calculer le $pKa$ de chacune des deux bases faibles.
c) Identifier chacune des deux bases faibles en utilisant la liste des valeurs de $pKa$ de quelques bases consignées dans le tableau suivant :
$$\begin{array}{|c|c|c|c|c|c|} \hline &\text{Aziridine}&\text{Morphine}&\text{Ammoniac}&\text{Ephedrine}&\text{Ethylamine}\\ \hline pKa&8.01&8.21&9.25&996&10.7\\ \hline \end{array}$$
Exercice 10
A. Pour déboucher les canalisations, on utilise des produits domestiques qui sont des solutions concentrées d'hydroxyde de sodium (ou soude).
Sur l'étiquette de l'un de ces produits, on lit
$-\ $ densité : $d=l.2$ (soit une masse volumique $p=l.2g\cdot cm^{–3}$,
$-\ $ contient $20\%$ en masse de soude.
1. Montrer que la concentration molaire $C$ de la solution commerciale est voisine de $6mol\cdot L^{–1}$
2. Quel volume de solution commerciale faut-il prélever pour obtenir $1L$ de solution diluée de concentration $C_{1}=3\times 10^{–2}mol\cdot L^{-1}$ ?
3. Quel volume de solution commerciale faut-il prélever pour obtenir $1L$ de solution diluée de concentration $C_{1}=3\times 10^{–2}mol\cdot L^{-1}$ ?
B. Les solutions de soude sont des solutions de base forte.
1.1 Rappeler la définition d'une base forte.
1.2 Calculer le $pH$ de la solution diluée.
Pour vérifier sa concentration, on dose $5mL$ de la solution diluée par une solution d'acide chlorhydrique de concentration $C_{a}=10^{–2}mol\cdot L^{–1}.$
2.1 Écrire l'équation-bilan de la réaction.
2.2 Pour obtenir l'équivalence, on doit verser $15mL$ de la solution d'acide chlorhydrique.
Calculer la concentration de la solution diluée.
Retrouve-t-on la valeur souhaitée ?
Masses atomiques (molaires) :
Oxygène : $16g\cdot mol^{–1}$ ;
Hydrogène : $1g\cdot mol^{–1}$ ;
Sodium : $23g\cdot mol^{–1}$
Exercice 11
N.B :
Toutes les solutions sont considérées à $25^{\circ}C$ où $[H_{3}O^{+}][OH^{-}]=10^{-14}$
1. Qu'appelle-t-on base forte ?
2. On prépare une solution d'hydroxyde de sodium $NaOH$ (base forte) en faisant dissoudre une masse $m$ de $NaOH$ dans l'eau pure de façon à obtenir $2L$ de solution $S.$
2.1 Écrire l'équation de la dissolution du solide dans l'eau.
2.2 Quelles sont les entités chimiques présentes dans la solution ?
2.3 Comment peut-on mettre en évidence expérimentalement le caractère basique de la solution.
2.4 A l'aide d'un $pH-$mètre on mesure le $pH$ de la solution, on trouve $pH=11$
Calculer la concentration molaire de toutes les entités chimiques présentes en solution.
2.5 Quelle est la concentration molaire $C$ de la solution.
Calculer alors $m$.
On donne : $M_{Na}=23g\cdot mol^{-1}$ ;
$M_{O}=16g\cdot mol^{-1}$ ;
$M_{H}=1g\cdot mol^{-1}$
3. A partir de la solution précédente, on veut obtenir un litre d'une solution $S'$ d'hydroxyde de sodium de $pH=10$ et de concentration $C'.$
3.1 Calculer la concentration molaire $C'$ de la solution $S'.$
3.2 Indiquer d'une façon précise comment doit-on opérer pour préparer la solution $S'$
Exercice 12
On dispose d'une solution d'acide sulfurique $S_{0}$ de concentration molaire $C_{0}=2mol\cdot L^{-1}$
A partir de la solution $S_{0}$, on veut préparer une solution $S_{1}$ de concentration $C_{1}=0.2 mol\cdot L^{-1}$ et volume $V_{1}$
Sur la paillasse, on dispose du matériel suivant : deux pipettes jaugées (avec des propipettes) de $10mL$ et $20mL$ ; deux béchers de $150mL$ et $200mL$ ; une pissette de $300mL$ ; une fiole jaugée de $200mL$ ; une burette de $50mL$ et tous les autres produits nécessaires
1. Calculer le volume $V_{0}$ de la solution $S_{0}$ à prélever pour un volume $V_{1}=200mL$ de la solution de $S_{1}$
2. Décrire brièvement le mode opératoire de cette opération
3. On veut vérifier la concentration des ions hydroniums dans cette par dosage à l'aide d'une solution d'hydroxyde de sodium $S_{2}$ de concentration $C_{2}=0.2 mol\cdot L^{-1}$
Pour cela, on prélève $10mL$ de la solution $S_{1}$
3.1 Faire le schéma simplifié du dispositif de dosage expérimental utilisé pour ce dosage
3.2 On introduit quelques gouttes de phénolphtaléine dans l'échantillon de $S_{1}$ prélevé
3.2.1 Quelle est la couleur de la solution ?
3.2.2 Comment repère-t-on l'équivalence au cours du dosage ?
3.2.3 La zone de virage d'un indicateur coloré est située entre $pH=3.2$ et $pH=4.4$
Cet indicateur peut-il être utilisé dans ce dosage ?
Justifier
3.3 On obtient l'équivalence lorsqu'on a versé $20mL$ de solution $S_{2}$
3.3.1 Quelle est la concentration molaire des ions hydroniums ?
3.3.2 Ce résultat était-il prévisible ?
Justifier la réponse
Exercice 13
Mélange de solution d'acide chlorhydrique et de potasse
On dispose au laboratoire des solutions suivantes :
Solution A : solution aqueuse d'acide chlorhydrique de concentration molaire $C_{a}$
Solution B : solution aqueuse d'hydroxyde de potassium de concentration molaire $C_{b}$
Un volume $V_{A}$ de la solution $A$ est obtenu en mettant en solution un volume $V'_{A}$ de chlorure d'hydrogène gazeux.
Le volume molaire gazeux est noté $V_{m}$ dans les conditions de l'expérience
Le volume $V_{B}$ de solution $B$ est obtenu en mettant en solution une masse $m_{B}$ d'hydroxyde de potassium
Données :
$V_{A}=100L$ ;
$V'_{A}=100 L$ ;
$m_{B}=11.2g$ ;
$V_{B}=10 L$ ;
$V_{m}=25L/mol$
Masse atomique $(g/mol)$
$K=39$ ;
$O=16$ ;
$H=1.$
Produit ionique de l'eau $K_{e}=10^{14}$ à $25^{\circ}C$
1. Exprimer littéralement puis calculer $C_{A}$
2. Exprimer littéralement puis calculer $C_{B}$
3. On mélange le tiers de $V_{A}$ au quart de $V_{B}$
$-\ $ Écrire les équations de mise en solution aqueuse du solide et du gaz, solutés des solutions ; l'équation bilan de la réaction se produisant dans le mélange
$-\ $ Définir l'équivalence acido-basique.
Le mélange est-il à l'équivalence ?
Justifier.
$-\ $ Ce mélange à $25^{\circ}C$ est-il acide ou basique ?
Justifier
Mélangeons cette fois un volume $V_{1}$ de la solution $A$ et un volume $V_{2}$ de la solution $B$ tels que :
$V_{2}=x\,V_{1}$ et que le $pH$ du mélange soit $12$ à $25^{\circ}C.$
4. Mélangeons cette fois un volume $V_{1}$ de la solution $A$ et un volume $V_{2}$ de la solution $B$ tels que $V_{2}=x\,V_{1}$ et que le $pH$ du mélange soit $12$ à $25°C$.
$-\ $ Calculer $x$
$-\ $ Dans le cas de cette dernière préparation quel est le plus grand volume de mélange possible ?
Exercice 14
On mélange un volume $V_{A}$ d'une solution d'acide chlorhydrique $\left(H_{3}O^{+}+Cl^{-}\right)$ de concentration molaire $C_{A}$ ayant un $pH_{A}$ avec un volume $V_{B}$ d'une solution d'hydroxyde de sodium $\left(Na^{+}+OH^{-}\right)$ de concentration molaire $C_{B}$ ayant un $pH_{B}.$
a) Réaliser le bilan de matière des ions hydronium et hydroxyde.
b) Calculer leur concentration molaire dans la solution après la réaction de neutralisation.
c) En déduire le $pH$ de la solution obtenue.
Montrer que celui-ci est :
$-\ \ pH=7$, dans le cas d'une réaction totale et stœchiométrique.
$-\ \ pH=-\log\left(\dfrac{C_{A}V_{A}-C_{B}V_{B}}{V_{A}+V_{B}}\right)$, dans le cas d'un excès de la solution acide.
$-\ \ pH=14+\log\left(\dfrac{C_{B}V_{B}-C_{A}V_{A}}{V_{B}+V_{A}}\right)$, dans le cas d'un excès de la solution basique.
d) Calculer la concentration molaire des ions sodium et des ions chlorure qui sont restés dans la solution dans les trois cas
1) $V_{A}=200mL$, $pH_{A}=2.0$
et $V_{B}=200mL$, $pH_{B}=12.0.$
2) $V_{A}=800mL$, $pH_{A}=2.0$
et $V_{B}=500 mL$, $pH_{B}=12.0.$
3) $V_{A}=300mL$, $pH_{A}=2.0$
et $V_{B}=200mL$, $pH_{B}=12.3.$
Exercice 15
On dispose de deux solutions aqueuses de concentration molaire $C$ dans des récipients sur les quels manquent des étiquettes : $C=1.10^{-3}mol\cdot L^{-1}.$
On dispose également d'étiquettes sur lesquelles sont inscrites les indications suivantes :
$H_{3}O^{+}$ ; $Cl^{-})$ et $Na^{+}$ ; $OH.$
a) Calculer les $pH$ théoriques d'une solution d'acide chlorhydrique et d'une solution d'hydroxyde de sodium de même concentration $C.$
On désire retrouver par des mesures de $pH$ à quel flacon correspond chaque étiquette.
On obtient les mesures suivantes :
$$\begin{array}{|c|c|c|} \hline \text{Flacon}&n^{\circ}1&n^{\circ}2\\ \hline pH\text{ mesuré}&2.90&11.2\\ \hline \end{array}$$
b) Indiquer, pour chaque flacon, l'étiquette qui lui correspond
Exercice 16
On verse dans $v_{a}=200cm^{3}$ d'acide chlorhydrique une solution de soude $(c_{b}=0.5mol/L).$
On mesure le $pH$ en fonction du volume $v_{b}$ de soude versé
$$\begin{array}{|c|c|c|c|c|c|c|c|c|c|c|c|c|c|c|c|} \hline V(cm^{3})&0&1.0&2.0&2.5&3.0&4.0&4.5&4.9&5.0&5.1&5.5&6.0&6.0&10.0&12.0\\ \hline &1.9&2.0&2.1&2.2&2.3&2.6&2.9&3.6&5.1&10.3&11.0&11.3&11.6&11.8&11.9\\ \hline \end{array}$$
1. Tracer la courbe $pH=f(vb)$ : $1cm$ pour $1$ unité $pH$ et $2cm$ pour $1 cm^{3}$
2. Déterminer le point d'équivalence par la méthode des tangentes.
Quel est le $pH$ à l'équivalence ?
3. En déduire la concentration cade la solution d'acide.
4. Calculer les diverses concentrations pour $v_{b}=3cm^{3}$

Commentaires
Procore (non vérifié)
mar, 07/14/2020 - 23:31
Permalien
Recherche du Bac
1 (non vérifié)
sam, 11/12/2022 - 14:45
Permalien
7
Anonyme (non vérifié)
sam, 11/12/2022 - 14:46
Permalien
Comment traiter les exercices
Memel (non vérifié)
jeu, 03/02/2023 - 07:34
Permalien
Élève
Mbaye FAYE (non vérifié)
sam, 06/28/2025 - 12:38
Permalien
Révision
Ajouter un commentaire