Solutions aqueuses basiques - 2nd S
Classe:
Seconde
L'étude de la solution d'acide chlorhydrique a permis de dégager les propriétés communes aux solutions acides.
De même, les propriétés communes des solutions basiques peuvent être mises en évidence à partir de l'étude de la solution aqueuse d'hydroxyde de sodium
I. Solutions basiques
1. L'hydroxyde de sodium
L'hydroxyde de sodium pur est appelé soude caustique.
Dans les conditions normales, il se trouve sous forme solide cristalline.
C'est un corps chimique minéral composé de formule chimique $NaOH$, qui est à température ambiante un solide ionique.
Il est fusible vers $318^{\circ}C$, il se présente généralement sous forme de pastilles, de paillettes ou de billes blanches ou d'aspect translucide, corrosives.
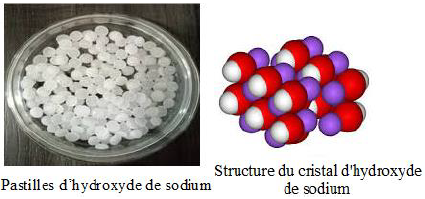
Il est très hygroscopique : il a tendance à absorber l'humidité de l'air, Il prend un aspect sirupeux (de la consistance du sirop).
On dit que l'hydroxyde de sodium est déliquescent
2. Solution d'hydroxyde de sodium
La dissolution de l'hydroxyde de sodium dans l'eau constitue la solution d'hydroxyde de sodium et s'accompagne de dégagement de chaleur.
On dit qu'elle est exothermique.
Cette dissolution se traduit par la dispersion et la solvatation des $Na^{+}$ et $OH^{-}$ selon l'équation de mise en solution :
$$NaOH\stackrel{Eau}\longrightarrow Na^{+}\ +\ OH^{-}$$
3. Électrolyse de la solution d'hydroxyde de sodium
3.1 Expérience
Considérons le circuit électrique ci-dessous
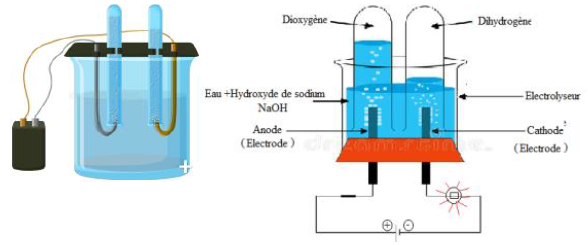
Plaçons de l'eau distillée dans l'électrolyseur et fermons l'interrupteur.
La lampe ne brille pas
Remplaçons l'eau distillée par une solution aqueuse d'hydroxyde de sodium et fermons l'interrupteur.
La lampe brille et on observe des dégagements gazeux au niveau des électrodes :
$-\ $ à la cathode, du dihydrogène, qui produit une faible détonation en présence de la flamme d'une allumette ;
$-\ $ à l'anode du dioxygène, qui produit une faible détonation en présence de la flamme d'une allumette
3.2 Interprétation
L'eau distillée versée dans un électrolyseur conduit faiblement le courant électrique (lampe éteinte)
En revanche, la solution aqueuse d'hydroxyde de sodium est conductrice : elle est un électrolyte.
Elle contient donc des ions
II. Propriétés liées à l'ion hydroxyde
1. Action sur les indicateurs colorés
Introduisons quelques gouttes d'indicateur coloré, dans deux tubes respectivement de l'eau distillée, une solution aqueuse chlorure de sodium (tubes témoins), d'autre part dans un tube contenant une solution aqueuse d'hydroxyde de sodium
$$\begin{array}{|l|l|l|l|} \hline &\text{Eau distillée}&\text{solution chlorure}&\text{solution d’hydroxyde}\\& &\text{de sodium}&\text{de sodium}\\\hline \text{Hélianthine}&\text{Orange}&\text{Orange}&\text{Jaune}\\ \hline BBT&\text{Vert}&\text{Vert}&\text{Bleu}\\ \hline \text{Phénolphtaléine}&\text{Rose}&\text{Rose}&\text{Violette}\\ \hline \end{array}$$
On observe que les indicateurs colorés ont la même couleur dans une solution de chlorure de sodium que dans l'eau distillée.
Ce ne sont donc point les ions $Na^{+}$ qui provoquent le changement de couleur des indicateurs
Le changement de couleur des indicateurs colorés est dû à la présence des ions hydroxyde $OH$
Les solutions qui font virer les indicateurs colorés comme la solution d'hydroxyde de sodium sont appelées solutions basiques
Le caractère basique de ces solutions est dû à la présence des ions $OH$
L'hydroxyde de sodium est totalement ionisé en solution.
C'est une base forte
Remarques
$-\ $ ions $OH^{-}$ peuvent caractérisés par des indicateurs colorés
$-\ $ La couleur jaune de la flamme permet d'identifier les ions $Na^{+}$
2. Action sur certains cations métalliques
L'ion hydroxyde $OH^{-}$ réagit avec les cations pour donner des hydroxydes métalliques
Les équations des réactions s'écrivent :
$Fe^{2+}\ +\ 2OH^{-}\ \longrightarrow\ Fe(OH)_{2}$
$Fe^{3+}\ +\ 3OH^{-}\ \longrightarrow\ Fe(OH)_{3}$
$Zn^{2+}\ +\ 2OH^{-}\ \longrightarrow\ Zn(OH)_{2}$
$Cu^{3+}\ +\ 3OH^{-}\ \longrightarrow\ Cu(OH)_{2}$
$Al^{3+}\ +\ 3OH^{-}\ \longrightarrow\ Al(OH)_{3}$
3. Action sur l'acide chlorhydrique
La réaction entre les solutions d'acide chlorhydrique et d'hydroxyde de sodium totale et qui traduit par l'équation-bilan :
$$H_{3}O^{+}\ +\ Cl^{-}\ +\ Na^{+}\ + OH^{-}\ \longrightarrow\ 2H_{2}O\ +\ Na^{+}\ +\ Cl^{-}$$
Les ions sodium et chlorure ne sont pas intervenus : ce sont des ions spectateurs
L'équation-bilan s'écrit donc :
$$H_{3}O^{+}\ +\ OH^{-}\ \longrightarrow\ 2H_{2}O$$
III. Exemples d'autres bases
1. Hydroxyde de potassium
L'hydroxyde de potassium $KOH$ est préparé par électrolyse d'une solution aqueuse saturée de chlorure de potassium.
Il est principalement employé pour produire du carbonate de potassium destiné à l'industrie verrière.
Il est aussi à la base de la production de divers sels de potassium, silicate, permanganate...
Il est utilisé également pour fabriquer le savon noir, comme électrolyte des piles alcalines et desséchant de gaz.

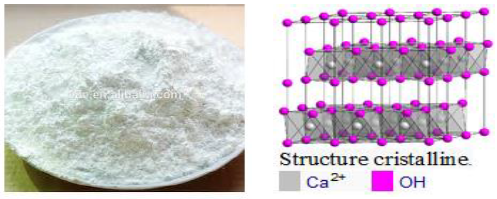
2. Hydroxyde de calcium
L'hydroxyde de calcium ou chaux éteinte $Ca(OH)_{2}$ est obtenue par hydratation de l'oxyde de calcium ou chaux vive $CaO$ obtenu par calcination du calcaire.
$$CaO\ +\ H_{2}O\ \longrightarrow\ Ca(OH)_{2}$$
Les utilisations de l'hydroxyde sont très nombreuses, dans le traitement de l'eau, des fumées, comme amendement agricole, pour l'obtention de $pH$ basiques...
3. Ammoniaque
L'ammoniac, gaz très soluble dans l'eau, s'ionise partiellement en solution avec formation d'ions hydroxyde $OH^{-}.$
On obtient donc une solution basique
L'équation-bilan de la réaction de la réaction s'écrit :
$$NH_{3}\ +\ H_{2}O\ \leftrightarrows\ NH_{4}\ +\ OH^{-}$$
La double flèche indique que l'ionisation n'est pas totale
L'ionisation de l'ammoniac libère des ions hydroxydes.
L'ammoniac est une base.

Commentaires
Alpha Ba (non vérifié)
lun, 06/20/2022 - 09:11
Permalien
réussir
Ajouter un commentaire