Structure de la matière - 2nd L
Classe:
Seconde
I. Structure de la matière
1. Molécule et élément chimique
1.1 Molécule
1.1.1 Observation
Le dihydrogène es un gaz est formé de petites particules toutes identiques, animées de mouvements incessants et désordonnés, auxquelles on donne le nom de molécules.
1.1.2 Définition
La molécule est plus petite partie d'un corps pur (simple ou composé) qui conserve toutes les propriétés chimiques de ce corps et qui puisse exister à l'état libre.
2. Clément chimique
2.1 Mise en évidence de l'élément carbone
2.1.1 Pyrolyse du bois
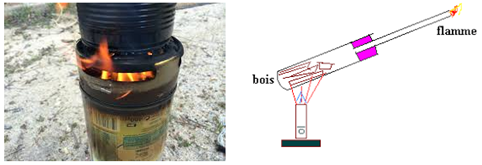
La pyrolyse du bois donne du charbon de bois
2.1.2 Pyrolyse du sucre
La pyrolyse du sucre donne un solide noir appelé charbon de sucre
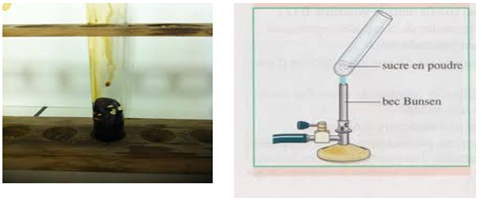
2.1.3 Conclusion
Le charbon de bois (produit de la pyrolyse du bois), le solide noir (résidu de la pyrolyse du sucre) contiennent un constituant commun : le carbone
2.2 Définition de l'élément chimique
Un élément chimique est un constituant commun à tous les corps qui le contiennent
Remarque :
$-\ $Les corps purs simples sont formés d'un seul élément
Exemples :
le dihydrogène est formé de l'élément hydrogène ; le dioxygène est formé de l'élément oxygène
$-\ $Les corps purs composés sont formés de plusieurs éléments
Exemples :
L'oxyde de dihydrogène (eau) est formé de l'élément oxygène et de l'élément hydrogène ; le dioxyde de carbone (gaz carbonique) est formé de l'élément oxygène et de l'élément carbone
2.3 Notation chimique
Pour faciliter l'étude de la chimie, les éléments sont représentés par des symboles
Généralement, on utilise la première lettre majuscule du nom (français, latin, grec, étranger...)
Lorsque plusieurs éléments commencent par la même lettre, on ajoute une seconde lettre minuscule pour les différencier
Symboles de quelques éléments chimiques
$$\begin{array}{|l|l|l|l|l|l|l|l|l|} \hline \text{Elément}&\text{Hydrogène}&\text{Carbone}&\text{Fer}&\text{Sodium}&\text{Azote}&\text{Oxygène}&\text{Fluor}&\text{Calcium}\\ \hline \text{Symbole}&H&C&F&Na&N&O&F&Fa\\ \hline \end{array}$$
2.4 Classification périodique des éléments chimiques
2.4.1 Principe de la classification
$-\ $Les éléments chimiques sont classés par numéro atomique Z croissant
$-\ $Les éléments dont les atomes ont le même nombre d'électrons sur leur couche externe sont disposés dans une même colonne verticale et constituent un groupe ou une famille
$-\ $Chaque ligne ou période correspond au remplissage d'une couche électronique
2.4.2 Tableau simplifiée de la classification périodique
Le tableau simplifié comporte trois lignes ou périodes et huit colonnes ou groupes
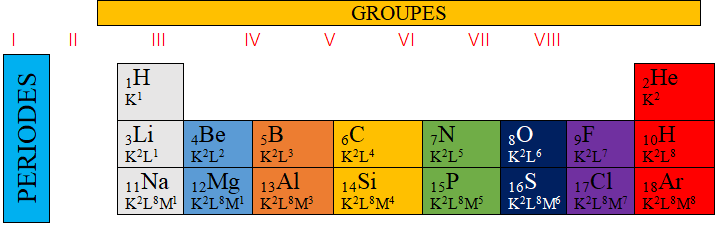
2.4.3 Intérêt de la classification périodique
Les atomes des éléments de même colonne ont le même nombre d'électrons périphériques. Ils ont des propriétés chimiques semblables et forment un groupe ou famille
Considérons quelques exemples :
2.4.3.1 La famille des métaux alcalins
$-\ $A l'exception de l'hydrogène, les éléments de la première colonne constituent le groupe des alcalins.
$-\ $Ils ont la même structure électronique externe. Ils possèdent un électron sur la couche électronique externe.
$Li$ (Lithium) ;
$Na$ (Sodium) ;
$K$ (Potassium)
$-\ $Les corps simples correspondant à ces éléments sont appelés les métaux alcalins.
$-\ $Ce sont des corps mous, légers à l'éclat métallique, très réactifs chimiquement.
$-\ $Ils sont oxydés par le dioxygène de l'air. Il faut les conserver dans le pétrole, à l'abri de l'air.
2.4.3.2 La famille des Halogènes
$-\ $Les éléments de la septième colonne constituent la famille des halogènes. Ces éléments possèdent la même structure électronique externe à sept électrons.
$F$ (Fluor) ;
$Cl$ (Chlore) ;
$Br$ (brome) ;
$I$ (iode)
$-\ $Ils existent sous la forme de molécules diatomiques :
$-\ $Le difluor, le dichlore (gaz jaune-vert), le dibrome (liquide jaune-orangé), le diiode (solide violet foncé).
2.4.3.3 La famille des gaz nobles
$-\ $Ce sont les éléments de la dernière colonne.
$-\ $L'hélium mis à part, ils possèdent une structure externe à huit électrons appelée octet d'électrons.
$He$ (Hélium) ;
$Ne$ (Néon) ;
$Ar$ (Argon)
$-\ $Ils possèdent une grande stabilité chimique. Ce sont des gaz monoatomiques, on les appelle les gaz rares ou gaz inertes
3. Atome et ion
3.1 Atome
3.1.1 Définition
Un atome est la plus petite partie d'un corps simple pouvant se combiner chimiquement avec un autre.
3.1.2 Dimensions et constituants
3.1.2.1 Dimensions
L'atome est représenté par une sphère infiniment petite. Le diamètre de l'atome est de l'ordre de l'Angstrom $($symbole ; $A^{\circ})$ ; $1A^{\circ}=10^{-15}m$
3.1.2.2 Les constituants de l'atome
3.1.2.2.1 Le modèle atomique
L'atome peut être modélisé par une structure présentant un noyau autour duquel existe une zone dans laquelle on peut trouver les électrons. Cette partie de l'atome est appelée nuage électronique
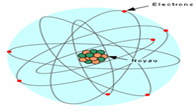
3.1.2.2.2 Les caractéristiques des constituants de l'atome
Les expériences montrent que l'atome est constitué de protons, de neutrons et d'électrons
$$\begin{array}{|l|l|l|} \hline \text{Particule}&\text{Masse}&\text{Charge}\\ \hline \text{Proton}&m_{p}=1.672\cdot 10^{-26}Kg&q_{p}=1.6\cdot 10^{-19}C\\ \hline \text{Neutron}&m_{n}=1.674\cdot 10^{-26}Kg&q_{n}=0C\\ \hline \text{Electron}&m_{e}=9.1\cdot 10^{-31}Kg&q_{e}=-1.6\cdot 10^{-19}C\\ \hline \end{array}$$
Remarque :
$-\ $La masse $m_{P}=m_{n}=1836m_{e}.$
La masse des électrons est $1836$ fois plus petite que celle du proton ; donc négligeable par rapport à celle-ci
$-\ $Les charges des protons et des électrons sont identiques et ces particules sont en même nombre dans l'atome ; l'atome est donc électriquement neutre
3.1.3 Structure électronique
3.1.3.1 Le noyau
Le noyau est constitué de deux types de particules : les neutrons et les protons .Ces deux types particules constituants du noyau sont appelés nucléons
Chaque atome est caractérisé par :
$-\ $le nombre de protons $Z$ qu'il renferme. Ce nombre est aussi appelé numéro atomique ou nombre de charge
$-\ $le nombre de nucléons $A$ qu'il renferme. Ce nombre est aussi appelé nombre de masse : $A=Z+N$
$N$ étant le nombre de neutrons
On symbolise le noyau des atomes par :
$_{Z}^{A}X$ $A=Z+N=$ nombre de masse d'un noyau, c'est le nombre de nucléons (protons + neutrons) qu'il contient.
$Z=$ numéro atomique d'un noyau, c'est le nombre de protons qu'il contient.
Exemples :
$_{6}^{12}C$ ;
$_{8}^{16}O$ ;
$_{1}^{1}H$ ;
$_{7}^{14}N$
Remarque :
Des atomes sont dits isotopes lorsqu'ils renferment le même nombre de protons mais de nombre de nucléons (ou nombre de neutrons) différents
Exemples :
$_{6}^{12}C$, $_{6}^{13}C$ et $_{6}^{14}C$ ;
$_{1}^{1}H$, $_{1}^{2}H$ et $_{1}^{3}H$
3.1.3.2 Le nuage électronique
3.1.3.2.1 Notion du niveau d'énergie
Les électrons d'un atome sont répartis en couche de niveau d'énergie différent. Pour arracher les électrons d'une même couche, il faut lui fournir la même énergie. On dit que les électrons d'une même couche ont le même niveau d'énergie
Les couches sont désignées par des lettres $K$, $L$, $M$, $N$, $O$, $P$, $Q\ldots$
A chaque couche correspond un nombre entier positif $n$
$$\begin{array}{|l|c|c|c|c|c|c|c|} \hline n&1&2&3&4&5&6&7\\ \hline \text{Lettre}&K&L&M&N&O&P&Q\\ \hline \end{array}$$
3.1.3.2.2 Règle de remplissage des couches
La répartition des électrons d'un atome sur les différentes couches ou niveaux d'énergie obéit à deux règles :
$-\ $la première règle : le nombre maximal d'électrons pouvant appartenir à une couche est : $N=2n^{2}$
Exemples :
Couche $K$ : $N=2\times 1^{2}\Rightarrow\;N=2$ électrons
Couche $L$ : $N=2\times 2^{2}\Rightarrow\;N=$ électrons
Couche $M$ : $N=2\times 3^{2}\Rightarrow\;N=18$ électrons
$-\ $la deuxième règle : on remplit successivement les couches dans l'ordre $K$, $L$, $M$, $N\ldots\ldots$
Une couche ne commence à se remplir que si la précédente est saturée
3.1.3.2.3 La configuration électronique
Pour donner la structure électronique ou la configuration électronique, on représente tous les électrons par des points $(.)$ dans des cases portant autant de places disponibles dans une couche déterminée
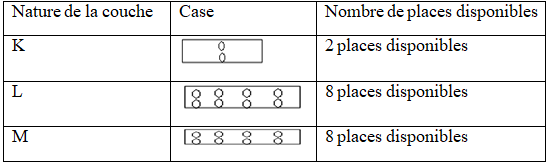
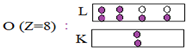
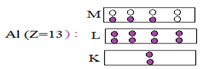
Exemples :


3.1.3.2.4 La formule électronique
On écrit la lettre qui correspond à chaque couche et on indique en exposant en haut à droite le nombre d'électrons par couche
Exemples :
$H$ $(Z=1)$ : $K^{1}$ ;
$He$ $(Z=2)$ : $K^{2}$ ;
$Li$ $(Z=3)$ : $K^{2}L^{1}$ ;
$C$ $(Z=6)$ : $K^{2}L^{4}$ ;
$O$ $(Z=8)$ : $K^{2}L^{6}$ ;
$Al$ $(Z=13)$ : $K^{2}L^{8}M^{3}$
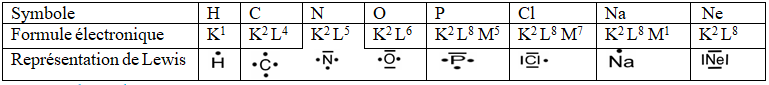
3.1.3.3 Structure de Lewis d'un atome
La représentation de Lewis permet de mettre en évidence les électrons de la couche externe ou couche périphérique. Les électrons célibataires sont représentés par des points $(.)$ ; les doublets sont représentés par un tiret $(-)$ placé autour de l'élément considéré
Exemples :
3.1.4 Valence d'un atome
Le nombre d'électrons célibataires que possède l'élément est la valence
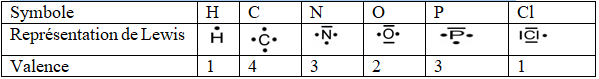
Hydrogène : monovalent ;
Oxygène : divalent ;
Azote : trivalent ;
Carbone : Tétravalent.
3.1.4 Masse de l'atome
La masse $M$ de l'atome est donnée la relation suivante :
$M=m_{\text{noyau}}+m_{\text{éléctrons}}\Rightarrow\boxed{M=Zm_{p}+Nm_{n} +Zm_{e}}$
\begin{eqnarray} \text{Si }m_{p}&=&m_{n}\nonumber\\\\\Rightarrow\,M &=&Zm_{p}+Nm_{p}+Zm_{e}\nonumber\\\\\Rightarrow\,M&=&(Z+N)m_{p}+Zm_{e}\nonumber\\\\\Rightarrow\,M&=&Am_{p}+Zm_{e} \end{eqnarray}
Si on néglige la masse des électrons $\Rightarrow\,M=Am_{p}$
3.1.5 Structure lacunaire de l'atome
La matière de l'atome est essentiellement concentrée dans son noyau. Les électrons tournent autour du noyau. Les distances séparant le noyau des électrons sont très grandes. Ainsi, la plus grandes partie (volume) est constituée de vide. On dit que l'atome a une structure lacunaire
3.2 Les ions monoatomiques
Certains atomes peuvent perdre ou gagner des électrons et deviennent des ions simples
3.2.1 Les cations
Un cation ou ion positif provient d'un atome qui a perdu un ou plusieurs électron(s)
Exemples :
$Na\longrightarrow\;Na^{+}+e^{-}$
$Al\longrightarrow\;Al^{3+}+3e^{-}$
$B\longrightarrow\;B^{3+}+3e^{-}$
$Mg\longrightarrow\;Mg^{2+}+2e^{-}$
$H\longrightarrow\;H^{+}+e^{-}$
$Li\longrightarrow\;Li^{+}+e^{-}$
De manière générale : $M\longrightarrow\;M^{n+}+ne^{-}$
3.2.2 Les anions
Un anion ou ion négatif provient d'un atome qui a gagné un ou plusieurs électron(s)
Exemples :
$Cl+e^{-}\longrightarrow\;Cl^{-}$ ;
$P+3e^{-}\longrightarrow\;P^{3-}$ ;
$N+3e^{-}\longrightarrow\;N^{3-}$ ;
$O+2e^{-}\longrightarrow\;O^{2-}$ ;
$F+e^{-}\longrightarrow\;F^{-}$ ;
$H+e^{-}\longrightarrow\;H^{-}$
De manière générale :
$M+ne^{-}\longrightarrow\;M^{n-}$
4. Liaison chimique
Exceptés, les gaz rares, les éléments chimiques n'existent pas l'état libre mais en combinaison pour former des édifices moléculaires
4.1 Liaison covalente ou liaison de covalence
4.1.1 Définition
La liaison de covalence (ou liaison covalente) résulte de la mise en commun par deux atomes d'une ou plusieurs paires d'électrons célibataires appelées doublets de liaison ou doublets liants
Exemple :
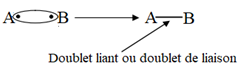
4.1.2 La valence d'un atome
La valence d'un atome est le nombre de liaisons de covalence qu'il peut former
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit acquérir pour saturer sa couche externe à un octet d'électrons (ou un duet pour l'atome d'hydrogène).
Le nombre de liaisons $n_{L}$ peut être calculé par la relation :
$$n=n_{\text{max}}-p$$
$n_{\text{max}}$ : nombre d'électrons pour saturer la couche externe et $p$ : nombre d'électrons périphériques d'un atome
Pour les couches $K$ : $n=2-p$
Pour les couches $L$ et $M$ : $n=8-p$
Exemples
$$\begin{array}{|l|l|l|l|} \hline \text{Atome}&Z&\text{Formule}&\text{Nombre}\\ & &\text{électronique}&\text{de liaisons}\\ \hline \text{Hydrogène }H&1&(K)^{1}&n=2-1=1\\ \hline \text{Chlore }Cl&17&(K)^{2}(L)^{8}(M)^{7}&n=8-7=1\\ \hline \text{Oxygène }O&8&(K)^{2}(L)^{6}&n=8-6=2\\ \hline \text{Azote }N&7&(K)^{2}(L)^{5}&n=8-5=3\\ \hline \text{Carbone }C&6&(K)^{2}(L)^{4}&n=8-4=4\\ \hline \end{array}$$
$\surd$ Le nombre des doublets non liants $n_{d}$ est : $n_{d}=\left(p-n_{L}\right)/2$
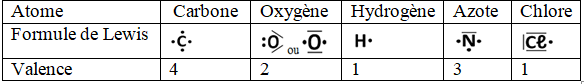
4.1.3 Formule brute d'une molécule
La formule brute d'une molécule est constituée des symboles des éléments qui composent cette molécule affectés en indice de coefficients indiquant leur nombre dans la molécule
Exemples :
$H_{2}$, $O_{2}$, $Cl_{2}$, $NH_{3}$, $CH_{4}$, $C_{2}H_{6}$
4.1.4 Atomicité d'une molécule
L'atomicité d'une molécule représente le nombre de d'atomes qu'elle comporte
$$\begin{array}{|l|c|c|c|c|c|c|} \hline \text{Molécule}&H_{2}&NH_{3}&CH_{4}&C_{2}H_{6}&KMnO_{4}&K_{2}Cr_{2}O_{7}\\ \hline \text{Atomicité}&2&4&5&6&11\\ \hline \end{array}$$
4.1.5 Représentation de Lewis d'une molécule
La représentation de Lewis d'une molécule est une représentation des atomes et de tous les doublets d'électrons périphériques liants et non-liants de cette molécule
Exemples :
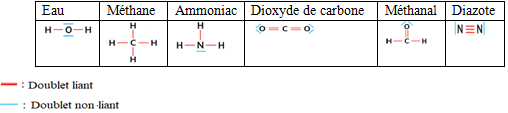
4.1.6 Formule développée et formule semi-développée
4.1.6.1 Formule développée
La formule développée d'une molécule est une représentation de Lewis de la molécule où les doublets non liants ne sont pas représentés
Exemples
4.2 Liaison covalente polarisée et liaison dative
4.2.1 L'électronégativité
$-\ $L'électronégativité est la tendance d’un atome à capter des électrons.
Elle traduit l'aptitude de l'atome à attirer les électrons des liaisons
Remarque :
L'électronégative augmente de la gauche vers la droite le long d'une période et du bas vers le haut le long d'une colonne dans la classification périodique
Le fluor est l'élément le plus électronégatif
$-\ $L'électropositivité est la tendance d'un élément chimique à céder des électrons
4.2.2 Liaison covalente polarisée
Une liaison entre deux atomes, $A$ et $B$, ayant des électronégativités différentes est polarisée : ils forment une liaison covalente polarisée (ou polaire)
Les électrons ne sont alors pas répartis de manière symétrique entre les deux atomes. On considère alors que :
$-\ $L'atome $A$ porte un excès de charges négatives $\left(\text{noté }\delta^{-}\right)$ ;
$-\ $L'atome $B$ porte un défaut de charges négatives $\left(\text{noté }\delta^{+}\right).$
Les symboles $\delta^{-}$ et $\delta^{+}$ représentent des fractions de la charge élémentaire $e$ $\left(e=1.6\cdot 10^{-19}C\right)$ : on parle de charges partielles (négative ou positive) sur la liaison
Exemples :
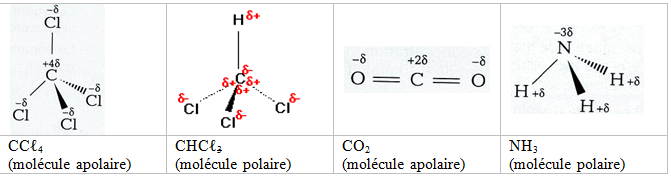
$-\ $Dans une liaison polaire, le barycentre des charges électriques $(-)$ n'est pas confondu avec celui des charges électriques $(+).$
$-\ $Plus la différence d'électronégativité entre les deux atomes est importante, plus la liaison est polarisée
4.2.3 Liaison covalente dative
C'est une liaison covalente dans laquelle le doublet d'électrons de la liaison à partager est apporté par un seul atome. L'atome qui donne le doublet s'appelle donneur, l'autre s'appelle accepteur.
La liaison dative se représente par une flèche allant du donneur à l'accepteur. Une fois formée, cette liaison est égale aux autres liaisons covalentes.
Exemple :
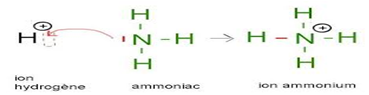
4.3 Liaison ionique
4.3.1 Définition
La liaison ionique est une liaison établie par attraction électrostatique entre deux ions de signes opposés dans les composés ioniques.
Sa cohésion est assurée par la force de l'attraction électrostatique qui unit les deux ions
4.3.2 Le cristal ionique
4.3.2.1 Formule ionique et formule statistique d'un solide ionique
4.3.2.1.1 La formule ionique
La formule ionique représente un ensemble électriquement neutre écrit avec des ions constituant le composé
Exemples :
$-\ $Chlorure de sodium $\left(Na^{+}\ ;\ Cl^{-}\right)$ ou $\left(Na^{+}+Cl^{-}\right)$
$-\ $Fluorure de calcium $\left(Ca^{2+}\ ;\ 2F^{-}\right)$ ou $\left(Ca^{2+}+2F^{-}\right)$
$-\ $Chlorure de magnésium $\left(Mg^{2+}\ ;\ 2Cl^{-}\right)$ ou $\left(Mg^{2+}+2Cl^{-}\right)$
$-\ $Sulfate de sodium $\left(2Na^{+}\ ;\ SO_{4}^{2-}\right)$ ou $\left(2Na^{+}+SO_{4}^{2-}\right)$
4.3.2.1 La formule statistique
La formule statistique d'un composé ionique représente un ensemble électriquement neutre et indique la proportion de chacun des ions (cations et anions) qui la compose
Exemples :
$-\ $Chlorure de sodium : $NaCl$
$-\ $Fluorure de calcium : $CaF_{2}$
$-\ $Chlorure de magnésium : $MgCl_{2}$
$-\ $Sulfate de sodium : $Na_{2}SO_{4}$
4.3.3 Nomenclature de quelques ions
$$\begin{array}{|l|l|l|} \hline &\text{CATIONS}&\text{ANIONS}\\ \hline\\ \text{Ion portant une seule charge}&H^{+}\text{ proton}&F^{-}\text{ ion fluorure} &Na^{+}\text{ ion sodium}&NO_{3}^{-}\text{ ion nitrate}\\ &Ag^{+}\text{ ion argent}&Cl^{-}\text{ ion chlorure}\\ &H_{3}O^{+}\text{ ion hydronium}&HO^{-}\text{ ion hydroxyde}\\ &K^{+}\text{ ion potassium}&MnO_{4}^{-}\text{ ion permanganate}\\ &NH_{4}^{+}\text{ ion ammonium}&\\ \hline \text{Ion portant deux charges}&Mg^{2+}\text{ ion magnésium}&O^{2-}\text{ ion oxyde}\\ &Ca^{2+}\text{ ion calcium}&S^{2-}\text{ ion sulfure}\\ &Ba^{2+}\text{ ion baryum}&SO_{3}^{2-}\text{ ion sulfite}\\ &Fe^{2+}\text{ ion fer II}&SO_{4}^{2-}\text{ ion sulfate}\\ &Ni^{2+}\text{ ion nickel}&CO_{3}^{2-}\text{ ion carbonate}\\ &Cu^{2+}\text{ ion cuivre II}&Cr_{2}O_{7}^{2-}\text{ ion dichromate}\\ &Zn^{2+}\text{ ion zinc}&S_{2}O_{3}^{2-}\text{ ion thiosulfate}\\ &Sn^{2+}\text{ ion étain}&S_{4}O_{6}^{2-}\text{ ion tétrathionate}\\ &Pb^{2+}\text{ ion plomb}&\\ \hline \text{Ion portant trois charges}&Al^{3+}\text{ ion aluminium}&PO_{4}^{3-}\text{ ion phosphate}\\ &Fe^{3+}\text{ ion fer III}&N^{3-}\text{ ion nitrure}\\ &Au^{3+}\text{ ion or}&\\ \hline \text{Ion portant quatre charges}&P^{4+}\text{ ion platine IV}&C^{4-}\text{ ion carbure}\\ \hline \end{array}$$
4.4 Structure des corps
4.4.1 Corps à structure moléculaire
Un corps pur à structure moléculaire est corps est formé uniquement d'une seule espèce chimique. Cette espèce chimique est représentée par des molécules qui sont formées par des atomes liés entre eux par des liaisons chimiques.
Si les atomes constituant ces molécules sont identiques, on est donc en présence de molécules simples.
Exemples :
La molécule d'hydrogène $H_{2}$ formée par deux atomes d'hydrogène.
La molécule d'oxygène $O_{2}$ formée par deux atomes d'oxygène.
Si les atomes constituant ces molécules ne sont pas identiques, on est donc en présence de molécules composées.
Exemples :
La molécule de dioxyde de carbone $CO_{2}$ formée de deux atomes d'oxygène et un atome de carbone.
La molécule d'eau $H_{2}O$ formée de deux atomes d'hydrogène et un atome d'oxygène.
4.4.2 Corps à structure atomique
Ces corps purs à structure atomique sont des corps qui existent dans la nature sous forme d'atomes.
Les atomes qui constituent les corps purs à structure atomique sont indépendants les uns des autres, c'est à dire, il n'existe aucune liaison entre eux.
Exemples :
Les gaz rares, les métaux sont des corps à structure atomique
4.4.3 Corps à structure ionique
Un corps à structure ionique est formé par un assemblage géométrique simple d'ions chargés positivement, les cations, et d'ions chargés négativement, les anions liés entre par des forces d'origine essentiellement électrostatique.

Commentaires
Cissé (non vérifié)
lun, 11/14/2022 - 20:30
Permalien
Réussir
Mairame lom (non vérifié)
sam, 03/15/2025 - 21:49
Permalien
Pc
Mairame lom (non vérifié)
sam, 03/15/2025 - 21:50
Permalien
C'est de réussir
Penda ba (non vérifié)
lun, 11/13/2023 - 19:36
Permalien
Bien compris mais ils
Penda ba (non vérifié)
lun, 11/13/2023 - 19:36
Permalien
Bien compris mais ils
Diallo (non vérifié)
sam, 01/13/2024 - 01:26
Permalien
Étude
Ajouter un commentaire