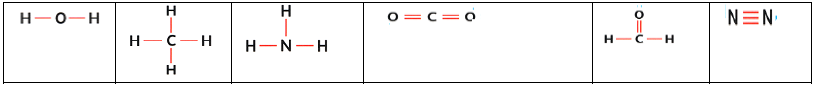
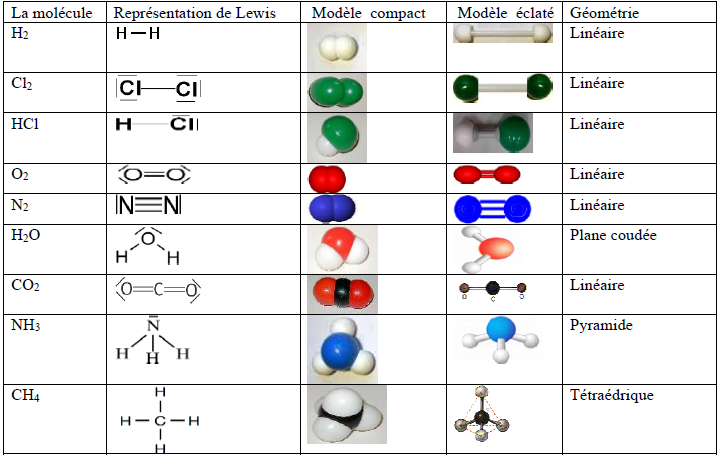
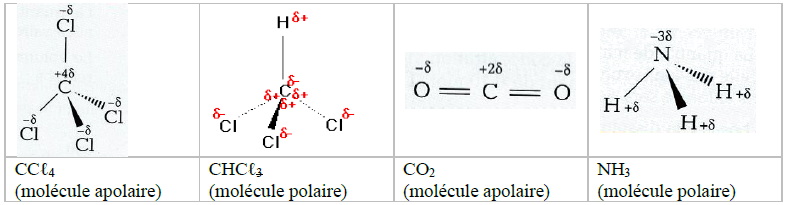
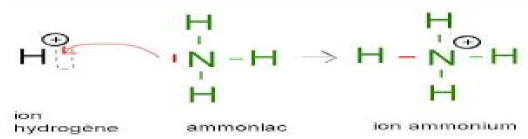
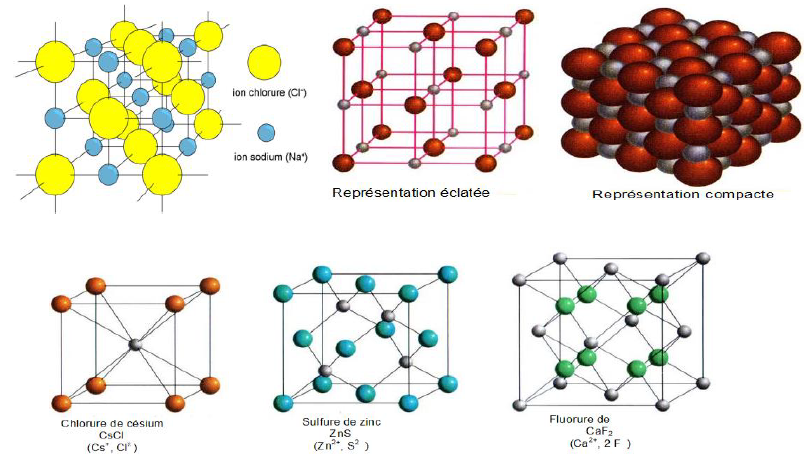
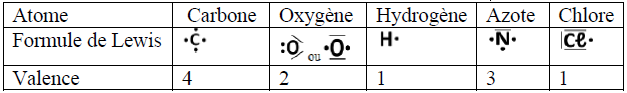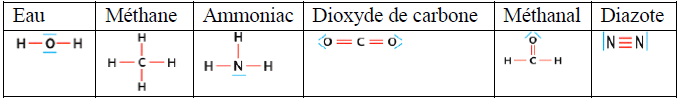I. La mole
1. Nécessité de changement d'échelle
L'échelle infiniment petit ou échelle microscopique permet de considérer un seul de carbone dont la masse est voisine $m_{atome}=2.0\cdot10^{-23}g$
A notre échelle ou échelle macroscopique, c'est la masse de quelques grammes de charbon essentiellement de carbone que nous utilisons pour faire la combustion
Déterminons le nombre d'atomes de carbone contenu dans une masse de charbon $m_{Charbon}=84g$
$N=\dfrac{84}{2.0\cdot10^{-23}}\Rightarrow\;N=42\cdot10^{23}$ atomes de carbone
Ce nombre est considérable !
En considérant que l'on puisse voir ces atomes, il faudrait plusieurs siècles aux habitants de toute la Terre pour les compter !
2. La mole, unité de la quantité de matière
3.1. Observations
Pour faciliter le comptage d'un grand d'objets, ceux ci sont regroupés en paquets
Ainsi les feuilles de papier ne sont pas vendues à l'unité.
Elles sont conditionnées en rame de $500$ feuilles
De même, il est commode de regrouper les atomes en paquets d'atomes comportant toujours le même nombre d'atomes
Les chimistes sont amenés à utiliser une nouvelle grandeur physique la quantité de matière dont l'unité est la mole (symbole mol)
2.2 Définition de la mole
La mole est la quantité de matière d'un système contenant autant d'entités élémentaires qu'il y a d'atomes dans $12g$ de carbone $12$
Remarque :
Lorsqu'on emploi la mole, les entités élémentaires doivent être spécifiées (atomes, molécules, ions,...etc).
Ces entités élémentaires peuvent être des atomes, molécules, ions, des électrons, des protons... etc.
3. La constante d'Avogadro
Nombre d'atomes dans $12g$ de carbone $\left(_{6}^{12}C\right)$
$$\left\lbrace\begin{array}{lllll} m\left(_{6}^{12}C\right)&=&A\cdot m_{p}&\longrightarrow& 1\;atome\\ m&=&12g&\longrightarrow&N\ atomes \end{array} \right.$$
On déduit
$\begin{array}{lcl} N&=&\dfrac{m}{A\cdot m_{p}}\\&=&\dfrac{12\cdot10^{-3}}{12\times 1.66\cdot 10^{-27}}\\&\Rightarrow& N=6.02\cdot10^{23} \end{array}$
Le nombre $6.02\cdot10^{23}$ porte le nom de constante d'Avogadro.
On note cette constante : $N_{A}=6.02\cdot10^{23}\cdot mol^{-1}$ $($ce qui signifie $6.02\cdot10^{23}$ entités par mole$)$
$-\ $ Une mole d'atomes (ou d'ions ou de molécules...) contient $6.02\cdot10^{23}$ atomes (ou ions, ou molécules).
Conséquence : le nombre $N$ d'entités élémentaires contenues dans un système est proportionnel à la quantité de matière $n$ correspondante :
$$N=n\times N_{A}\quad\text{ou}\quad n=\dfrac{N}{N_{A}}$$
Exercice d'application
1) Quel est le nombre de moles de molécules d'eau contenu dans $12.7\cdot10^{24}$ molécules d'eau
2) Quel est le nombre d'ions chlorure $Cl^{-}$ contenu dans $1.5$ mole de chlorure de sodium $NaCl$
On donne : $N_{A}=6.02\cdot10^{23}\cdot mol^{-1}$
Résolution
1) Nombre de moles d'eau
$n=\dfrac{N}{N_{A}}=\dfrac{12.7\cdot10^{24}}{6.02\cdot10^{23}}\Rightarrow\;n=21.1\,mol$
2) Le nombre d'ions chlorure
$N=n\times N_{A}=1.5\times 6.02\cdot10^{23}\Rightarrow N=9.0\cdot10^{23}$ ions
II. Masses molaires
La masse molaire d'une espèce chimique est la masse d'une mole de cette espèce chimique
Elle s'exprime en grammes par mole $($symbole : $mol^{-1})$
1. Masse molaire atomique
La masse molaire atomique d'une espèce chimique est la masse d'une mole d'atomes de cette espèce chimique.
Elle s'exprime en grammes par mole $($symbole : $mol^{-1})$
Exemple :
La masse molaire atomique du fer est $M(Fe)=56\,g\cdot mol^{-1}.$
On peut déterminer la masse molaire atomique moyenne d'un élément constitué d'isotopes
Exemple :
$$\begin{array}{|l|l|l|} \hline \text{Isotope}&\text{Chlore }35&\text{Chlore }37\\ \hline \text{Pourcentage}&75.8\%&24.2\%\\ \hline \text{Masse d'une mole en gramme}&35.0&37.0\\ \hline \end{array}$$
$M=\dfrac{35.0\times 75.8}{100}+\dfrac{37.0\times 24.2}{100}\Rightarrow\,M=35.5\,g\cdot mol^{-1}$
Remarque
Les valeurs des masses molaires atomiques sont indiquées pour chaque élément dans le tableau de classification périodique des éléments.
Exemples :
$M_{H}=1.0\,g\cdot mol^{-1}$ ;
$M_{C}=12.0\,g\cdot mol^{-1}$ ;
$M_{O}=16.0\,g\cdot mol^{-1}$ ;
$M_{N}=14.0\,g\cdot mol^{-1}$
2. Masse molaire moléculaire
La masse molaire moléculaire ou masse molaire d'une espèce chimique moléculaire représente la masse d'une mole de ses molécules
Elle est égale à la somme des masses molaires atomiques des éléments constituant la molécule.
Elle s'exprime en grammes par mole $($symbole : $mol^{-1})$
La masse molaire moléculaire d'un composé est la masse d'une mole de molécules de ce composé.
Exemples
$M(H_{2}O)=2\cdot M_{H}+M_{O}=2\times 1.0+16.0=18\,g\cdot mol^{-1}$
$M(C_{2}H_{6}O)=2\cdot M_{C}+6\cdot M_{H}+M_{O}$
$=2\times12.0+6\times1.0+16.0=46.0\,g\cdot mol^{-1}$
3. Masse molaire ionique
La masse molaire ionique est la masse d'une mole d'ions de l'espèce considérée
On peut négliger la masse des électrons par rapport à celle du noyau
Exemples
$M(Cl^{-})=M_{Cl}=35.5\,g\cdot mol^{-1}.$
$M_{Al(OH)_{4}^{-}}=M_{Al}+4M_{O}+4M_{H}=27+4\times 16+4\times 1$
$\Rightarrow\;M_{Al(OH)_{4}^{-}}=95\,g\cdot mol^{-1}$
4. Relation entre masse et quantité de matière
La quantité de matière $n$ d'un composé de masse $m$ et de masse molaire $M$ est donnée par la relation :
$$n=\dfrac{m}{M}\quad\text{ou}\quad m=n\times M$$
Exercice d'application :
Calculer la quantité de matière contenue dans une masse d'eau de $360\,g.$
On donne : Masse molaire moléculaire de l'eau $M_{H_{2}O}=18\,g\cdot mol^{-1}$
$n_{H_{2}O}=\dfrac{m_{H_{2}O}}{M_{H_{2}O}}=\dfrac{360}{18}\Rightarrow\;n_{H_{2}O}=20\,mol$
III. Le volume molaire
1. Définition
Le volume molaire d'un gaz est le volume occupé par une mole de ce gaz dans des conditions de pression et de température données
Le volume molaire d'un gaz se note $V_{m}$, on l'exprime en litres par mole $($symbole : $L\cdot mol^{-1})$
2. Notion de température
La température absolue mesure le degré d'agitation thermique des molécules d'une substance donnée
Son unité est le kelvin $($symbole : $K).$
La relation entre la température absolue et la température à échelle Celsius est :
$$\boxed{T(K)=t(C^{\circ})+273}$$
Remarque :
Le $0K$ (zéro kelvin) représente l'absence totale d'agitation des molécules soit : $-273\,C^{\circ}$
3. Notion de pression
La pression correspond au nombre de chocs entre les molécules et les parois du récipient qui les renferme par unité de temps et de surface.
Elle traduit également la force qui s'exerce sur une surface donnée
Son unité est le pascal $($symbole : $Pa)$ et elle est notée $P$
$$\boxed{P=\dfrac{F}{S}}$$
$F$ en newton $(N)$
$S$ en mètres carrés $(m)$
$P$ en pascals $(Pa)$
$1\,atm=1.013\cdot10^{5}Pa=760\;mmHg$
$1\,bar=10^{5}Pa$
4. Équation d'état du gaz parfait
A faible pression, tous les gaz ont un comportement identique de celui d'un gaz idéal appelé gaz parfait.
Un gaz parfait suit une équation d'état suivant :
$$\boxed{PV=n\,RT}$$
$P$ en $Pa$
$V$ en $m^{3}$
$n$ en mol
$T$ en $K$
$R=8.314\,Pa\cdot m^{3}\cdot mol^{-1}K^{-1}$
ou $R=8.314\cdot10^{3}\,Pa\cdot L\cdot mol^{-1}K^{-1}$ est la constante des gaz parfaits
Remarque :
$R=0.082\,atm\cdot L\cdot mol^{-1}\cdot K^{-1}$
5. La loi d'Avogadro-Ampère
Dans les mêmes conditions de température et de pression, le volume occupé par une mole de molécules d'un gaz
Autrement dit, des volumes égaux différents, pris dans les mêmes conditions de température et de pression contiennent le même nombre de moles (donc le même nombre de molécules)
6. Expression du volume molaire
$PV=n\,RT$
Pour $n=1\,mol\Rightarrow\;PV_{m}=RT\Rightarrow\;V_{m}=\dfrac{RT}{P}$
On définit conventionnellement des conditions de référence appelées Conditions Normales de Température et de Pression $(C.N.T.P)$
Dans les $C.N.T.P$ :
$$\left\lbrace\begin{array}{lll} T&=&0^{\circ}C&=&273K\\ P&=&10^{5}Pa \end{array}\right.$$
$\Rightarrow\;V_{m}=\dfrac{8.314\cdot 10^{3}\times 273}{10^{5}}\Rightarrow\;V_{m}=22.4\,L\cdot mol^{-1}$
Dans les conditions ordinaires :
$$\left\lbrace\begin{array}{lll} T&=&24^{\circ}C&=&297K\\ P&=&10^{5}Pa \end{array}\right.$$
$\Rightarrow\;V_{m}=\dfrac{8.314\cdot 10^{3}\times 297}{10^{5}}\Rightarrow\;V_{m}=24\,L\cdot mol^{-1}$
7. Relation entre le volume molaire et la quantité matière
La quantité de matière d'un gaz se note $n$ de volume $V$ et $V_{m}$ représente le volume molaire
$$\left\lbrace\begin{array}{lcl} 1\,mol&\longrightarrow&V_{m}\\ n\,mol&\longrightarrow&V \end{array}\right.$$
$\Rightarrow\;n=\dfrac{V}{V_{m}}\quad\text{ou}\quad V=n\cdot V_{M}$
$n$ en mole
$V$ en $L$
$V_{m}$ en $L\cdot mol^{-1}$
8. La densité $d$ d'un gaz densité par rapport à l'air
$-\ $ La densité du gaz est donc égale à la masse d'un certain volume de ce gaz divisée par la masse du même volume d'air, les volumes étant mesurés dans les mêmes conditions de température et de pression.
$$d=\dfrac{m}{m_{air}}$$
$-\ $ On définit également la densité $d$ d'un gaz comme le rapport de la masse volumique du gaz sur la masse volumique du gaz de référence : l'air.
$$d=\dfrac{\rho}{\rho_{air}}$$
$-\ $ La densité est une grandeur sans unité.
$-\ $ Si on s'intéresse à $1$ mol du gaz : il occupe le volume molaire et sa masse est $M$, masse molaire du gaz la masse du même volume d'air est sensiblement de $29\,g$ dans les $C.N.T.P$
$$d=\dfrac{\rho}{\rho_{air}}=\dfrac{\rho\,V_{m}}{\rho_{air}V_{m}}\Rightarrow\;d=\dfrac{M}{29}$$
Exercice d'application
Une bouteille de gaz contient une masse $m=420\,g$ d'un corps liquide de formule $C_{x}H_{y}$ et de masse molaire $M=58\,g\cdot mol^{-1}$
1. Déterminer la quantité de matière du gaz présent dans la bouteille
2. Calculer le volume occupé par ce corps liquide.
On donne la masse volumique de ce liquide $\rho=0.6\,gm\cdot L^{-1}$
3. Le détendeur permet d'abaisser la pression et le liquide sort de la bouteille à l'état gazeux
3.1 Calculer le volume molaire du gaz à $250C$ et sous la pression de $1\,bar$
3.2 Quel volume peut-on récupérer à la température de $250C$ et sous la pression normale
3.3 Peut-on espérer vider complètement la bouteille de son gaz ?
Pourquoi ?
4. Le corps $17.2\%$ en masse d'hydrogène.
Donner sa formule brute et les formules semi-développées possibles











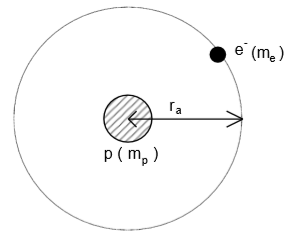
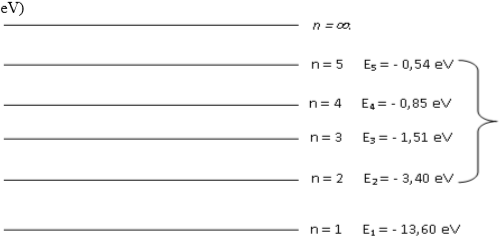
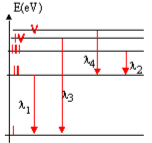
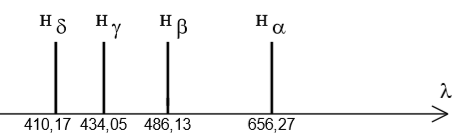
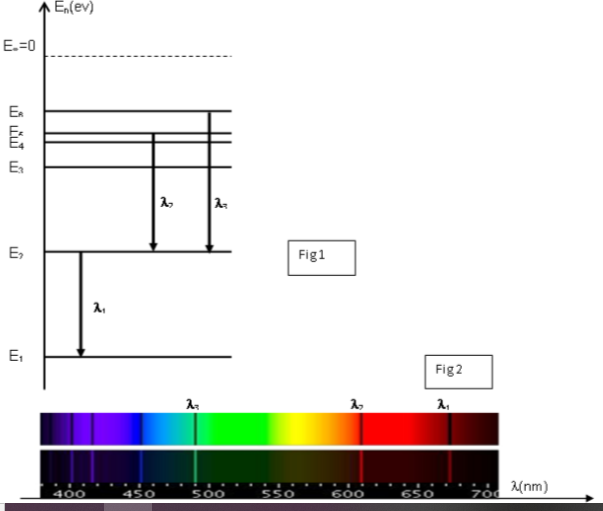
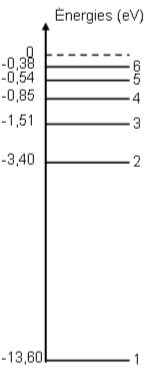
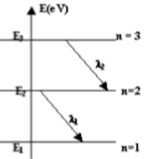 1-1.2 L'atome d'hydrogène est à l'état excité correspondant au niveau d'énergie $(n = 2)$.
1-1.2 L'atome d'hydrogène est à l'état excité correspondant au niveau d'énergie $(n = 2)$.