Solutions acides - Solutions basiques - 3e
Classe:
Troisième
Situation – problème
En arrivant dans le laboratoire presque à l'abandon d'un lycée, un technicien de laboratoire découvre dans une armoire deux bouteilles contenant deux solutions qu'il ne peut distinguer.
Il ramasse, à leur coté une étiquette tombée de l'une d'elle sur laquelle il arrive à lire : « Solution molaire de soude ».
Croyant que les deux solutions étaient identiques, il en mélange deux prélèvements respectifs et note un dégagement de chaleur ; il découvre alors que les deux solutions ne sont pas identiques.
Par un test au $BBT$, il parvient à les distinguer.
$1–\ $ Qu'est-ce que le $BBT$ ?
Comment a-t-il permis cette distinction ?
$2-\ $ Que fera-t-il pour rétablir l'étiquette manquante de l'une des solutions ?
I. Classification des solutions
I.1 Par le bleu de bromothymol BBT.
I.1.1 Expérience
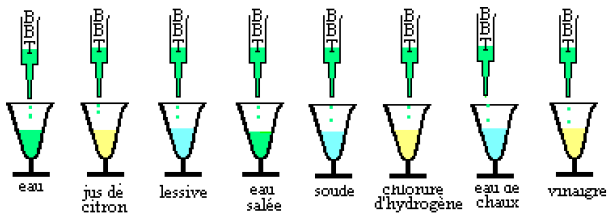
Dans chacune des solutions suivantes, versons quelques gouttes de bleu de bromothymol $BBT$ et observons
I.1.2 Observations
Les solutions, ne donnant pas la même coloration avec le $BBT$ sont donc de natures différentes.
Le $BBT$ qui change de coloration suivant la nature de la solution est un indicateur coloré ; il existe d'autres indicateurs colorés tels que le tournesol, l'hélianthine, la phénolphtaléine...
I.1.3 Résultats de l'expérience
Le classement
$$\begin{array}{|c|c|c|c|c|} \hline\text{Jaune} & & & & \text{Acides} \\ \hline\text{Vert} & & & & \text{Neutre} \\ \hline\text{Bleu} & & & & \text{Bases} \\ \hline \end{array}$$.
I.2 Conclusions.
Les trois colorations observées conduisent à l'identification de trois sortes de solutions dont les définitions respectives à partir du $BBT$ sont :
I.2.1 Solution acide : C'est toute solution qui fait virer le $BBT$ au jaune.
I.2.2 Solution basique : C'est toute solution qui fait virer le $BBT$ au bleu.
I.2-3 Solution neutre : C'est toute solution qui laisse le $BBT$ vert
II. Quelques propriétés des solutions
II.1 Propriétés communes aux acides et bases
II.1.1 Conductibilité électrique.
En versant quelques gouttes d'acide ou de base, la $D.E.L$ s'allume : le courant passe.
L'expérience montre que les solutions acides ou basiques conduisent le courant électrique : ce sont desélectrolytes
II.1.2 Actions sur les métaux
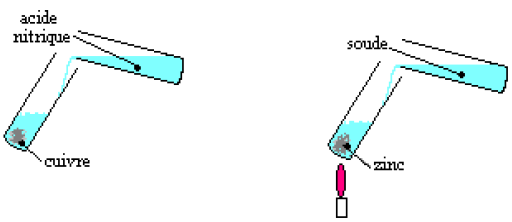
Versons de l'acide nitrique (acide) sur du cuivre et de la soude (une base) sur du zinc à chaud.
Certaines solutions acides et certaines solutions basiques réagissent dans certaines conditions avec certains métaux.
II.2 Propriétés spécifiques.
II.2.1 Aux solutions acides
Les solutions acides ont un goût piquant dit aussi acide.
Elles attaquent le calcaire.
Exemple :
l'acide chlorhydrique réagit avec le calcaire pour donner entre autres du gaz chlorhydrique.
$$CaCO \qquad + \qquad HCl \qquad \longrightarrow \qquad CaCl \qquad + \qquad HO \qquad + \qquad CO$$
II.2.2 Aux solutions basiques
Les solutions basiques ont un goût fade
Attention ! Évitez, autant que possible, de goutter aux solutions du laboratoire ; elles sont généralement corrosives.
III. Réaction Acide - Base
III.1 Étude qualitative de la réaction entre l'acide chlorhydrique $HCl$ et la soude $NaOH$
Versons goutte à goutte une solution de soude $NaOH$ dans une solution d'acide chlorhydrique $HCl$ Leur réaction produit :
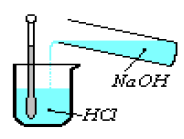
III.1.1 Un dégagement de chaleur
L'élévation de la température que l'on note au niveau du thermomètre montre que la réaction entre l'acide et la base produit de la chaleur : c'est une réaction exothermique.
III.1.2 Un sel et de l'eau
Chauffons à siccité la solution obtenue à la fin de la réaction.Des cristaux de sel apparaissent après l'évaporation de l'eau :
Ce sel est du chlorure de sodium $NaCl$ communément appelé sel de cuisine

Conclusion :
bilan de la réaction
La réaction entre l'acide chlorhydrique $HCl$ et la solution d'hydroxyde de sodium $NaOH.$
Dégage de la chaleur et produit de l'eau $H_2O$ sel de cuisine $NaCl.$
$$HCl \qquad + \qquad NaOH \longrightarrow NaCl \qquad + H_2O$$
Généralisation
Une solution acidproduit un sel et e et une solution basique réagissent toujours entre elles. Leur réaction exothermique produit du sel et de l'eau
$$\text{Acide} \qquad+\qquad \text{Base} \longrightarrow \text{Sel} \qquad+ \qquad \text{eau}$$
\begin{array}{lcl}
\text{N.B. Une réaction chimique est dite :} &➭&\text{Exothermique Esi elle dégage de chaleur}\\
&➭ &\text{Endothermique quand elle absorbe de la chaaleur.}\\
&➭& \text{Athermique si elle n'absorbe ni ne dégage de la chaleur.}
\end{array}
$$\text{Acide} \qquad+\qquad \text{Base} \longrightarrow \text{Sel} \qquad+ \qquad \text{eau}$$
\begin{array}{lcl}
\text{N.B. Une réaction chimique est dite :} &➭&\text{Exothermique Esi elle dégage de chaleur}\\
&➭ &\text{Endothermique quand elle absorbe de la chaaleur.}\\
&➭& \text{Athermique si elle n'absorbe ni ne dégage de la chaleur.}
\end{array}
III.2 Étude quantitative
III.2.1 La neutralisation
Expérience
Laissons tomber goutte à goutte une solution de soude sur une solution d'acide chlorhydrique additionnée de quelques gouttes de $BBT.$
Attention ! La coloration verte est très difficile à observer à cause de l'inévitable goutte de base de trop : la solution devient bleue.

Observations
L'acide et la base réagissent progressivement et la coloration jaune de l'acide persiste.
La première goutte de base qui fait virer le $BBT$ indique l'épuisement de l'acide qui est alors neutralisé par la base.
On parle alors de la neutralisation de l'acide par la base.
N.B.
L'étape du virage de l'indicateur coloré est appelée point d'équivalence de la neutralisation.
Relation de neutralisation
Le point d'équivalence ou virage du $BBT$ traduit une équivalence (égalité) entre le nombre de moles d'acide $n$ et le nombre de mole de base $n_b$ :
c'est l'équivalence acido - basique.
$n_a = n_b$
Or $n_a=C_aV_a$ et $n_b=C_bV_b$
Donc on peut écrire : $C_a \ a$ $bV_b$
N.B.
$a$ pour l'acide chlorhydrique $HCl$ et $b$ pour la solution basique de soude $NaOH$.
Objectif
Le dosage ou titrage d'une solution est la détermination de la concentration (titre) inconnue d'une solution à partir de celle (titre) connue d'une autre solution :
c'est une application de la neutralisation.
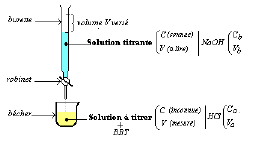
Le matériel
Une burette : tube gradué avec un dispositif d'écoulement maîtrisable(robinet) fixée à une potence.
Un bêcher ou un erlemeyer pour contenir la solution à titrer
Une pipette jaugée pour mesurer l'échantillon à doser.
Un agitateur (souvent magnétique) pour uniformiser la solution.
Protocole et schéma de l'expérience
➭ Introduire, dans la burette, la solution de concentration connue $C_b$ : solution titrante $NaOH$
➭ Prélever à la pipette un volume $V$ de la solution de concentration inconnue $C_a.$
➭ Placer la solution à titrer prélevé dans l'erlenmeyer (ou le bêcher) en y ajoutant des gouttes de $BBT.$
➭ Laisser tomber goutte à goutte la solution titrante sur la solution à titrer.
➭ Arrêter l'écoulement dès le virage du $BBT$ qui indique la neutralisation de l'acide par la base.
➭ Lire alors, sur la burette, le volume $V$ de la solution titrante versée.
Résultat expérimental
En appliquant la relation de neutralisation, on trouve la concentration $C_a$ inconnue.
$C_aaV_a = C_bV_b \Rightarrow C_a \frac{C_bV_b}{V_b}$

Commentaires
Cinf (non vérifié)
ven, 01/18/2019 - 23:43
Permalien
Eléve
Khadidjatou mbengue (non vérifié)
jeu, 01/24/2019 - 20:56
Permalien
Eleve
sididione (non vérifié)
mer, 03/23/2022 - 23:39
Permalien
Merci pour m'avoir m'aide à
Pape Samba Sow (non vérifié)
dim, 02/05/2023 - 02:31
Permalien
Avoir mon bfem
Ami gueye (non vérifié)
dim, 06/02/2024 - 20:36
Permalien
Apprendre
Élève 3è (non vérifié)
jeu, 04/09/2020 - 23:12
Permalien
Acide et base
Fatou (non vérifié)
mer, 01/27/2021 - 23:32
Permalien
Fatick
MOHAMED FALL (non vérifié)
ven, 06/19/2020 - 15:37
Permalien
J'aime
Awa (non vérifié)
jeu, 09/10/2020 - 18:24
Permalien
Trés intéressant
mizo (non vérifié)
dim, 01/10/2021 - 01:09
Permalien
élevé
Daouda Seck (non vérifié)
lun, 01/18/2021 - 16:34
Permalien
Eleve
Calibri (corps) (non vérifié)
jeu, 04/22/2021 - 00:01
Permalien
pas assai de cour
Anonyme (non vérifié)
mer, 05/19/2021 - 19:18
Permalien
doul
Baye samba diop (non vérifié)
ven, 04/23/2021 - 21:25
Permalien
Sur le site
FRANCOIS LEMOU FAYE (non vérifié)
dim, 05/16/2021 - 20:38
Permalien
COMPREHENSION SUR LES ACIDES ET BASES
Fatou Ndiaye (non vérifié)
dim, 05/23/2021 - 21:28
Permalien
satisfaction
Papis Diop (non vérifié)
mer, 02/09/2022 - 19:48
Permalien
Commentaires
Sall Aminata (non vérifié)
sam, 06/11/2022 - 21:25
Permalien
Ce cours est intéressant
Anonyme
mar, 11/29/2022 - 12:08
Permalien
compréhensible
Anonyme (non vérifié)
jeu, 01/12/2023 - 07:18
Permalien
Merci
Anonyme (non vérifié)
ven, 03/10/2023 - 22:17
Permalien
Pourquoi ne pas créer une
Cheikh tidiane ... (non vérifié)
lun, 03/25/2024 - 01:41
Permalien
Ingénieur
Ajouter un commentaire