Série d'exercice : Les généralités de la chimie organique - 1e s
Classe:
Première
Exercice 1
Mots croisés :
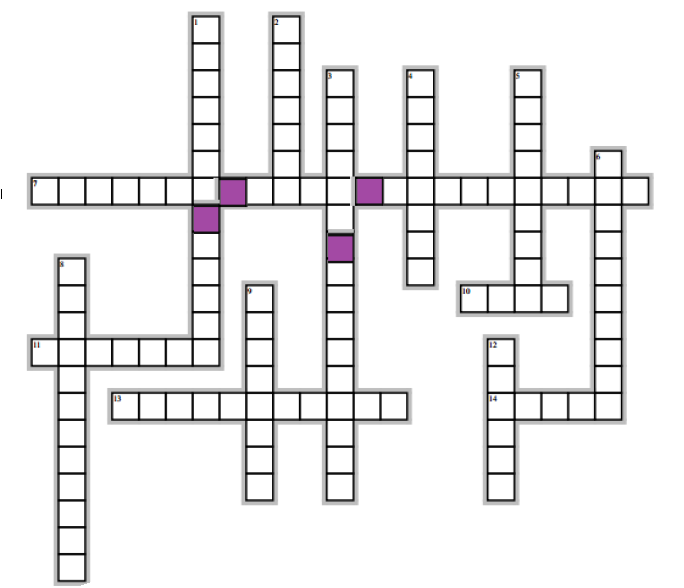
Horizontalement
7) Écriture simplifiée d'une formule développée
10) Premier composé organique synthétisé
11) Elle s'oppose à la synthèse.
13) Son étude permet déterminer la nature des éléments présents dans composé organique
14) Élément dont sa présence est prouvée, dans un composé organique, par la formation de l'ammoniac lors d'une réaction chimique
Verticalement
1) Elle renseigne sur le nombre d'atomes présents dans une molécule
2) Élément qui définit la chimie organique ( ou élément présent dans tous les composés organiques)
3) Chimie de l'élément carbone
4) composés ayant la même formule brute mais de formules développées ou semi-développées différentes
5) Élément dont sa présence est prouvée dans un composé organique par formation de l'eau lors d'une combustion
6) Dans la formule, les toutes liaisons sont représentées
8) Études qui donne le nombre d'atomes présents dans une molécule organique
9) Ces isomères qui différent l'enchainement des atomes de carbone
Exercice 2
1.1. Indiquer si les composés chimiques suivants sont des composés organiques ou minéraux :
$NO_{2}$ ; $C_{4}H_{10}$ ; $NH_{3}$ ; $CO$ ; $C_{2}H_{3}Cl$ ; $C_{7}H_{5}O_{2}Na$ ; $C$
2. le glucose a pour formule $C_{6}H_{12}O_{6}$
Calculer sa masse molaire et déterminer sa composition centésimale massique (en Carbone, Hydrogène et Oxygène).
Exercice 3
L'analyse quantitative de l'urée montre que le composé est constitué de $26.7\%$ d'oxygène, $20.0\%$ de carbone, $46\%$ d'azote et l'élément hydrogène y est présent.
Établir sa formule moléculaire brute sachant que sa masse molaire vaut $60\,g/mol.$
Exercice 4
Un composé organique gazeux a, dans les conditions normales, une masse volumique égale à $\rho=1.34\,kg\cdot m^{-3}.$
Déterminer sa formule brute sachant qu'il ne renferme que du carbone, de l'hydrogène et de l'oxygène avec les pourcentages massiques suivants : $C\ :\ 40.0\%\ ;\ H\ :\ 6.67\%.$
Exercice 5 : Formule brute de la chlorophylle
La chlorophylle, pigment végétal vert qui confère aux végétaux le possédant la fonction d'assimilation du carbone par photosynthèse, est une macromolécule qui renferme dans sa structure les éléments carbone, hydrogène, oxygène, azote et magnésium.
L'oxydation d'une masse $m=10\,g$ de chlorophylle produit $27.13\,g$ de dioxyde de carbone et $7.29\,g$ d'eau.
La destruction de $10\,g$ de chlorophylle en l'absence totale d'azote produit $0.504\,L$ de diazote dans les conditions normales de température et de pression.
Par ailleurs, la chlorophylle renferme en masse $2.69\%$ de magnésium et sa molécule ne contient qu'un seul atome de magnésium.
$1-\ $ Déterminer la composition centésimale massique de la chlorophylle.
$2-\ $ Calculer la masse molaire de la chlorophylle.
$3-\ $ Déduire de ce qui précède la formule brute de la chlorophylle.
$4-\ $ Sachant que $500\,g$ de feuilles de laitue contiennent environ $1\,g$ de chlorophylle, calculer la masse de magnésium absorbée lorsqu'un individu consomme $200\,g$ de salade.
Quel est le nombre d'atomes de magnésium correspondant ?
On donne :
volume molaire : $V_{m}=24\cdot L\cdot mol^{-1}$ et $M_{c}=12\,g\cdot mol^{-1}$ ; $M_{H}=1\,g\cdot mol^{-1}$ ; $M_{O}=16\,g\cdot mol^{-1}$,
$M_{N}=14\,g\cdot mol^{-1}$ ; $M_{Mg}=24\,g\cdot mol^{-1}.$
Exercice 6
Soit un composé organique $A$ contenant du carbone, de l'hydrogène, de l'oxygène et de l'azote.
La combustion de $1.40\,g$ de ce composé produit $3.48\,g$ de gaz dont $2.38\,g$ sont absorbable par la potasse et le reste par les ponces sulfuriques.
L'azote contenu dans ce composé peut être libéré dans certaines conditions sous forme de diazote.
Le diazote recueilli à partir de $0.70\,g$ de ce composé est égal à $76\,cm^{3}$ dans les conditions normales.
Le composé $A$ ne contient qu'un seul atome d'azote par molécule.
$1-\ $ Déterminer les masses de carbone, d'hydrogène d'azote et d'oxygène contenus dans $1.40\,g$ de $A.$
$2-\ $ Quelle est la composition centésimale massique du composé $A.$
$3-\ $ Déduire la formule brute de $A.$
Exercice 7
On veut déterminer la formule brute d'un liquide $A.$
Ce liquide est inflammable et sa molécule est composée des éléments : carbone, hydrogène et oxygène.
1. Comment peut-on montrer la présence des éléments carbone et hydrogène dans le liquide $A$ ?
2. On vaporise $1.20\,g$ de liquide $A.$
Le gaz obtenu occupe un volume de $0.62\,L$ dans des conditions pour lesquelles le volume molaire des gaz est $V_{m}=31.0\,L\cdot mol^{-1}.$
Déterminer :
2.1. La quantité de gaz correspondant à $1.20\,g$ de gaz
2.2. La masse molaire de $A.$
3. L'analyse de $A$ montre que les proportions massiques centésimales sont les suivantes :
$\bullet\ $ carbone $60.0\%$
$\bullet\ $ hydrogène $13.3\%$
$\bullet\ $ oxygène $26.7\%$
3.1. Déterminer les masses de carbone d'hydrogène et d'oxygène dans une mole.
3.2. En déduire la formule brute de $A.$
4. Proposer deux formules semi-développées différentes de $A.$
Données :
$$\begin{array}{|c|c|c|c|} \hline \text{Eléments}&\text{carbone}&\text{oxygène}&\text{hydrogène}\\ \hline \text{masses molaires}&12&16&1\\ g\cdot mol^{-1}& & &\\ \hline \end{array}$$
Exercice 8
La combustion complète d'un échantillon d'un hydrocarbure (ne renferme que de l'hydrogène et du carbone) de masse $m=0.44\,g$ et de formule brute $C_{x}H_{y}$ a produit $1.32\,g$ d'un gaz qui trouble l'eau de chaux.
1. Calculer la masse de carbone existant dans $1.32\,g$ de $CO_{2}.$
En déduire le pourcentage de carbone dans l'échantillon.
2. Déduire le pourcentage d'hydrogène dans l'échantillon.
3. Sachant que la masse molaire de l'hydrocarbure est $44\,g\cdot mol^{-1}$.
Écrire une relation entre $x$ et $y.$
4. En appliquant la règle du pourcentage à une mole, déterminer $x$ et $y.$
Exercice 9
L'analyse élémentaire de l'aspirine (est un acide) a donné la composition centésimale massique :
$\%C=60\ ;\ \%H=4.5\text{ et }\%O=35.5.$
Pour déterminer la masse molaire de l'aspirine on réalise les opérations suivantes :
$-\ $ On dissout $0.1\,g$ d'aspirine dans $50\,mL$ d'eau.
$-\ $ On prélève $10\,mL$ de la solution obtenue qu'on dose par une solution de soude $0.01\,M$, l'équivalence acido-basique est atteinte pour un volume de soude versé égal à $11.1\,mL.$
1. Calculer la masse molaire de l'aspirine.
2. Déterminer la formule brute de l'aspirine.
Exercice 10
La combustion complète d'un échantillon de masse $m$ d'un composé organique ne contenant que du carbone et de l'hydrogène $\left(C_{x}H_{y}\right)$ a donné $2.2\,g$ d'un gaz qui trouble l'eau de chaux et $0.9\,g$ d'eau.
1. Calculer la masse de carbone et la masse d'hydrogène contenu dans l'échantillon.
En déduire $m.$
2. Calculer le pourcentage de carbone et d'hydrogène dans le composé.
3. Sachant que la masse molaire du composé est $70\,g\cdot mol^{-1}$, Déterminer sa formule brute.
4. Écrire l'équation de la réaction de combustion.
5. Calculer le volume de dioxygène nécessaire à cette combustion.
On donne $V_{M}=24\,L\cdot mol^{-1}$
Exercice 11
Un composé organique pur $A$ de formule brute $C_{x}H_{y}O_{z}$ et de masse molaire moléculaire $M.$
La combustion complète d'une masse $m$ de $A$ dans un volume $V_{t}$ de dioxygène donne $8.8\,g$ d'un gaz qui trouble l'eau de chaux et $4.5\,g$ d'eau.
Il reste un excès de $2.8\,L$ de dioxygène.
1. Écrire l'équation équilibrée de la réaction de combustion.
2. En utilisant la correspondance en nombre de mole montrer que $5x=2y.$
On donne :
$M_{H}=1\,g\cdot mol^{-1}$, $M_{C}=12\,g\cdot mol^{-1}$ et $M_{O}=16\,g\cdot mol^{-1}$
3. On donne le volume de dioxygène utilisé $V_{_{t}}=10\,L$
3.1. Calculer le volume $v_{O_{2}}$ de dioxygène ayant réagi.
3.2. Montrer que $x=4z$ et $y=10z.$
On donne $V_{M}=24\,L\cdot mol^{-1}$
4. Sachant que $M=74\,g\cdot mol^{-1}$,
4.1. Déterminer la formule brute de ce composé
4.2. Calculer la masse $m.$
4.3. Déterminer la composition massique de ce composé en carbone, hydrogène et oxygène.
Exercice 12
On soumet à l'analyse élémentaire $0.45\,g$ d'un composé organique gazeux.
Sa combustion produit $0.88\,g$ de dioxyde de carbone et $0.63\,g$ d'eau ; par ailleurs, la destruction d'une même masse de substance en l'absence totale d'azote conduit à la formation de $0.17\,g$ d'ammoniac $NH_{3}$ (méthode de Kjeldahl).
$1-\ $ Déterminer les masses de carbone, d'hydrogène et d'azote contenues dans les $0.45\,g$ du composé.
Celui-ci, contient-il de l'oxygène ?
$2-\ $ Quelle est la composition centésimale du composé ?
$3-\ $ Sachant que dans les $C.N.T.P$ la masse volumique du composé est voisine de $2g/L$, calculer une valeur approchée de sa masse molaire et déterminer sa formule brute
Exercice 13
La nitroglycérine est un composé organique ne contenant que du carbone, de l'hydrogène, de l'oxygène et de l'azote.
L'analyse élémentaire de la substance donne les résultats suivants :
$C\ :\ 15.90\%\ ;\ H\ :\ 2.20\%\ ;\ N\ :\ 18.50\%.$
$1-\ $ Trouver sa formule brute sachant que sa densité de vapeur vaut $d=7.82.$
$2-\ $ Ce composé, liquide à température ordinaire, explose au moindre choc.
La réaction très exothermique, produit du dioxyde de carbone, de l'eau du diazote et du dioxygène.
$2.1-\ $ Écrire l'équation bilan de la réaction de décomposition.
$2.2-\ $ Calculer le volume gazeux total libéré par l'explosion de $10\,g$ de nitroglycérine
On donne $V_{M}=24\,L\cdot mol^{-1}$
Exercice 14
La Combustion complète d'un composé organique de masse $m=1\,g$ de formule brute $C_{x}H_{y}O_{z}$ et ayant un seul atome d'oxygène a donné $m_{1}=2.88\,g$ de dioxyde de carbone et $m_{2}=1.22\,g$ d'eau.
1) Détermine les pourcentages massiques des éléments chimiques contenus dans ce composé organique
2) Déduis-en sa formule brute
3) Calcule sa masse molaire puis sa densité par rapport à l'air.
Données :
masse molaire atomique $(g/mol)$ :
$M_{C}=12$ ;
$M_{H}=1$
$M_{O}=16$
Correction des exercices

Commentaires
Anonyme (non vérifié)
ven, 04/03/2020 - 09:39
Permalien
pdf
Ouandaogo HAMADOU (non vérifié)
mar, 09/21/2021 - 17:24
Permalien
Avoir basse
nkounkou (non vérifié)
ven, 12/03/2021 - 00:42
Permalien
cours et amelioration
Astou Ndiaye (non vérifié)
jeu, 01/12/2023 - 22:11
Permalien
Avoir de bonnes notes
fatou dieme (non vérifié)
mar, 11/26/2024 - 20:21
Permalien
avoir de bonnes notes
Alpha (non vérifié)
mer, 11/08/2023 - 18:44
Permalien
Chimie
Scofield (non vérifié)
mar, 10/04/2022 - 21:00
Permalien
Études
joseph (non vérifié)
sam, 10/09/2021 - 18:45
Permalien
étude
diarrassouba (non vérifié)
mer, 11/03/2021 - 14:11
Permalien
Télécharger
Youssouf khassim (non vérifié)
mer, 06/08/2022 - 19:19
Permalien
Version pdf
Kabore (non vérifié)
sam, 09/17/2022 - 08:30
Permalien
Cedric
Kabore (non vérifié)
sam, 09/17/2022 - 08:32
Permalien
Cedric
Sidibe (non vérifié)
mer, 11/08/2023 - 07:29
Permalien
Bosser
Dhia (non vérifié)
ven, 12/01/2023 - 22:12
Permalien
Ok
Boubacar Diarra (non vérifié)
dim, 12/03/2023 - 08:16
Permalien
D'avoir la correction
Mariama diallo (non vérifié)
jeu, 11/06/2025 - 21:33
Permalien
Correction des exos
Adama Diouf (non vérifié)
sam, 11/28/2020 - 15:46
Permalien
PC
Mouhamed sarry (non vérifié)
dim, 11/29/2020 - 14:07
Permalien
Je veux la correction
Modou (non vérifié)
dim, 01/03/2021 - 08:21
Permalien
Etudie
Modou (non vérifié)
dim, 01/03/2021 - 08:22
Permalien
Reussit
Modou (non vérifié)
dim, 01/03/2021 - 08:24
Permalien
Reussit
Anonyme (non vérifié)
jeu, 01/07/2021 - 15:26
Permalien
Exo 6
mané (non vérifié)
dim, 01/10/2021 - 18:58
Permalien
exercice
Serigne mbacke (non vérifié)
sam, 10/18/2025 - 11:55
Permalien
Correction
Mback3 (non vérifié)
ven, 01/15/2021 - 18:13
Permalien
Travail
Aly diop (non vérifié)
lun, 11/15/2021 - 00:08
Permalien
La correction
Ablaye NDIAYE (non vérifié)
ven, 12/04/2020 - 17:39
Permalien
Correction
abdallah (non vérifié)
dim, 04/11/2021 - 19:50
Permalien
Correction
Mo (non vérifié)
mar, 03/09/2021 - 20:20
Permalien
Terre
MaroBouba (non vérifié)
mar, 04/27/2021 - 15:40
Permalien
Correction pc
Cheikh akhmadou... (non vérifié)
jeu, 09/08/2022 - 16:23
Permalien
Chimie organique
Bassirou (non vérifié)
mar, 12/01/2020 - 17:53
Permalien
Pour réussir
Bâ (non vérifié)
mer, 12/02/2020 - 17:00
Permalien
Pour réussir
Anonyme (non vérifié)
ven, 12/11/2020 - 01:44
Permalien
C'est efficace
MamadouThiam (non vérifié)
ven, 12/25/2020 - 11:28
Permalien
Besoin d'aide
Anonyme (non vérifié)
ven, 12/25/2020 - 11:29
Permalien
C'est ce qu'il nous fallait!!
APA ROMARIC ALE... (non vérifié)
mer, 02/10/2021 - 21:00
Permalien
DEMANDE D EXERCICES
Assane ciss (non vérifié)
mar, 02/02/2021 - 17:41
Permalien
Correction
kalidou diallo (non vérifié)
mar, 11/23/2021 - 20:23
Permalien
correction
DOJA (non vérifié)
dim, 11/06/2022 - 08:51
Permalien
REPONSE
Ndiaye (non vérifié)
mar, 03/02/2021 - 07:38
Permalien
Élevé de 1 ére S
Elhadji Amath T... (non vérifié)
sam, 12/02/2023 - 00:31
Permalien
Faire d’exo
A télécharger ?? (non vérifié)
lun, 11/15/2021 - 01:34
Permalien
A télécharger ??
Mouhamad (non vérifié)
mar, 11/16/2021 - 14:58
Permalien
Je veux la solution des exercices
nkounkou (non vérifié)
ven, 12/03/2021 - 00:47
Permalien
cours et excercice en svt
Je m'appelle Pa... (non vérifié)
mar, 11/23/2021 - 17:28
Permalien
Demande
Sangare (non vérifié)
ven, 11/26/2021 - 19:27
Permalien
Pc
Anonyme (non vérifié)
sam, 01/01/2022 - 13:07
Permalien
super
Mami (non vérifié)
lun, 09/26/2022 - 16:51
Permalien
Demande
Mima (non vérifié)
mer, 10/12/2022 - 00:53
Permalien
La correction
Pages
Ajouter un commentaire