Exercices sur les solutions aqueuses -3e
Classe:
Troisième
Exercice 1
remplir la grille ci-dessous
Horizontalement
1 corps qui se dissolvent
2 relative à la masse par volume de solution
4 la solution l'est quand on augmente son solvant
7 elle caractérise la solution et peut être massique ou molaire
10 elle augmente la concentration en diminuant le solvant.
Verticalement :
1 quantitative, elle représente la quantité maximale soluble d'une substance.
7 ses constituants sont : le solvant et le soluté
12 celui de la solution aqueuse est l'eau.
14 relatif à la mole
18 pour un mélange, on obtient une solution

Exercice 2
Trouver la molarité de chacune des solutions suivantes obtenues par la dissolution de :
1) $0.3\;mol$ de $NaOH$ dans $4\;L$ d'eau.
2) $29.25\;g$ de $NaCl$ dans $250\;mL$ d'eau.
3) $56\;mL$ de gaz chlorhydrique dans les conditions normales dans $10\;L$ d'eau.
Exercice 3
Calculer la masse de cristaux d'hydroxyde de sodium $NaOH$ nécessaire à la préparation de $250\;mL$ de soude 0.5 molaire.
Exercice 4
On prépare une solution en dissolvant $100\;g$ chlorure de calcium $CaCl_{2}$ dans $500\;mL$ d'eau distillée. Trouver la concentration massique de la solution obtenue et en déduire sa molarité.
Exercice 5
Une solution de concentration $C=5.10^{-2}\;mol/L$ est diluée 5 fois. Trouver la molarité de la solution diluée ainsi obtenue.
Exercice 6
Dans un laboratoire, on dispose d'une solution d'acide chlorhydrique $HCl$ dimolaire en volume suffisant. Indiquer, l'opération et les quantités à prendre pour préparer $200\;mL$ d'acide chlorhydrique décimolaire.
Exercice 7
Une solution $A$ a une concentration $C_{A}=0.1\;mol/L$. On prélève $50\;mL$ de $A$ auxquels on ajoute $450\; mL$ d'eau ; on obtient alors une solution $B$ que l'on dilue 10 fois pour obtenir une solution $C$. Quelle est
1) La concentration molaire de la solution $B$ ?
2) La molarité de la solution $C$ ?
Exercice 8
Pour obtenir $200\;ml$ de solution de soude $NaOH$ de concentration $10^{-2}\;mol/L$, on dissout des pastilles d'hydroxyde de sodium $NaOH$ dans l'eau.
1) Quelle masse d'hydroxyde de sodium a-t-on utilisée ?
2) On prélève $50\;mL$ de cette solution de soude que l'on dilue en y ajoutant $450\;mL$ d'eau, trouver la molarité de la solution diluée obtenue.
Exercice 9
Sur l'étiquette d'une bouteille d'acide chlorhydrique on peut lire :
Acide chlorhydrique commercial.
Masse volumique $\\mu=1190\;kg/m^{3}$
Pourcentage en masse d'acide pur $37\%$.
Masse molaire du chlorure d'hydrogène $HCl=36.5\;g/mol$.
1) Calculer la concentration molaire de cette solution d'acide chlorhydrique.
2) On prélève $1\;mL$ de cette solution que l'on dilue en y ajoutant de l'eau pour obtenir $500\;mL$ de solution. Trouver la concentration molaire de la solution diluée obtenue.
Exercice 10
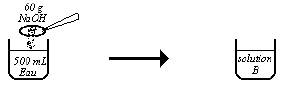
Le schéma ci-contre est celui de la préparation d'une solution.
1) Calculer la concentration massique de la solution $B$ et en déduire sa concentration molaire.
A cette solution $B$, on ajoute $300\;mL$ d'eau et on obtient alors une solution $C$.
2) Comment a-t-on obtenu cette solution $C$ ; trouver sa molarité.
Exercice 11
L'eau de mer contient en moyenne $29.25\;g$ de sel $NaCl$ par litre.
1) Trouver la concentration molaire de cette eau salée.
2) On prélève $100\;cm^{3}$ de cette eau de mer et on évapore $20\%$ de son volume initial ; trouver la concentration molaire de la nouvelle solution salée obtenue.
Exercice 12
soit le tableau ci-contre :
$$\begin{array}{|c|c|c|}\hline C(mol.L^{-1}) & C_{m}(g.L^{-1}) & M(g.mol^{-1}) \\ \hline 5 & & 40 \\ \hline & 20 & 36.5 \\ \hline\end{array}$$
1) Que représente chacune de ces grandeurs
2) Écrire la relation qui existe entre ces grandeurs
3) Compléter le tableau
$BFEM\ :\ Juillet\; 2000$
Activité
Fatou veut préparer $50\,mL$ d'une solution aqueuse de saccharose de concentration massique $Cm=90\,g\cdot L^{-1}$ par dissolution de saccharose (sucre du commerce) de formule $C_{12}H_{22}O_{11}$
1) Quelle masse de saccharose doit-elle peser ?
2) Elle dispose du matériel suivant : balance de précision, cuillère, coupelle, entonnoir, fiole jaugée de $50\,mL$, pissette, eau.
Décris le mode opératoire pour préparer cette solution.
Exercice 13 Contrôle de connaissances
Recopie le texte et complète les phrases avec les mots ou groupes de mots suivants :
solvant ; solution ; dissout ; masse ; concentration ; sucre ; saturée ; quantité de matière ; soluté ; eau.
1) La concentration molaire d'une solution est la ............ de soluté par litre de solution.
2) La concentration massique d'une solution est la ........... de .............. par litre de solution.
3) Une solution ............... est une solution pour laquelle le solvant ne peut plus dissoudre le soluté à une température donnée.
4) Le soluté est le corps qui se ................ dans la solution.
5) Dans une solution aqueuse de sucre, le soluté est ............. le solvant est ..................
6) Augmenter le volume du solvant d'une solution, c'est faire une ............ ; dans ce cas la .............. de la solution diminue.
Exercice 14 Relation entre concentration molaire et concentration massique
Choisis la lettre correspondant à la bonne réponse.
La relation entre la concentration molaire $C$ et la concentration massique $Cm$ et la masse molaire $M$ est :
a) $C=\dfrac{Cm}{M}$
b) $C=\dfrac{M}{Cm}$
c) $C=Cm\times M$
Exercice 15 Préparation d'une solution par dissolution d'un soluté solide
Une solution est obtenue en dissolvant une masse $m=14.2\,g$ de sulfate de sodium $\left(Na_{2}SO_{4}\right)$ dans de l'eau et en complétant le volume à $500\;ml.$
1) Calculer la concentration massique $Cm$ de cette solution.
2) Calculer de deux façons différentes la concentration molaire $C$ de cette solution.
Données :
masses molaires atomiques : $M(Na)=23\,g\cdot mol^{-1}$ ; $M(S)=32g\cdot mol^{-1}$ ; $M(O)=16\,g\cdot mol^{-1}$
Exercice 16 Préparation d'une solution par dissolution d'un soluté gazeux.
Dans un volume $V=500\,ml$ d'eau distillée, on dissout un volume $v=0.12L$ de chlorure d'hydrogène $HCl.$
Le volume $v$ est mesuré dans les conditions où le volume molaire est égal à $24L\cdot mol^{-1}.$
1) Calcule la concentration molaire de la solution obtenue.
2) Quelle est la quantité de matière de chlorure d'hydrogène contenue dans un prélèvement de $20\,cm^{3}$ de cette solution.
Exercice 17 Détermination de la masse molaire d'un composé
Une solution est obtenue par dissolution de $24\,g$ d'un soluté dans $1.2L$ d'eau pure.
La dissolution se fait par ailleurs sans changement de volume.
1) Calcule la concentration massique de la solution.
2) En déduis la masse molaire moléculaire $M$ du soluté sachant la concentration molaire volumique de la solution est $C=0.5\,mol\cdot L^{-1}$
Exercice 18 Identification de solutions
Un élève a perdu les étiquettes de $2$ flacons d'eau salée.
Il sait seulement que l'eau se trouvant dans un des flacons est plus concentrée en sel (plus salée) que l'autre.
Par un raisonnement rigoureux et scientifique, propose, étape par étape, une expérience qui permet d'identifier la solution la moins concentrée.
Exercice 19 Dilution d'une solution
On dispose d'une solution aqueuse $S$ de chlorure de sodium de concentration molaire $C=0.4\,mol\cdot L^{-1}.$
La réalisation de $50\,mL$ d'une solution $S_{1}$ est obtenue par dilution de $5.0\,mL$ de la solution $S$
1) Détermine la concentration molaire de la solution $S_{1}$
2) Quel volume de $S$ faut-il diluer pour préparer $500\,mL$ de solution $S_{2}$ de concentration molaire $C_{2}=0.016\,mol\cdot L^{-1}$ ?
3) Décris, schéma à l'appui, les différentes étapes de la préparation de $S_{2}.$
Exercice 20 Dilution (bis)
Une solution $S_{1}$ est réalisée par dissolution de $0.3$ mole de chlorure de sodium solide dans $200\,mL$ d'eau.
On prélève à l'aide d'une pipette $10\,mL$ de la solution $S_{1}$ et on l'introduit dans une fiole de $250\,mL.$
En complétant avec de l'eau jusqu'au trait jauge de la fiole, on obtient une solution $S_{2}.$
1) Calcule la concentration molaire $C_{2}$ de cette nouvelle solution.
2) Calcule le volume d'eau ajouté.
Exercice supplémentaire
Situation 1
Une maman a fait des analyses médicales.
Sur le bulletin des résultats on lit entre autres
$\surd\ $ Glycémie (taux de glucose dans le sang) : $1.04\cdot10^{-3} mol\cdot L^{-1}$
$\surd\ $ Cholestérol : $6.4\cdot10^{-3} mol\cdot L^{-1}$
Sur le bulletin, sont aussi indiquées les valeurs de références pour la norme
$\surd\ $ Glucose : $\left[0.76\,g\cdot L^{-1}\;;\ 1.10\,g\cdot L^{-1}\right]$
$\surd\ $ Cholestérol : $\left[1.25\,g\cdot L^{-1}\;;\ 2.0\,g\cdot L^{-1}\right]$
Cette maman doit-elle consulter son médecin ?
Justifier.
Données :
$\bullet\ $ $M$ (glucose)$=180\,g\cdot mol^{-1}$
$\bullet\ $ $M$ (cholestérol)$=388\,g\cdot mol^{-1}$
Situation 2
Dans votre quartier, un enfant est atteint de diarrhée.
Sa maman te demande conseil.
Tu lui recommandes une solution de réhydratation orale (SRO) pour éviter toute déshydratation.
Un litre de cette solution contient $20\,mg$ de sucre et $3.5\,mg$ de sel de cuisine.
Indique les masses de sucre et de sel de cuisine que l'on doit dissoudre dans une tasse de $25\,mL$ d'eau pour préparer ce remède.
$\begin{array}{c}\blacktriangleright\,\boxed{\text{Correction des exercices}}\end{array}$
Source:
irempt.ucad.sn & ADEM

Commentaires
Anonyme (non vérifié)
mar, 02/12/2019 - 08:29
Permalien
Réussite
Anonyme (non vérifié)
mar, 02/12/2019 - 08:33
Permalien
Votre site est excellente
absatou kande (non vérifié)
jeu, 08/22/2019 - 22:38
Permalien
solution
amy (non vérifié)
dim, 10/04/2020 - 22:06
Permalien
Exercice 2
Bara samb (non vérifié)
mar, 03/23/2021 - 00:52
Permalien
Etudier le PC
Arsène gueswend... (non vérifié)
mar, 04/22/2025 - 17:03
Permalien
Reussir
absatou kande (non vérifié)
jeu, 08/22/2019 - 22:38
Permalien
solution
Mouhamadou (non vérifié)
jeu, 11/21/2019 - 15:43
Permalien
Eleve
Anonyme (non vérifié)
ven, 12/06/2019 - 20:22
Permalien
Lolou nekh ne
Mimi (non vérifié)
mar, 08/18/2020 - 14:39
Permalien
remerciement
Fatima (non vérifié)
ven, 01/29/2021 - 21:55
Permalien
Seye
Anonyme (non vérifié)
lun, 02/22/2021 - 19:49
Permalien
Merci
Ndiaye (non vérifié)
lun, 02/22/2021 - 19:50
Permalien
Élève
Ali (non vérifié)
ven, 04/02/2021 - 13:08
Permalien
Merci
Yacoub (non vérifié)
ven, 04/22/2022 - 23:02
Permalien
Elève
Yacoub (non vérifié)
ven, 04/22/2022 - 23:05
Permalien
Elève
Maïrame (non vérifié)
mer, 12/13/2023 - 21:34
Permalien
Travail
Adji Ba (non vérifié)
lun, 12/04/2023 - 22:31
Permalien
Exercice PC ✅️ et application
Daniel (non vérifié)
mer, 01/29/2025 - 04:06
Permalien
Pc
bira (non vérifié)
dim, 12/17/2023 - 13:39
Permalien
commenté
Gora Wade (non vérifié)
mar, 01/16/2024 - 18:29
Permalien
Pour être un élève parfait en sciences
Kourouma fara ... (non vérifié)
ven, 03/22/2024 - 11:39
Permalien
Être un bon élève
Souadou ba (non vérifié)
ven, 02/02/2024 - 22:18
Permalien
Pc
Khady sarr Niass (non vérifié)
mar, 10/21/2025 - 22:38
Permalien
Passer en série g
Anonyme (non vérifié)
mer, 12/04/2024 - 23:34
Permalien
Très intéressant
gguok (non vérifié)
mer, 12/18/2024 - 19:35
Permalien
gtresdfghjklkjh
Tohun (non vérifié)
dim, 12/29/2024 - 01:36
Permalien
Demande de correction
Dieneba Aïdara (non vérifié)
jeu, 03/20/2025 - 02:33
Permalien
Scientifiques
Ajouter un commentaire