Série d'exercices sur les acides a-aminés - Ts
Classe:
Terminale
Exercice 1 Étude d'acides aminés
La glycémie, ou acide $2-$amino éthanoique, et l'amine sont les acides $\alpha$aminés les plus simple.
$$\begin{array}{|c|c|c|} \hline \text{Nom}&\text{Forme moléculaire}&\text{Amphion}\\ \hline \text{Glycémie}&NH_{2}-CH_{2}-COOH&N_{3}^{+}N-CH-COO^{-}\\ \hline \text{Alamine}&CH_{3}-CH-COOH&CH_{3}-CH-COO^{-} \mid \mid NH_{2} NH_{3}^{+}\\ \hline \end{array}$$
1.1 Identifier les groupes caractéristiques présents sur ces deux molécules.
1.2 Représenter l'alamine de façon à mettre en évidence le carbone asymétrique.
Combien existe-t-il de stéréoisomètres de l'alamine.
Préciser leur nature.
Qu'en est-il de la glycémie ?
2. En solution aqueuse, il se forme presque exclusivement un ion dipolaire, appelé amphion ou zwitterion (représenté dans le tableau précédent).
2.1 Définir un acide et une base selon Bronsted.
2.2 Quel est l'acide conjugué de cet amphion (on donne $pK_{A_{2}}=9.9)$ ?
Écrire alors l'équation de la réaction de cet amphion avec l'eau.
Quel est ici le rôle de l'eau ?
Celui de l'amphion ?
2.3 Quelle est la base conjuguée de cet amphion (on donne $pK_{A_{1}}=2.3)$ ?
Écrire alors l'équation de la réaction de cet amphion avec l'eau.
Quel est ici le rôle de l'eau et celui de l'amphion ?
2.4 Comment peut-on qualifier cet amphion ?
3. Les valeurs respectives des $pK_{A}$ des couples acido-basiques sont $pK_{A_{1}}=2.3$ et $pK_{A_{2}}=9.9.$
3.1 Sur un axe de $pH$, indiquer les domaines de prédominance de chaque couple de l'alamine.
3.2 On acidifie la solution aqueuse de l'alamine, on obtient un $pH$ de $2.$
Quelle est l'espèce majoritaire ?
Que se passe-t-il si la solution a un $pH=6$, un $pH=11$ ?
Exercice 2
Une solution d'amine aliphatique saturée $B$ de concentration molaire $C_{B}$ a un $Ph=11.9$ à $25^{\circ}C$
2.1 On dose un volume $V_{B}=250\,mL$ d'une solution de l'amine $B$ par une solution d'acide sulfurique de concentration molaire $C_{A}=0.1\,mol\cdot L^{-1}.$
Le volume d'acide versé pour atteindre la demi-équivalence est $V_{A}=6.25\,mL$
Montrer à l'aide de ces données que la concentration de l'amine $B$ vaut $C_{B}=0.1\,mol\cdot L^{-1}.$
2.2 Sachant que l'amine $B$ est une base faible qui se dissocie faiblement, montrer que $$pK_{A}=2pH-(pKe+\log\,C_{B})$$
En déduire la valeur du $pK_{A}$ du couple acide-base
2.3 Pour préparer $250\,mL$ de cette solution il a fallu dissoudre $1.125\;g$ d'amine
Déterminer la formule brute de l'amine.
Écrire les formules semi-développées des isomères et les nommer.
2.4 On fait réagir l'amine secondaire $B$ avec un acide carboxylique $A.$
On obtient après chauffage un composé $C$ de formule brute $C_{x}H_{y}ON$ dont l'analyse de $0.645\,g$ montre qu'il contient $0.07\,g$ d'azote
a) Déterminer la formule brute du composé $C.$
b) Écrire la formule semi-développée du composé $C$ sachant que la molécule d'acide possède un carbone asymétrique et nommer-le
c) Écrire l'équation de formation du composé $C.$
Exercice 3 (Bac 2009)
Amines, amides, acides aminés et autres sont des composés organiques azotés qui jouent un rôle important dans le fonctionnement des organismes vivants, de l'être humain en particulier, en intervenant dans un grand nombre de réactions biochimiques.
Les acides $\alpha-$aminés, en particulier, constituent les matières de base des polypeptides et des protéines qui peuvent intervenir dans les systèmes de régulation et jouer le rôle d'enzymes (catalyseurs biologiques).
1.1 Écrire la formule générale d'une amine primaire et celle d'un acide $\alpha-$aminée.
1.2 Un acide $\alpha-$aminée $A$ donne, par décarboxylation, une amine primaire $B$ de masse molaire $31\,g\cdot mol^{-1}.$
Donner la formule semi-développée et le nom de l'amine primaire $B.$
En déduire la formule semi-développée et le nom de l'acide $\alpha-$aminé $A.$
1.3 Écrire l'équation-bilan de la réaction de l'amine $B$ avec l'eau.
Préciser le couple acide/base auquel appartient $B.$
1.4 On considère une solution aqueuse de l'amine $B$ de concentration initiale $C.$
En supposant que la valeur de $C$ est telle $[OH^{-}]$ $C$, démontrer que le $pH$ de cette solution est donné par la relation : $pH=7+(pKa+\log\,C).$
En déduire la valeur du $pH$ d'une solution à $10^{-1}\,mol\cdot L^{-1}$ de l'amine.
Le $pKa$ du couple acide/base auquel appartient $B$ vaut : $pKa=10.7$
1.5 On désire synthétiser un dipeptide $D$ en mettant en évidence la liaison peptidique.
On donne la formule de l'alamine : $CH_{3}-CH_{2}-COOH$
Exercice 4
La valine est un acide $\alpha-$aminé dont la formule semi-développée est :
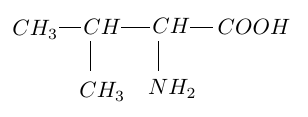
1. Donner le nom de la valine en nomenclature systématique.
2. Recopier la formule semi-développée de la valine, entourer les groupements fonctionnels caractéristiques de ce composé et donner le nom des fonctions correspondantes.
3.La valine possède un atome de carbone asymétrique.
3.1 Rappeler la définition de ce terme.
3.2 Identifier sur la formule semi-développée de la valine, le carbone asymétrique par un astérisque $\ast.$
3.3 Donner, selon Fischer, la représentation des deux énantiomètres de la valine.
Identifier la série de chacun d'eux.
4. Les solutions aqueuses de valine contiennent un ion dipolaire, appelé aussi amphion ou zwitterion.
4.1 Représenter la formule semi-développée de cet ion.
4.2 Justifier l'existence de cet ion.
4.3 Écrire les deux couples acido-basiques dont fait partie cet ion dipolaire.
4.4 Pour chacun des couples écrire l'équation de la demi-réaction correspondance.
5. On réalise une réaction de condensation entre la valine et un acide $\alpha-$aminé $X.$
Un des dipeptides obtenus a pour formule :
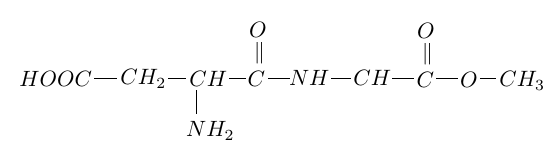
5.1 Nommer la liaison formée entre les deux acides $\alpha-$aminés.
5.2 Représenter la formule semi-développée de l'acide $\alpha-$aminé $X.$
Exercice 5 : Un dipeptide - l'aspartame
Données :
Masse molaires en $g\cdot mol^{-1}$ : $H=1\ ;\ C=12\ ;\ O=16\ ;\ N=14$
L'aspartame est un édulcorant possédant un pouvoir sucrant et qui est utilisé dans les boissons "light".
La formule de l'aspartame est :
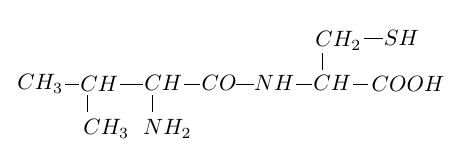
Recopier la molécule d'aspartame et répondre aux questions suivantes :
1.1 Encadrer la liaison peptidique.
1.2 D'autres groupes fonctionnels sont présents dans cette molécule.
Entourer et identifier clairement les groupes fonctionnels acides carboxyliques et ester.
1.3 Sachant que l'aspartame a pour formule brute $C_{14}H_{18}O_{5}N_{2}.$
Montrer que sa masse molaire est $M=294\,g\cdot mol^{-1}.$
1.4 Un litre de limonade allégée contient $m=0.60\,g$ d'aspartame.
1.4.1 Montrer que la quantité de matière $n_{asp}$ d'aspartame contenue dans le litre de cette limonade vaut $n_{asp}=2.0\times 10^{-3}mol.$
1.4.2 Calculer la concentration molaire $c$ en aspartame de la boisson.
2. Après consommation d'une telle boisson, l'aspartame est hydrolysé dans l'estomac.
Les produits de la réaction sont deux acides $\alpha-$aminés et du méthanol.
2.1 On donne la formule générale d'un acide $\alpha-$aminé :
Sur la formule recopiée, entourer et identifier clairement les groupes fonctionnels caractéristiques des acides $\alpha-$aminés.
2.2 Après hydrolyse, l'un des deux acides $\alpha-$aminés obtenus est la phénylalamine de formule :
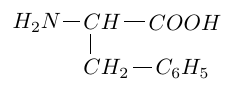
Compléter, après l'avoir recopiée, la configuration $D$ de la phénylalamine en projection de Fischer.
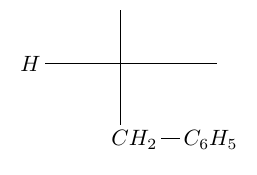
Exercice 6
Les albumines et les globulines sont des protéines globulaires (sphéroprotéines) qui se trouvent aussi bien chez les animaux que chez les végétaux.
Les albumines sont riches en acide glutamique (glutamate), en acide aspartique (aspartate), en lysine et en leucine.
Partie 1 : Étude de la leucine
La leucine est un acide $\alpha-$aminé de formule semi-développée :
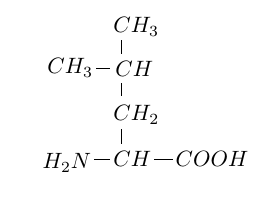
1.1 Justifier que cette molécule est bien un acide $\alpha-$aminé.
Encadrez sur la formule que vous avez recopiée sur votre copie les deux enchainements d'atomes carractéristiques.
1.2 Donner la définition d'un atome de carbone asymétrique.
1.3 Montrer que la leucine contient bien un atome de carbone asymétrique.
Le repérer sur la formule recopiée précédemment.
1.4 Cette molécule est chirale.
Justifier cette affirmation.
1.5 De part sa chiralité, cette molécule présente deux énantiomètres.
Donner le nom de chacun d'eux.
1.6 L'organisme des mammifères ne peut utiliser qu'un de ces énantiomètres.
Lequel ?
1.7 Donner la représentation de Fsher de l'énantiomètre mentionné à la question 1.6
Partie 2 : La séquence leucine-lysine
Dans les albumines, des séquences leucine-lysine alternent avec d'autres séquences.
Elles sont formés par la condensation, lors de la synthèse peptidique, d'une molécule de leucine et d'une molécule de lysine.
Cette séquence est représentée par la formule suivante.
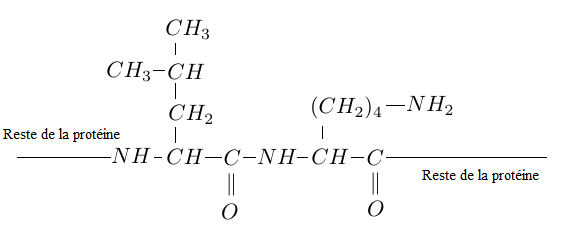
2.1 Qu'est ce qu'une protéine ?
2.2 Recopier la séquence et entourer la liaison peptidique.
2.3 Cet enchainement d'atomes est un cas particulier d'une fonction organique.
Nommer cette fonction et dessiner l'enchainement d'atomes qui la caractérise.
2.4 Quelle est la particularité géométrique de la liaison peptidique ?
2.5 La liaison peptidique peut, dans certains conditions, être hydrolysée.
Quel composé doit-on utiliser pour réaliser cette hydrolyse ?
2.6 A quel endroit de la liaison peptidique ce composé va-t-il agir ?
2.7 A partir de la séquence précédente, donner la formule de la lysine.
Partie 3 : La séquence acide glutamique-acide aspartique
Cette séquence est obtenue par la condensation d'une molécule d'acide glutamique avec une molécule d'acide aspartique lors d'une synthèse peptidique.
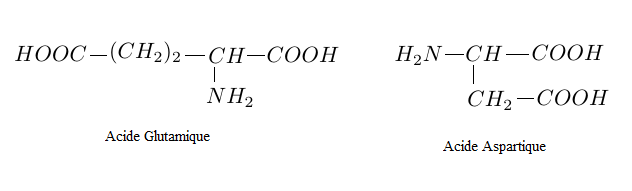
3.1 Quel composé autre que le dipeptide est formé lors de cette condensation ?
3.2 Combien de dipeptides peut-on former lors de cette réaction si on ne prend aucune précaution particulière ?
3.3 On bloque la fonction acide de l'acide aspartique et la fonction amine de l'acide glutamique afin qu'elles ne réagissent pas.
Ecrire la formule du dipeptide obtenue.
3.4 Nommer ce dipeptide à l'aide des abréviations $GLU$ pour la partie provenant de l'acide glutamique et $ASP$ pour la partie provenant de l'acide aspartique.
3.5 Nommer les autrs dipeptides qui auraient été formés sans les blocages décrit précédemment.
On donne les masses molaires $(C)=12\,g\cdot mol^{-1}\ ;\ M(N)=14\,g\cdot mol^{-1}\ ;\ M(O)=16\,g\cdot mol^{-1}\ ;\ M(H)=1\,g\cdot mol^{-1}.$
Exercice 7 Les acides $\alpha-$aminés dans l'alimentation de la femme enceinte
1. On dit parfois : Lorsqu'on attend un enfant, il faut manger pour deux.
Faut-il vraiment manger deux fois plus ou manger différemment ?
Par exemple, le développement du fœtus ainsi que celui de différents organes nécessite un apport supplémentaire en protéines.
Celles-ci doivent être équilibrées en acides aminés essentiels.
1.1 Recopier la formule générale d'un acide $\alpha-$aminé donnée ci-dessous, puis encadrer et nommer les deux groupes caractéristiques présents.
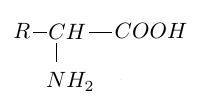
1.2 Expliquer brièvement l'appellation d'acide $\alpha-$aminé attribuée à cette molécule.
1.3 La leucine est un acide $\alpha-$aminé essentiel.
Sa formule semi-développée est :
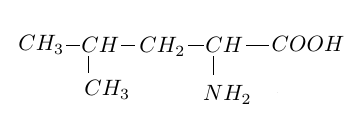
1.3.1 Définir ce qu'on appelle carbone asymétrique.
1.3.2 Recopier la formule semi-développée de la leucine et indiquer le carbone asymétrique par un astérisque $(\ast).$
1.3.3 Pourquoi la molécule de leucine est-elle chirale ?
1.3.4 Donner selon la représentation de Fischer la configuration $L$ de la leucine.
2. Dans l'organisme humain, les protéines apportés par les aliments sont décomposées par hydrolyse dans l'appareil digestif.
Les acides $\alpha-$aminés ainsi produits passent dans l'intestin et sont transportés vers les organes et les cellules.
Sous le contrôle du programme génétique, ils sont ensuite assemblés en d'autres protéines.
2.1 Recopier la formule du dipeptide suivant et entourer la liaison peptidique.
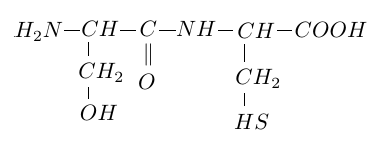
2.2 La liaison peptidique est un cas particulier d'un groupe fonctionnel caractéristique.
Lequel ?
2.3 Recopier et compléter l'équation de l'hydrolyse de ce dipeptide :
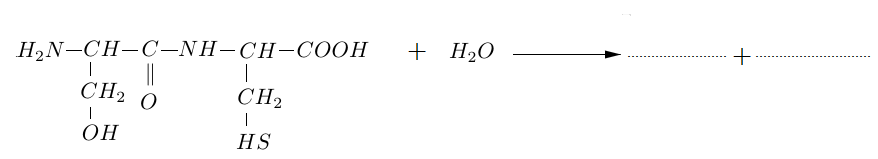
3. On considère maintenant un mélange équimolaire de deux autres acides $\alpha-$aminés : la valine, notée Val, et l'acide aspartique, noté Asp.
3.1 Par condensation entre ces deux acides $\alpha-$aminés, on obtient des dipeptides.
Qu'appelle-t-on réaction de condensation ?
3.2 Démontrer et nommer les dipeptides susceptibles d'être obtenus par condensation entre ces deux acides $\alpha-$aminés.
Exercice 8
L'alamine est l'acide $\alpha-$aminé de formule $H_{2}N-CH(CH_{3})-COOH$
1.a. Donner le nom de l'alamine en nomenclature officielle.
Justifier l'appellation acide $\alpha-$aminé.
b. Montrer que la molécule est chirale.
Donner les représentations de Fiscer des énantiomères correspondant à l'alamine et les nommer.
2. Dans la solution aqueuse d'alamine, on trouve un dipolaire.
2.1 Écrire la formule semi-développé de cet ion et la formule générale le désignant.
2.2 Écrire les formules semi-développées des autres formes ioniques susceptibles d'exister en solution aqueuse.
Quelles sont les formes ioniques par rapport à l'ion dipolaire.
2.3 Le $pK_{A}$ de l'alamine sont respectivement $pK_{1}=2.3$ et $pK_{2}=9.9$
a. Attribuer à ces valeurs le couple acide-base de l'alamine en justifiant la réponse.
b. Quelle est l'espèce chimique prépondérant à $pH=2$ et $pH=11$ ?
3. La condensation d'une molécule d'alamine et d'une molécule de glycine de formule $H_{2}N-CH_{2}-COOH$, conduit à un dipeptide.
Deux réactions sont possibles.
3.1 Écrire les équations de ces réactions en donnant les formules semi-développées des deux dipeptides que l'on peut obtenir.
3.2 Soit $A$ l'un des deux dipeptides.
Des formules trouvées au 3.1, on cherche celle qui correspond au composé $A$
Pour cela on réalise les expériences suivantes :
$-\ $ On traite $A$ par l'aide nitreux $HNO_{2}$ ; sachant que l'acide nitreux réagit sur un groupe aminé primaire suivant la réaction
$NH_{2}\ +\ HNO_{2}\ \rightarrow\ R-OH\ +\ N_{2}\ +\ H_{2}O$ ; tout en passant donc comme si le groupe $-NH_{2}$ était remplacé par le groupe $-OH.$
Écrire les formules possibles pour le composé $C$ obtenu par cette réaction.
$-\ $ Si on hydrolyse ce composé $C$, on obtient entre autres de l'acide glycolique
$$HO-CH_{2}-COOH$$
Donner l'équation de la réaction dhydrolyse et déduire les deux formules trouvées ci-dessus celle qui correspond au corps $C$ (lhydrolyse permet la coupure de la liaison peptidique entre $C$et $H$).
Quelle est la formule semi-développée du peptide $A.$
2.4 On fait réagir l'alamine secondaire $B$ avec un acide carboxylique $A.$
On obtient après chauffage un composé $C$ de formule brute $C_{x}H_{y}ON$ dont l'analyse de $0.645\,g$ montre qu'il contient $0.07\,g$ d'azote.
a. Déterminer la formule brute du composé $C.$
b. Écrire la formule semi-développée du composé $C$ sachant que la molécule d'acide possède un carbone asymétrique et nommer-le.
c. Écrire l'équation de formation du composé $C.$
Exercice 9
1) Principe de l'électrophorèse
L'électrophorèse est une méthode qui permet : de séparer différents acides $\alpha-$aminés ; de purifier des acides $\alpha-$aminés.
Ces deux opérations sont basées sur leur migration différenciée sous l'action d'un champ électrique, à $pH$ contrôlé.
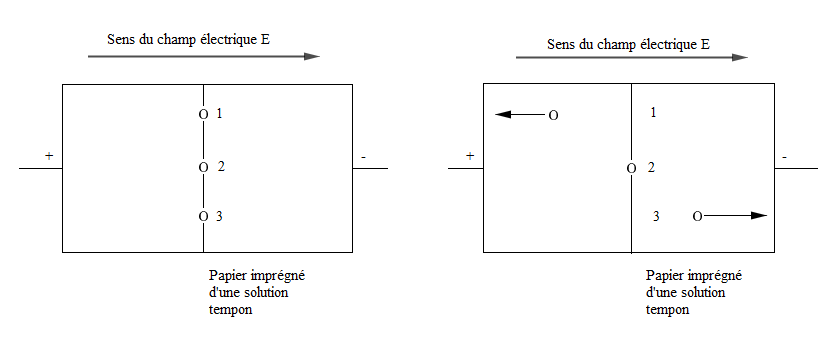
Trois acides aminés sont déposés en $1\;,\ 2$ et $3$ sur une même ligne centrale avant l'établissement du champ électrique.
A une valeur de $pH$ bien déterminer, donnée par une solution tampon, correspondant au point isoélectrique de l'acide $\alpha-$aminé $2$, en présence du champ électrique, les acides $\alpha-$aminés migrent dans un sens ou dans l'autre, selon le signe de leur charge électrique.
Seul l'acide aminé $2$ ne migre pas car il est à son $pH_{i}$ et donc pratiquement uniquement sous forme d'amphion doublement ionisé.
Remarque :
Il existe, pour chaque acide $\alpha-$aminé, une valeur du $pH$ pour laquelle l'amphion est majoritaire donc sa concentration maximale.
Ce $pH$ particulier, compris entre $pK_{a\,1}$ et $pK_{a\,2}$, est appelé point isoélectrique ; il se note $pH_{i}.$
Il est caractéristique de chaque acide $\alpha-$aminé et sa valeur est donnée par la relation :
$$pH_{1}=\dfrac{1}{2}\left(pK_{a\,1}+pK_{a\,2}\right)$$
2) La charge électrique des acides aminés
On étudie $3$ acides aminés $(A\;,\ B\text{ et }C).$
Quand on dépose un acide aminé $A$ en solution à $pH$ $6$ sur une feuille de papier filtre imbibée du tampon à $pH$ $6$ et que l'on place la feuille dans un champ électrique, l'acide aminé $A$ ne se déplace pas.
Quand la même opération est faite, dans les mêmes conditions expérimentales $-$ (c'est à dire $pH$ $6$) $-$ avec un acide aminé $B$, l'acide aminé $B$ se déplace sur la feuille de papier en direction du pôle $-.$
L'acide aminé $C$ soumis au même traitement se déplace vers le pôle $+.$
2.1 Expliquer pourquoi les $3$ acides aminés se comportent de cette manière.
L'analyse élémentaire de chaque acide aminé a fourni les résultats suivants :
$$\begin{array}{|c|c|c|c|c|c|} \hline \text{Acide aminé}&\text{Masse molaire}&\%\,N&\%\,C&\%\,O&\%\,H\\ \hline A&75&18.67&32.00&42.66&6.67\\ \hline B&146&19.18&49.31&21.92&9.59\\ \hline C&133&10.52&36.10&48.12&5.26\\ \hline \end{array}$$
2.2 Proposer une formule brute pour chaque composé et écrire la formule semi-développée.
2.3 Écrire la formule du tripeptide constitué par l'enchainement $A-B-C$

Commentaires
XAVIERA MEBINE (non vérifié)
mar, 10/27/2020 - 10:20
Permalien
Besoin de la correction de ces exercices très intéressantes.
Anonyme (non vérifié)
ven, 07/02/2021 - 21:02
Permalien
On peut avoir les corrections
Sarah (non vérifié)
mer, 05/10/2023 - 12:30
Permalien
On peut avoir la correction s
Ndeye Maréme gueye (non vérifié)
mer, 06/14/2023 - 18:19
Permalien
Fair des exercices
oumayma (non vérifié)
ven, 10/20/2023 - 15:49
Permalien
correction
Zi Sayouba (non vérifié)
mar, 06/18/2024 - 00:15
Permalien
Enseignant a la recherche de savoir
Anonyme (non vérifié)
dim, 06/23/2024 - 23:01
Permalien
Correction
Ajouter un commentaire