Généralités sur la chimie organique - 1er s
Classe:
Première
I. Présentation de la chimie organique
1. Historique
A l'origine, la chimie organique étudiait les substances des êtres vivants appartement au monde animal ou végétal.
Elle s'opposait à la chimie minérale ( chimie inorganique) qui se consacrait aux substance extraites du monde minéral, c'est-à-dire provenant des roches, des eaux naturelles, de l'atmosphère.
Ce n'est qu'en 1828 Wöhler (chimiste allemand) réussit à créer l'urée substance biologique à partir d'un composé minérale.
On comprit alors que la chimie organique obéissait aux mêmes règles que la chimie minérale.
Mais la distinction demeure en raison entre autre des propriétés particulières des composés organiques par rapport aux composés minéraux.
Ainsi les composés organiques (pétrole, gaz naturel, alcool...) sont presque combustibles, ce qui est rarement le cas des composés minéraux.
2. Définition
La chimie organique est la chimie des composés du carbone, que ces composés soient naturels ou artificiels.
Remarque
En fait il faut exclure le carbone, les oxydes de carbone $(CO\;,\ CO_{2})$, les carbonates $($ex : $CaCO_{2})$, les cyanures $($ex : $NaCN)$, les carbones $($ex : $CaC_{2}\ldots)$ qui ont tous un caractère minéral
3. Mise en évidence du carbone
3.1 Pyrolyse du sucre
La pyrolyse est la décomposition chimique subie par un composé lorsqu'il est porté par une température élevée.

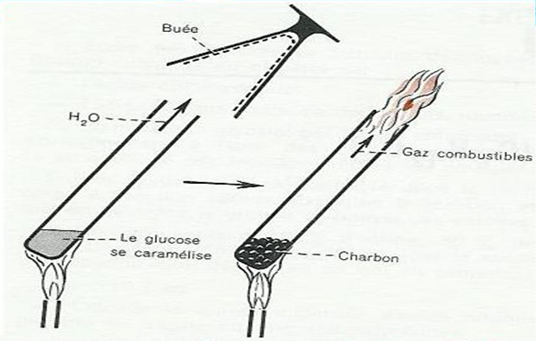
Le sucre chauffé donne résidu appelé charbon de sucre
3.2 La combustion du butane

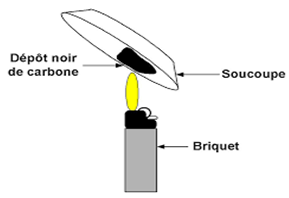

La combustion du butane donne un dépôt noir de carbone.
De même, la combustion du pétrole lampant (kérosène) donne du carbone
3.3 Action de l'oxyde du cuivre sur l'amidon
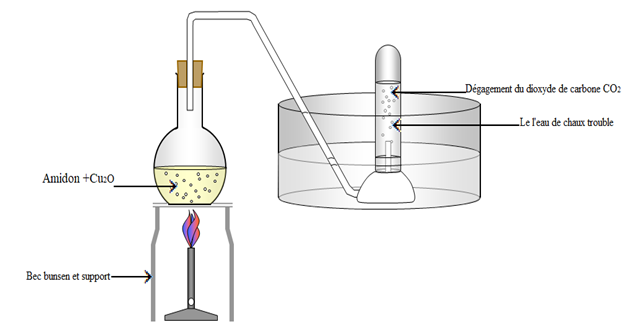
L'oxydation de l'amidon par l'oxyde de cuivre donne du dioxyde de carbone
3.3 Conclusion
La présence d'éléments carbones dans un compose peut être détectée :
$-\ $ Par pyrolyse, c'est-à-dire par chauffage
$-\ $ Par combustion avec le dioxyde de l'air
$-\ $ Par chauffage avec l'oxyde de cuivre $II$
On obtient :
$-\ $ Un dépôt de carbone
$-\ $ Un dégagement de dioxyde de carbone
$-\ $ Un dégagement d'un monoxyde de carbone
II. Analyse organique
L'analyse élémentaire des espèces organiques c'est-à-dire la détermination de la nature et des pourcentages de la nature et des pourcentages atomiques ou massique des éléments montrent qu'elles sont constituées d'un nombre limité d'élément chimiques.
1. L'analyse qualitative
L'analyse qualitative d'un composé permet de déterminer les éléments composé.
On procède généralement la combustion d'un échantillons par dioxygène ; le carbone est alors transformé en dioxyde de carbone $($absorbé par la potasse $KOH)$, l'hydrogène est transformé en eau (absorbé par l'acide sulfurique).
La présence de l'élément azote dans des substances organiques peut être mise en évidence :
$-\ $ Par la formation du cyanure des sodium $NaCN$
$-\ $ par dégagement du gaz ammoniac $NH_{3}$
Les procèdes de mise en évidence des halogènes, du soufre et du phosphore sont moins simples.
Ils se reposent sur la la transformation :
Remarque
On prouve généralement la présence d'élément oxygène après l'analyse quantitative et le dosage d'autres éléments.
2. L'analyse quantitative
L'analyse quantitative d'un composé permet de déterminer les propositions massiques des éléments constitutifs.
2.1 Composition centésimale d'un composé organique
L'analyse centésimale exprime sous forme de pourcentage la composition massique d'un corps en ses différents éléments.
$$\%X=\dfrac{m_{X}\times 100}{m_{composé}}$$
Exercice d'application
Un composé organique a pour formule brute $C_{2}H_{4}O$ ; calculer les pourcentages en carbone, en hydrogène et en oxygène pour une mole de ce $0$ corps.
On donne :
$M_{c}=12\;g\cdot mol^{-1}$ ;
$M_{H}=1.0\;g\cdot mol^{-1}$ ;
$M_{O}=16\;g\cdot mol^{-1}$
Solution :
Le pourcentage en carbone est :
$\begin{array}{lcl} \%C&=&\dfrac{2M_{C}\times 100}{M_{C_{2}H_{4}O}}\\&=&\dfrac{2\times 12\times 100}{44}\\\Rightarrow\%C&=&55 \end{array}$
Le pourcentage en hydrogène est :
$\begin{array}{lcl} \%H&=&\dfrac{4M_{H}\times 100}{M_{C_{2}H_{4}O}}\\&=&\dfrac{4\times 1\times 100}{44}\\\Rightarrow\%H&=&9.0 \end{array}$
Le pourcentage en carbone est :
$\begin{array}{lcl} \%O&=&\dfrac{M_{O}\times 100}{M_{C_{2}H_{4}O}}\\&=&\dfrac{16\times 100}{44}\\\Rightarrow\%O&=&36 \end{array}$
2.2 Détermination de la formule brute d'un composé organique
Soit $C_{x}H_{y}O_{z}N_{t}$ la formule brute d'un composé organique.
Il existe une proportionnalité entre la composition molaire et la composition centésimale
$$\dfrac{12x}{\%C}=\dfrac{y}{\%H}=\dfrac{16z}{\%O}=\dfrac{14t}{\%N}=\dfrac{M}{100}$$
III. Formule développée et semi-développée et semi-développée
1) Définition
Dans une formule développée, toutes les liaisons sont représentées par des tirets.
Dans une formule semi-développée, les liaisons d'atomes d'atomes d'hydrogène ne sont pas représentées.
2) Exemples
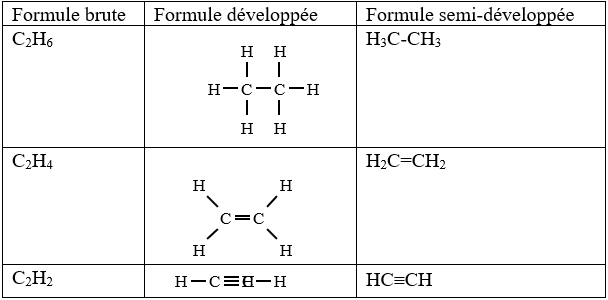
Remarque
Les formules ainsi écrites sont dites formule développées planes.
Cette écriture ne précise pas direction réelle des liaisons dans l'espace.
Elles permettent uniquement de mettre en évidence l'enchainement des atomes, c'est-à-dire l'ordre dans lequel les atomes sont liés et se suivent dans la molécule.
IV. Isomérie plane
Deux corps isomères de constitution lorsqu'ils ont la même formule brute mais qu'ils différent par l'enchainement des atomes donc par leurs formules développées.
1. Isomérie de chaine
Les isoméries de chaine ne différent que par l'enchainement des atomes de carbone.
2. Isomérie de position
Les isoméries de position différent par la position d'un groupe caractéristique ou de la liaison multiple le long à la chaine.
3. Isomères de fonction différent par la nature du groupe caractéristique qu'ils porte
Exemple :
$C_{3}H_{6}O$
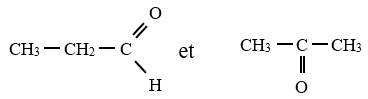
Exercice d'application :
L'urée est formé de $20.0\%$ de carbone, $6.66\%$ d'hydrogène, $26,67\%$ d'oxygène et de $46,67\%$ d'azote.
1. Déterminer la formule brute de l'urée sachant que le composé ne renferme qu'un seul atome de carbone.
2. Sachant que l'atome de carbone est doublement lié à l'atome d'oxygène et lié aux atomes d'azote par de simples liaisons, donner la formule semi-développée de l'urée.
Solution :
Détermination de la formule brute de l'urée $C_{x}H_{y}O_{z}N_{t}$
D'après la relation de proportionnalité.
$$\dfrac{12}{\%C}=\dfrac{y}{\%H}=\dfrac{16z}{\%O}=\dfrac{14t}{\%N}=\dfrac{M}{100}$$
La molécule comporte un seul atome de carbone ; donc $X=1$
$$\dfrac{12}{\%C}=\dfrac{y}{\%H}=\dfrac{16z}{\%O}=\dfrac{14t}{\%N}=\dfrac{M}{100}$$
$\begin{array}{rcl}\Rightarrow\dfrac{12}{C}&=&\dfrac{y}{\%H}\\ \\ \Rightarrow y&=&\dfrac{12\times\%H}{\%C}\\ \\ \Rightarrow y&=&\dfrac{12\times 6.66}{20.00}\\ \\ \Rightarrow y&=&4 \end{array}$
$\begin{array}{rcl} z&=&\dfrac{12\times\%O}{16\times\%C}\\&=&\dfrac{12\times 26.67}{14\times20.00}\\\Rightarrow z&=&1 \end{array}$
$\begin{array}{rcl} t&=&\dfrac{12\times\%N}{14\times\%C}\\&=&\dfrac{12\times 46.67}{14\times20.00}\\\Rightarrow t&=&2 \end{array}$
La formule de l'urée est donc : $CH_{4}ON_{2}$
2. Détermination de la formule semi-développée de l'urée brute.
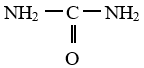

Commentaires
Alladoum (non vérifié)
dim, 10/18/2020 - 21:55
Permalien
Recherche d'un cours
Cherif (non vérifié)
dim, 10/18/2020 - 23:34
Permalien
Taper en bas de télécharger
Ly (non vérifié)
mar, 11/24/2020 - 00:16
Permalien
Comprendre
Ngom (non vérifié)
jeu, 11/26/2020 - 15:56
Permalien
Réussir
Barry (non vérifié)
ven, 11/27/2020 - 14:17
Permalien
apparandre
Thiobane (non vérifié)
mar, 10/26/2021 - 20:57
Permalien
Etudier
Soultana (non vérifié)
sam, 03/29/2025 - 15:52
Permalien
Pc
Barry (non vérifié)
mer, 11/25/2020 - 19:23
Permalien
apparandre
NDIAYE ML (non vérifié)
jeu, 10/13/2022 - 06:50
Permalien
PREPARATION DUN COURS
Alladoum (non vérifié)
dim, 10/18/2020 - 21:56
Permalien
Recherche d'un cours en pdf
Cherif (non vérifié)
dim, 10/18/2020 - 23:35
Permalien
Cliquez en bas de télécharger
Cheikh (non vérifié)
lun, 11/01/2021 - 12:38
Permalien
Pc
Modou (non vérifié)
sam, 11/21/2020 - 08:07
Permalien
Etudie
Ousmane Diémé (non vérifié)
sam, 01/06/2024 - 15:10
Permalien
Je veux que vous m'aider à m'améliorer en PC
Ismaël (non vérifié)
dim, 11/01/2020 - 23:28
Permalien
Remerciment
ahmet ndaw (non vérifié)
mer, 11/04/2020 - 09:19
Permalien
REMARQUE
Modou (non vérifié)
sam, 11/21/2020 - 08:11
Permalien
Reussit
Mourtalla (non vérifié)
jeu, 11/26/2020 - 16:08
Permalien
C'est excellent
Coumba (non vérifié)
ven, 12/04/2020 - 21:15
Permalien
Merci c'est intéressant
amina ndiaye (non vérifié)
ven, 12/11/2020 - 14:59
Permalien
comprendre .réussir. appliquer
Coumba (non vérifié)
mar, 03/02/2021 - 00:44
Permalien
Réussite
Wone zakaria (non vérifié)
mer, 10/27/2021 - 18:38
Permalien
Formidable
Anonyme (non vérifié)
ven, 10/29/2021 - 07:29
Permalien
Merci
Mame astou (non vérifié)
ven, 10/29/2021 - 07:31
Permalien
Remerciements
Degbeu Akaffou ... (non vérifié)
jeu, 11/11/2021 - 06:54
Permalien
Pour les recherches
Anonyme (non vérifié)
dim, 11/14/2021 - 01:58
Permalien
Nice
BA (non vérifié)
ven, 11/26/2021 - 11:20
Permalien
EXCELLENT
Anonyme (non vérifié)
ven, 11/26/2021 - 11:21
Permalien
EXCELLENT
Yamar dillo (non vérifié)
jeu, 12/02/2021 - 00:22
Permalien
Téléchargement
Yamar dillo (non vérifié)
jeu, 12/02/2021 - 00:22
Permalien
Téléchargement
Sogodogo (non vérifié)
sam, 12/11/2021 - 23:52
Permalien
Apprecia
Anonyme (non vérifié)
lun, 09/19/2022 - 12:13
Permalien
tres interressant
AMON KOULOU EUGENE (non vérifié)
mar, 10/11/2022 - 15:14
Permalien
JE SUIS A LA RECHERCHE D'UNE CORRECTION
Oumar Ndom (non vérifié)
lun, 07/24/2023 - 14:41
Permalien
Les cours en pdf
Yao Gaël (non vérifié)
lun, 09/25/2023 - 16:00
Permalien
Demande de devoirs et exercices
Gbaha siabi Fulgence (non vérifié)
dim, 10/01/2023 - 22:19
Permalien
Élève
Gbaha siabi Fulgence (non vérifié)
dim, 10/01/2023 - 22:19
Permalien
Élève
Nagalo Abdoul razak (non vérifié)
lun, 10/09/2023 - 22:18
Permalien
Demande de devoir et exercice
Kouakou Yao Jea... (non vérifié)
lun, 10/23/2023 - 22:57
Permalien
Demande d'exercice et de devoir
Thiam Babacar (non vérifié)
mer, 10/25/2023 - 01:32
Permalien
De l' os
Anonyme (non vérifié)
jeu, 12/07/2023 - 15:01
Permalien
Intéressant
Leile (non vérifié)
jeu, 10/16/2025 - 04:41
Permalien
Remercier
Ajouter un commentaire