Série d'exercices sur les acides carboxyliques et dérivés - Ts
Classe:
Terminale
Exercice 1
Partie A
1) Un acide carboxylique $(A)$ à chaine ouverte saturée est formé de $31.37\%$ d'oxugène.
calculer sa masse molaire et déterminer sa formule brute.
2) Écrire les formules semi-développées et les noms de tous mes isomères possibles.
3) On fait dissoudre $4\,g$ de l'isomère à chaine linéaire de $A$ dans $200\,mL$ d'eau.
a) Déterminer la concentration de la solution obtenue.
b) On prélève $25\,ml$ de cette solution à laquelle on ajoute $2.8\,g$ de fer.
$\ -$ Écrire l'équation de la réaction.
$\ -$ Quel est le réactif en excès ?
$\ -$ calculer le volume de gaz dégagé.
On donne $V_{m}=24\,L\cdot mol^{-1}.$
Partie B
Un ester $E$ de formule brute $C_{4}H_{8}O_{2}$ est préparé au cours d'une réaction d'un acide carboxylique $A$ et d'un alcool $B.$
1) a) Qu'appelle-t-on cette réaction ?
b) Donner ses caractéristiques.
2) Donner la formule semi développée, le nom de chaque isomère de l'ester $E.$
3) Déterminer la formule semi développée, et le nom de l'acide $A$ et ceux de l'alcool $B$ correspondant à chaque isomère de l'ester $E.$
Exercice 2
On réalise dans un excès de dioxygène, la combustion complète d'un composé organique oxygéné $A$ de formule brute $C_{n}H_{2n}O_{2}$ et de masse molaire $M$ ; les résultats de cette expérience ont permis de déterminer le pourcentage massique du carbone dans ce composé : $\%C\ :\ 54.54$
1) Comment peut-on montrer, à l'aide d'une combustion complète, que le composé $A$ renferme dans sa formule le carbone et l'hydrogène.
2) a) Vérifier que les pourcentage en carbone, en hydrogène et en oxygène peuvent s'écrire sous la forme :
$$\%C=\dfrac{12n\cdot 100\%}{M}\;;\ \%H=\dfrac{2n\cdot 100\%}{M}\text{ et }\%O=\dfrac{32\cdot 100\%}{M}.$$
On donne :
$M(H)=1\,g\cdot mol^{-1}\;,\ M(C)=12\,g\cdot mol^{-1}\text{ et }M(O)=16\,g\cdot mol^{-1}.$
b) Montrer que le rapport $\dfrac{\%C}{\%H}=6.$
Calculer les pourcentages d'hydrogène $\%H$ et d'oxygène $\%O.$
c) A partir de l'expression du pourcentage de l'oxygène, calculer la masse molaire $M$ du composé $(A).$
Déduire $n.$
Donner la formule brute du composé $A.$
3) Lors de la combustion complète on a utilisé un volume $V=240\,mL$ du composé $A.$
a) Écrire l'équation de la réaction.
b) Déterminer le volume de dioxygène de carbone dégagé.
On donne : volume molaire à la température de l'expérience : $V_{M}=24\,L\cdot mol^{-1}.$
Exercice 3
On considère la réaction chimique suivante
$$C_{n}H_{2n}\ +\ H_{2}O\quad\rightarrow\quad C_{n}H_{2n+2}O$$
1) Quelle est la nature de cette réaction chimique ?
2) Donner la fonction chimique du produit obtenu
L amasse moléculaire du produit obtenu est $M=88\,g\cdot mol^{-1}$
On le fait réagir avec de l'acide $2-$ Methylbutanoique.
3) Écrire la réaction qui se produit sachant que l'ester formé a pour formule :
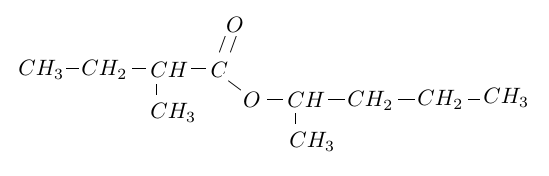
L'oxydation ménagée de l'alcool utilisée dans la question $2$ conduits à un composé $A.$
4) Donner la formule semi-développée de ce composé $A$ et son nom.
On donne :
$M(H)=1\,g\cdot mol^{-1}\ ;\ M(C)=12\,g\cdot mol^{-1}\text{ et }M(O)=16\,g\cdot mol^{-1}.$
Exercice 4
On considère les formules de cinq corps $A\;,\ B\;,\ C\;,\ D\text{ et }E$
$A\ :\ CH_{3}-CH_{2}-CH_{2}-OH$
$B\ :\ CH_{3}-CHOH-CH_{3}$
$C\ :\ CH_{3}-CH_{2}-COCl$
$D\ :\ CH_{3}-CH_{2}-COOCH_{2}-CH_{3}$
$E\ :\ CH_{3}-CO-NH_{2}$
1) Indiquer le groupe fonctionnel caractéristique de chacun de ces corps et les nommer.
2) a) On réagir une solution acidifiée de $K_{2}Cr_{2}O_{7}$ sur le corps $A.$
On obtient dans une première étape un composé $F$ ; puis dans une seconde étape un composé $G.$
Écrire l'équation - bilan correspondant à chacune de ces étapes.
b) La même solution agit sur $B$ pour donner un corps $H.$
Donner la formule semi-développée $H$ (l'équation - bilan n'est demandée).
c) Indiquer la nature de $F\;,\ G\text{ et }H.$
Donner leurs noms.
Citer un réactif permettant de distinguer $F\text{ et }H.$
3) Proposer un enchainement de réactions possibles permettant d'obtenir $C$ à partir de $A.$
4) a) La densité de vapeur d'un monoacide carboxylique à chaine saturée non cyclique $I$ est voisine de $3.$
Donner les formules semi-développées possibles pour $I$, ainsi que les noms.
b) L'isomère non ramifiée de $I$ réagit sur $B$ en présence d'un catalyseur pour donner un composé $J.$
Écrire l'équation - bilan de cette réaction.
Donner le nom de $J.$
Préciser les caractéristiques de cette réaction.
Donner la formule semi-développée et le nom d'un composé $K$ qui permet, par action sur $B$, d'obtenir $J$ à l'issue d'une réaction totale.
Exercice 5 Triglycéride
La palmitine est un triglycéride dérivant de l'acide gras nommé acide palmitique et du glycérol (aussi appelé propan$-1\;,\ 2\;,\ 3-\text{triol}$).
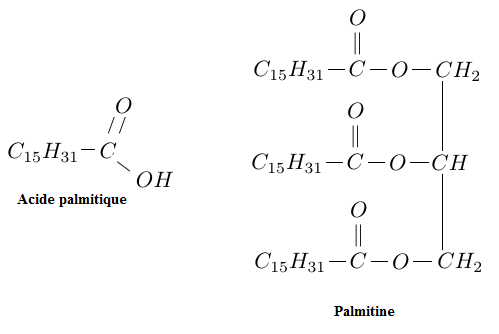
1) Définir un triglycéride.
2) Donner la formule semi-développée de la molécule de glycérol.
3) L'acide palmitique est-il un acide gras saturé ou insaturé ?
Justifier clairement.
4) Combien faut-il de molécules d'eau pour hydrolyser une molécule de palmitine ?
Justifier.
5) Écrire l'équation de l'hydrolyse de la palmitine.
6) lorsqu'on met en œuvre l'hydrolyse de la palmitine, on abouti à la fin à un mélange constitué d'une partie des réactifs qui n'ont pas réagi et des produits de la réaction.
Comment se nomme cet état final ?
Quelle est son origine ?
Exercice 6
On réalise l'oxydation ménagée d'une masse $m=2\,g$ d'un alcool $(A)$ aliphatique saturé et à chaine linéaire, par un excès de dioxygène de l'air, on obtient un seul produit $(B)$ qui rougit un papier $pH.$
1) a) Donner la formule générale d'un alcool.
b) Décrire la réaction.
c) Quelle est la nature de composé $B.$
Donner sa formule générale.
2) Le composé obtenu $(B)$ réagit avec une solution aqueuse d'hydrogène de sodium de concentration molaire $C_{b}=1\,mol\cdot L^{-1}.$
L'équivalence acido-basique a eu lieu lorsqu'on a versé un volume de $V_{b}=27\,mL$ de soude.
a) Calculer la quantité de matière du composé $(B).$
Déduire celle de $(A).$
b) calculer la masse molaire de $(A).$
Déduire son nom et sa formule semi-développée.
c) Donner la formule semi-développée du composé $(B)$ et son nom.
3) Si le dioxygène n'était pas en excès, un composé $(C)$ autre que $(B)$ peut être formé.
Donner sa formule semi-développée et son nom.
4) On chauffe l'alcool $(A)$ à la température $350^{\circ}C$ en présence de l'oxyde d'aluminium.
a) De quelle réaction s'agit-il ?
b) Écrire l'équation de cette réaction.
Donner le nom et la famille du produit formé.
Exercice 7
On réalise une réaction d'estérification en mélangeant à $t=0$ une masse $m_{ac}=12\,g$ d'acide éthanoique et une masse $m_{al}=12\,g$ de propane$-ol$ dans un Bécher auquel on ajoute quelques gouttes d'acide sulfurique.
Ce mélange est partagé d'une façon égale dans $10$ tubes à essai.
Les tubes sont placés dans un bain marie de $80^{\circ}C.$
1) Montrer que le mélange initial d'acide et d'alcool est équimolaire.
Calculer la composition initiale dans chaque tube.
On donne :
$M_{C}=12\,g\cdot mol^{-1}\ ;\ M_{O}=16\,g\cdot mol^{-1}\text{ et }M_{H}=1\,g\cdot mol^{-1}.$
2) Écrire l'équation de la réaction.
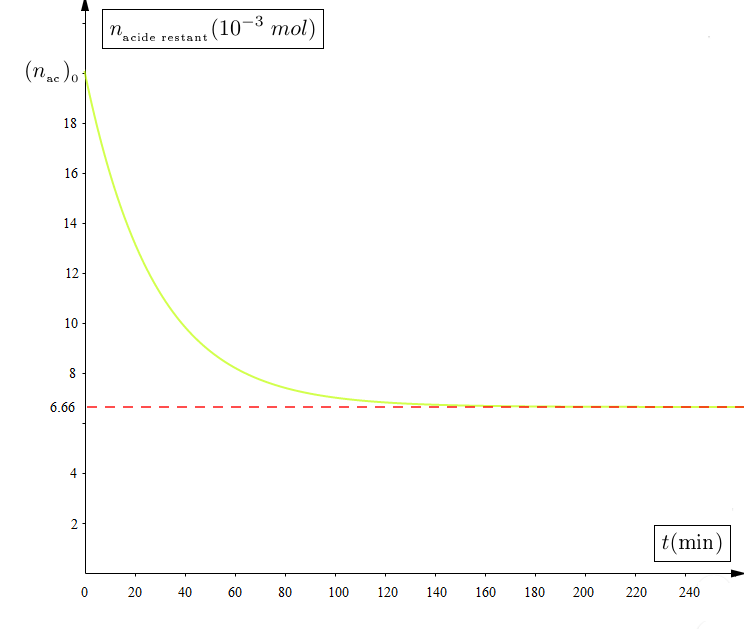
3) pour déterminer la composition du mélange à une date $t$,on dose l'acide restant par une solution d'hydroxyde de sodium $1\,M$, l'indication coloré utilisé est la phénolphtaléine.
Les résultats de mesure sont traduits par graphe suivant :
a) pourquoi a t-on chauffé le mélange et quel est le rôle de l'acide sulfurique ?
b) comment peut-on connaitre expérimentalement le point d'équivalence ?
c) Que représente la date $t=160\,min$ ?
Déterminer graphiquement la quantité de matière d'acide éthronoique restant à la fin de la réaction.
Déduire le nombre de môle d'ester formé.
d) calculer le volume de soude $V$ versé au cours du dosage à la date $t=160\,min$ comparer les volumes $V_{1}$ et $V_{2}$ de soude respectivement aux dates $t=100\,min$ et $t=200\,min$ au volume $v$
e) Représente sur le même graphe l'allure de la courbe représentant le nombre de môle d'ester formé en fonction du temps $n_{ester}=g(t).$

Commentaires
Khambon cissokho (non vérifié)
mar, 01/05/2021 - 19:55
Permalien
Demande d'exercices corrigés
Derek (non vérifié)
jeu, 01/28/2021 - 04:09
Permalien
Correction
za armel davy (non vérifié)
ven, 01/29/2021 - 15:48
Permalien
chimie
Bass Teuw (non vérifié)
mar, 02/23/2021 - 11:43
Permalien
Comprendre la chimie organique en terminal
Kouamé kouakou steve (non vérifié)
mar, 06/21/2022 - 18:52
Permalien
Connaître les acides carboxylique et leurs dérivés
Fofana amed (non vérifié)
ven, 01/21/2022 - 09:55
Permalien
Je veux être plus expérimenté en science
Fofana amed (non vérifié)
ven, 01/21/2022 - 10:35
Permalien
Je veux être plus expérimenté en science
Poudiougo (non vérifié)
jeu, 12/14/2023 - 13:34
Permalien
Correction
Djafarou (non vérifié)
lun, 07/29/2024 - 10:28
Permalien
Demande de corriger type
Dédé (non vérifié)
sam, 02/13/2021 - 22:50
Permalien
TP
IKA (non vérifié)
jeu, 05/06/2021 - 10:19
Permalien
Correction des exercices
yasmine (non vérifié)
jeu, 05/20/2021 - 11:18
Permalien
111
Fatou (non vérifié)
jeu, 01/05/2023 - 17:43
Permalien
Correction
kouka (non vérifié)
ven, 05/06/2022 - 23:35
Permalien
merci infiniment
Princesse Ericka (non vérifié)
jeu, 06/09/2022 - 01:11
Permalien
Demande des corrigés
Traoré lombeko (non vérifié)
mar, 11/28/2023 - 08:39
Permalien
Exercice et la correction
diakaridia Sogodogo (non vérifié)
jeu, 07/07/2022 - 02:17
Permalien
Pdf
Kamta tchani (non vérifié)
mer, 10/05/2022 - 09:07
Permalien
Réussir avec mention
GORÉE (non vérifié)
jeu, 01/05/2023 - 17:44
Permalien
Correction
Mouroukoro coulibaly (non vérifié)
mer, 02/01/2023 - 21:29
Permalien
correction sur les exercices
Riantsoa (non vérifié)
mer, 10/11/2023 - 16:59
Permalien
Demande de corrigé
Kone Demarie (non vérifié)
ven, 12/15/2023 - 17:26
Permalien
C'est vraiment magnifique .
Anonyme (non vérifié)
jeu, 01/23/2025 - 02:07
Permalien
<p> liste de course <p>
Ajouter un commentaire