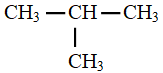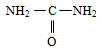5. Premier composé organique synthétisé
9. Elle s'oppose à la synthèse
10. Élément dont sa présence est prouvée, dans un composé organique, par la formation de l'ammoniac lors d'une réaction chimique
12. Son étude permet déterminer la nature des éléments présents dans un composé organique
13. Écriture simplifiée d'une formule développée
1. Élément qui définit la chimie organique (ou élément présent dans tous les composés organiques
2. Dans cette formule, les toutes liaisons sont représentées
3. Elle renseigne sur le nombre d'atomes présents dans une molécule
4. Ces isomères qui se distinguent par la position d'une liaison multiple
6. Étude qui donne le nombre d'atomes présents dans une molécule organique
7. Élément dont sa présence est prouvée dans un composé organique par formation de l'eau lors d'une combustion
8. Chimie de l'élément carbone
11. Isomères qui diffèrent l'enchaînement des atomes de carbone
1. La liaison covalente provient de :
a. la mise en commun de deux électrons célibataires par deux atomes ;
b. l'attraction électromagnétique des atomes
c. des effets électroniques dans les molécules
2. On définit les isomères chimiques comme :
a. des espèces chimiques de même formule brute mais qui diffèrent par leurs structures
b. des structures qui se ressemblent
c. des structures superposables avec leur image dans un miroir.
3. En chimie organique, les isomères, qui existent, sont :
a. deux types (isomère de constitution et stéréoisomère / spatiale)
b. trois types (squelette, position et fonction) ;
c. deux types (configuration et conformation)
4. L'analyse élémentaire quantitative d'une substance permet de déterminer :
a. a masse molaire de cette substance ;
b. la nature des éléments qui constituent cette substance ;
c. le nombre de mole d'atomes de chaque élément contenu dans cette substance.
5. La somme des masses des éléments constitutifs d'un échantillon d'une substance est:
a. supérieure à la masse de l'échantillon analysé
b. inférieure à la masse de l'échantillon analysé
c. égale à la masse de l'échantillon analysé aux erreurs d'expérience près.
6. Pour déterminer la formule brute d'une substance il suffit de connaître:
a. les résultats de l'analyse élémentaire qualitative de la substance
b. les résultats de l'analyse élémentaire quantitative de la substance
c. la masse molaire et les résultats de l'analyse élémentaires qualitative et quantitative de lasubstance
Exercice 3
Compléter ce texte avec les mots ou groupe de mots suivants : oxydes de carbone ; organique ; biologique ; chimie ; minérale ; carbone ;combustibles ; chimie organique ; caractère minéral ; végétale ; animal ; carbures.
A l'origine, la$\ldots\ldots\ldots$étudiait les substances des êtres vivants appartenant au monde$\ldots\ldots\ldots$ou végétal.
Elle s'opposait à la chimie$\ldots\ldots\ldots$(chimie inorganique) qui se consacrait aux substances extraites du monde minéral, c'est-à-dire provenant des roches, des eaux naturelles, de l'atmosphère.
Ce n'est qu'en $1828$ Wöhler (chimiste allemand) réussit à créer l'urée substance$\ldots\ldots\ldots$à partir d'un composé minéral$\ldots\ldots\ldots$
On comprit alors que la chimie organique obéissait aux mêmes règles que la$\ldots\ldots\ldots$minérale
Mais la distinction demeure en raison entre autres des propriétés particulières des composés organiques par rapport aux composés minéraux.
Ainsi les composés organiques (pétroles, gaz naturel, alcool...) sont presque$\ldots\ldots\ldots$, ce qui est rarement le cas des composés minéraux
La chimie organique est la chimie des composés du$\ldots\ldots\ldots$Certains sont d'origine naturelle, animale ou k$\ldots\ldots\ldots$d'où l'appellation "organique" (s'oppose à la chimie minérale).
Les médicaments, matières plastiques, fibres synthétiques, peintures, additifs alimentaires sont des produits de la$\ldots\ldots\ldots$obtenus par synthèse, c'est à dire par formation d'une molécule à partir de molécules plus simples.
En fait il faut en exclure le carbone, les$\ldots\ldots\ldots$les carbonates, les cyanures les$\ldots\ldots\ldots$qui ont tous un$\ldots\ldots\ldots$
Exercice 4
Lire attentivement ce texte avant de répondre aux questions :
En $1800$, la chimie s'était fermement établie parmi les sciences ; au cours de la décennie suivante, les scientifiques se sont vivement intéressés à l'étude de la composition des substances et à la manière dont elles pouvaient être modifiées.
Par suite de recherches, ils ont commencé à faire la distinction entre deux genres de composés : ceux qui étaient issus de sources végétales ou animales ont été appelés composés organiques, et ceux qui provenaient de constituants minéraux de la Terre ont été appelés « inorganiques ».
Les chimistes connaissaient l'existence de très nombreux composés organiques telles que les teintures, les savons, le vinaigre, le sucre, les parfums, les gommes et le caoutchouc, pour n' en mentionner que quelques-uns, mais ils n'arrivaient pas à expliquer comment tant décomposes pouvaient être faits à partir de quelques éléments seulement...()
Jusqu'alors, on n'avait jamais synthétisé un composé organique à partir de matières inorganiques ; par conséquent, de nombreux scientifiques croyaient que les composés organiques se formaient sous l'influence d'une « force vitale ».
En $1828$, Friedrich Wöhler a fait une découverte remarquable.
Il a essayé de fabriquer du cyanate d'ammonium au moyen d'une réaction de décomposition double, dans une solution de chlorure d'ammonium et de cyanate d'argent.
Or, ces deux composés étaient considérés comme étant « inorganiques ».
Cependant, au lieu d'obtenir du cyanate d'ammonium, il a produit des cristaux d'urée, un composé organique
Au cours des années qui ont suivi cette découverte et après que l'acide acétique et plusieurs autres composés organiques eurent été fabriqués à partir de matières inorganiques, la validité de la « force vitale » a été mise en doute.
Avec le temps, de plus en plus de composés organiques ont été synthétisés à partir de matières inorganiques.
Il est devenu évident qu'il n'était pas nécessaire que tous les composés organiques soient associés à des organismes vivants.
Au milieu des années $1850$, on a compris que le facteur commun à tous les composés organiques était le carbone.
Maintenant, les chimistes disent simplement que les composés organiques sont ceux qui contiennent du carbone, sauf les oxydes de carbone, les carbonates,les carbures et les cyanures.
Ces exceptions, en plus de toutes les autres substances connues,sont dites inorganiques.
Trois à quatre millions de composés organiques sont connus tan disque seulement cinquante mille composés inorganiques sont connus
1. Donner un titre à ce texte
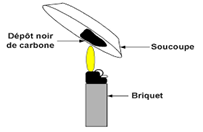
2. Le texte fait allusion au premier composé organique fabriqué.
Lequel ?
Et quels sont les composés minéraux utilisés pour cette synthèse
3. Citer les composés organiques et les composés minéraux
4. Quelle est la chimie qui s'opposait à la chimie organique ?
5. Définir la chimie organique
Exercice 5
Classer ces composés en composés minéraux ou organique
$CH_{4}$ ;
$CO_{2}$ ;
$C_{2}H_{6}$ ;
$CO$ ;
$CaCO_{3}$ ;
$C_{2}H_{4}$ ;
$C_{3}H_{6}$ ;
$C_{5}H_{12}$ ;
$HCN$ ;
$CaCO_{3}$ ;
$C_{55}H_{72}N_{4}O_{5}Mg$ ;
$CH_{4}ON_{2}$ ;
$CH_{3}C1$ ;
$HNO_{3}$
Exercice 6
Les composés $C_{2}H_{4}$, $C_{3}H_{6}$, $C_{4}H_{8}$, $C_{6}H_{12}$, contiennent tous une même proportion de môles d'atomes de carbone et de môles d'atomes d'hydrogène (une môle d'atomes de carbone pour deux môles d'atomes d'hydrogène).
Quelle est la donnée qui permet de distinguer ces quatre composés ?
1. La masse atomique relative des éléments
2. La masse moléculaire relative du composé
3. La constante d'Avogadro
4. La masse de l'échantillon considéré
Exercice 7
L'acide acétique (présent notamment dans le vinaigre) a pour formule brute : $C_{2}H_{4}O_{2}$
1. Quelle est la masse molaire moléculaire de l'acide acétique ?
2. Déterminer les pourcentages en masse de chaque élément présent dans ce composé.
On donne les masses molaires atomiques suivantes :
$M(C)=12.0\,g\cdot mol^{-1}$ ;
$M(H)=1.0\,g\cdot mol^{-1}$ ;
$M(O)=16.0\,g\cdot mol^{-1}$
Exercice 8
La formule de la chlorophylle est $C_{55}H_{72}N_{4}O_{5}Mg.$
1. Calculer le pourcentage massique de magnésium contenu dans la chlorophylle.
2. Sachant que $0.5\,kg$ de feuilles contient environ $1\,g$ de chlorophylle, calculer la masse de magnésium absorbée lorsqu'on mange $100\,g$ de feuilles, sous forme de salade par exemple.
3. Quel est le nombre correspondant d'atomes de magnésium ?
Exercice 9
Un composé organique $A$ est formé de carbone, d'hydrogène et d'oxygène.
La composition centésimale massique de ce composé est la suivante :
$C\ :\ 54.5\%$ ;
$H\ :\ 9.1\%$ ;
$O\ :\ 36.4\%.$
Sa densité de vapeur par rapport à l'air est $d=3.03.$
1. Calculer la masse molaire de ce composé
2. Déterminer sa formule brute
3. Le composé $A$ brûle dans le dioxygène.
Il se forme du dioxyde de carbone et de l'eau.
3.1. Écrire l'équation bilan de la réaction chimique
3.2. On fait brûler une masse $m=3.4\,g$ de $A.$
Calculer le volume de dioxygène nécessaire pour que la combustion soit complète.
Données :
$V_{m}=22.4L\cdot mol^{-1}$ ;
$M(H)=g\cdot mol^{-1}$ ;
$M(C)=12\,g\cdot mol^{-1}$ ;
$M(O)=16\,g\cdot mol^{-1}$ ;
$\rho_{\,\text{air}}=1.293\,g\cdot L^{-1}$
Exercice 10
L'analyse élémentaire d'un composé organique montre qu'il contient $84\%$ de carbone et $16\%$ d'hydrogène.
Choisir, parmi les formules moléculaires suivantes, celle en accord avec cette composition.
1. $C_{6}H_{14}O_{2}$
2. $C_{6}H_{10}$
3. $CH_{4}O$
4. $C_{14}H_{22}$
5. $C_{7}H_{16}$
Exercice 11
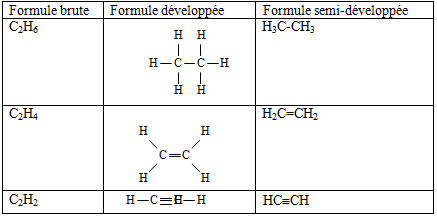
1. Écrire les formules semi-développées des composés moléculaires suivants : $C_{2}H_{6}$ ; $C_{2}H_{4}$ ; $CH_{4}O$ ; $C_{3}H_{9}N$ ; $C_{2}H_{4}O_{2}.$
2. L'analyse quantique d'un composé A indique qu'il est formé en masse de $40\%$ de carbone, de $6\%$ d'hydrogène et de $53\%$ d'oxygène.
Ces données suffisent-elle pour déterminer la formule $A$ ?
Quelle est la formule brute la plus simple ?
3. La composition centésimale est, en masse, la suivante pour la saccharine : $45\%$ de carbone ; $2.7\%$ d'hydrogène ; $26.2\%$ d'oxygène ; $7.7$ d'azote ; $17.5\%$ de soufre.
Sachant que la molécule comporte un seul atome de soufre, trouver la formule brute de la saccharine.
Exercice 12
Parmi les substances gazeuses dérivées du carbone, on en connait :
$-\ $une $X$, contenant $42.2\%$ en masse de carbone, ainsi que de l'oxygène.
La densité de ce composé $X$ par rapport à l'air vaut $0.967$ ;
$-\ $une $Y$, contenant $92.5\%$ en masse de carbone, ainsi que de l'hydrogène.
La densité de ce composé $Y$ par rapport à l'air vaut $0.898$ ;
$-\ $une $Z$, contenant $81.8\%$ 81, en masse de carbone, ainsi que de l'hydrogène.
La densité de ce composé $Z$ par rapport à l'air vaut $1.519.$
1. Quelles sont les masses moléculaires relatives des composés $X$, $Y$ et $Z$ ?
2. Quelles sont les masses d'un litre de chacun des composés gazeux $X$, $Y$ et $Z$ pris dans les conditions normales de température et de pression $\left(t=0 ^{\circ}C\;,p=1\text{atm ou }101325 P_{a}\right)$ ?
3. Déterminer les formules moléculaires des trois composés $X$, $Y$ et $Z.$
Masses atomiques : $M_{N}=14\;g\cdot mol^{-1}$ ; $M_{O}=16$ ; $g\;\cdot mol^{-1}$ ; $M_{At}=40\;g\cdot mol^{-1}$
Exercice 13
1. Établir la relation qui permet de calculer la masse molaire d'un composé gazeux à partir de sa densité.
On rappelle que la densité d d'un gaz par rapport à l'air est égale à :
$d=\dfrac{\text{masse d'un volume de ce gaz}}{\text{masse d'un même volume d'air}}$
Les masses sont déterminées dans les mêmes conditions de température et de pression.
2. Calculer la masse molaire d'un composé gazeux dont la densité est égale à $2.83.$
La masse volumique de l'air est égale à $1.29\;g\cdot L^{-1}$
Exercice 14
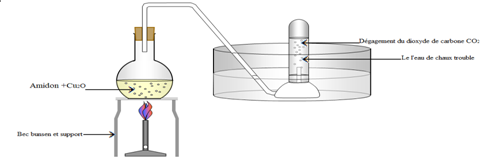
La combustion d'un échantillon de $0.084\;g$ d'un composé ne contenant que du carbone et de l'hydrogène a donné une augmentation de masse d'un flacon laveur à l'eau de chaux de $0.265\;g$ et du flacon laveur à l'acide sulfurique concentré de $0.106\;g.$
1. Calculer la masse de carbone et la masse d'hydrogène contenues dans l'échantillon.
2. Calculer le pourcentage massique de chaque élément.
Exercice 15
On considère un composé organique $(A)$ ne renfermant que du carbone, de l'hydrogène et de l'oxygène.
La combustion complète d'un échantillon de $(A)$ de masse $m$ égale à $0.373\;g$ a donné $0.886\;g$ d'un gaz qui trouble l'eau de chaux et $.453\;g$ d'eau.
1. Calculer les masses de carbone, d'hydrogène et d'oxygène contenues dans l'échantillon.
2. Déterminer la formule brute de (A) sachant que sa masse molaire est égale à $74\;g\cdot mol^{-1}$
Exercice 16
La composition en masse du camphre est :
$78.9\%$ de carbone, $10.5\%$ d'hydrogène et $10.5\%$ d'oxygène.
Déterminer sa formule brute sachant que sa masse molaire est égale à $152\\;g\cdot mol^{-1}$
Exercice 17
La composition en masse d'un composé organique ne contenant que du carbone, de l'hydrogène, de l'azote et de l'oxygène a donné les résultats suivants :
$40.6\%$ de carbone ;
$8.47\%$ d'hydrogène et $23.7\%$ d'azote
Déterminer sa formule brute sachant que sa masse molaire est égale à $59\;g\cdot mol^{-1}$
Exercice 18
Un composé organique contient du carbone, de l'hydrogène et, éventuellement, de l'oxygène.
Pour déterminer la formule moléculaire de ce composé, on a réalisé les deux expériences suivantes :
$-\ $la combustion complète de $0.74\;g$ du composé a fourni $1.76\;g$ de dioxyde de carbone et $0.9\;g$ d'eau ;
$-\ $ la vaporisation de $0.111\;g$ de ce composé a fourni, à $21^{\circ}C$ , un volume de $35.6\;ml$ sous une pression de $102791 Pa\left(\text{ou }1.014_{\text{atm}}\right).$
1. Déterminer la composition centésimale de ce composé
2. Calculer sa masse molaire
3. Déterminer sa formule moléculaire
4. Écrire les formules moléculaires semi-développées de $5$ isomères non cycliques
Exercice 19
Le glucose est un sucre contenant uniquement les éléments carbone, hydrogène et oxygène.
Une analyse centésimale a permis de déterminer les pourcentages en masse suivants : $\%c=40.0$ $\%H+6.7$ $\%O %C=40,0 %H=6,7 %O=53,3$
$(\%C représente le pourcentage en masse de l'élément carbone dans le glucose).$
Sachant que le glucose a une masse molaire moléculaire de $180.0\;g\cdot mol^{-1}$, quelle est sa formule brute ?
On donne les masses molaires atomiques suivantes :$M(C)=12.0\;g\cdot mol^{-1}$ ; $M(H)=1.0\;g\cdot mol^{-1}$ ; $M(O)=16.0\;g\cdot mol^{-1}$
Exercice 20
Pour effectuer l'analyse centésimale élémentaire d'un composé organique de formule brute $C_{x}H_{y}O_{z}$ de masse molaire moléculaire $M=46\;g\cdot mol^{-1}$, on prélève un échantillon de $230\;mg.$
On le chauffe en présence d'un excès d'oxyde de cuivre de formule $C_{u}O.$
Dans ces conditions, on obtient du dioxyde de carbone, de l'eau et du cuivre métallique.
Une fois la transformation chimique terminée, on a obtenu $44\;mg$ de dioxyde de carbone et $270\;mg$d'eau.
1. Écrire l'équation de la réaction modélisant cette transformation chimique.
2. Quelle quantité de matière du composé organique contenait l'échantillon utilisé ?
3. Exprimer en fonction de $x$ la quantité de matière de dioxyde de carbone et en fonction de $y$ la quantité de matière d'eau produite au cours de la transformation chimique.
4. En déduire les valeurs de $x$, $y$ et z ainsi que la formule brute du composé organique étudié.
5. Déterminer les pourcentages en masse de chaque élément présent dans ce composé.
On donne les masses molaires atomiques suivantes :
$M(C)=12.0\;g\cdot mol^{-1}$ ; $M(H)=1.0\,g\cdot mol^{-1}$ ; $M(O)=16.0\cdot mol^{-1}$
Exercice 21
Le chlorhydrate de kétamine est une molécule utilisée comme anesthésique général en médecine humaine et en médecine vétérinaire.
Sa formule brute peut s'écrire sous la forme $C_{x}H_{y}C1_{z}N_{t}O_{e}$
L'analyse quantitative du composé donne les pourcentages massiques suivants : $\%c=65.68$ ; $\%H=6.78$ ; $\%N=5.89$ ; $\%C1=14.91$ ;
1. En déduire la composition centésimale molaire de l'élément oxygène
2. Déterminer la formule brute du chlorhydrate de kétamine
On donne :
Masse molaire du chlorhydrate de kétamine : $M=237.725\;g\cdot mol$
Exercice 22
La composition en masse d'un composé organique ne contenant que du carbone, de l'hydrogène et de l'oxygène a donné les résultats suivants :
$52.17\%$ de carbone ; $13.04\%$ d'hydrogène et $34.79\%$ d'oxygène.
La densité de la vapeur de ce composé par rapport à l'air est égale à $1.58.$
1. Déterminer la masse molaire de ce composé.
2. En déduire sa formule brute
Exercice 23
L'analyse quantitative d'un hydrocarbure $C_{x}H_{y}$ montre qu'il contient
$85.7\%$ de carbone.
1. Calculer le rapport $\dfrac{x}{y}$
2. En déduire la formule brute de cet hydrocarbure sachant que sa densité de vapeur par rapport à l'air est $d=1.93.$
3. Écrire toutes les formules semi-développées possibles de cet hydrocarbure.
Exercice 24
La combustion complète de $10\;mL$ d'un hydrocarbure gazeux nécessite $50\;mL$ d'oxygène et fournit de l'eau et $3\;mL$ de dioxyde de carbone. Les volumes sont mesurés dans les mêmes conditions de température et de pression.
1. Déterminer la formule brute de cet hydrocarbure.
2. Écrire sa formule semi-développée.
Exercice 25
La combustion complète de $0.01\;mole$ d'un composé organique constitué de carbone, d'hydrogène et d'oxygène nécessite $1.08\;L$ de dioxygène et donne $1.32\;g$ de dioxyde de carbone et $0.72\;g$ d'eau.
Le volume molaire des gaz dans les conditions de l'expérience est égal à $24\;L\cdot mol^{-1}.$
1. Écrire l'équation chimique de la réaction de combustion.
2. Déterminer la formule brute de ce composé.
3. Écrire les formules semi-développées des isomères correspondant à cette formule brut.
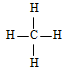
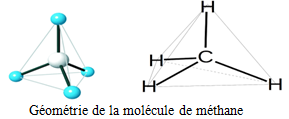

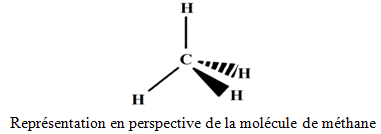
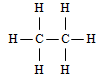
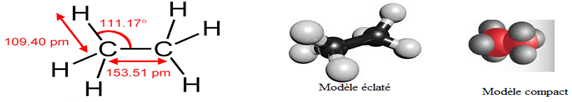


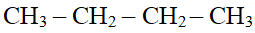 et
et