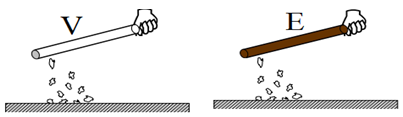
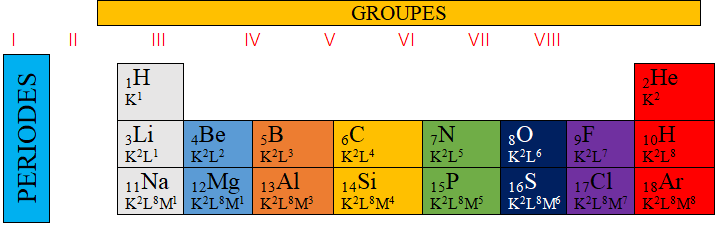
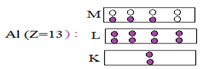
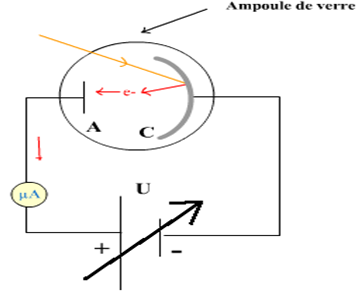
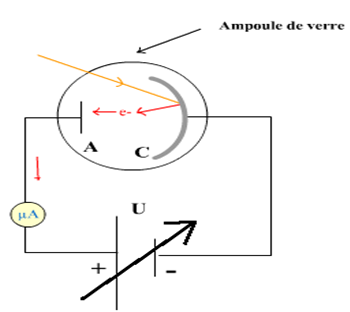
$-\ $de deux récepteurs : l'ampoule $(L)$, la cuve à l'électrolyse $(C)$, contenant de l'eau distillée
Ces effets du courant deviennent plus importants que le courant est intense ou son intensité a augmenté
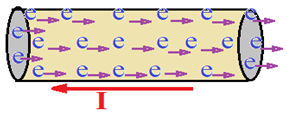
Si en une durée t exprimée en seconde(s). $N$ nombre de charges qui traverse une section de conducteur métallique
Si ce débit est constant, l'intensité $I$ d'un courant continu est le rapport de la valeur absolue de la quantité d'électricité $Q$ sur la durée de passage $t$
$$\begin{array}{lcl} D&=&\dfrac{Q}{t}\\\\\text{or }Q&=&N_{e}\\\\\Rightarrow\,I&=&\dfrac{N_{e}}{t}\\\\\Rightarrow\,I&=&D_{e} \end{array}$$
1.3 Ordre grandeur de quelques intensités
$$\begin{array}{|l|l|l|l|l|l|} \hline \text{Foudre}&\text{Génératrice de}&\text{Démarreur}&\text{Plaque}&\text{Lampe}&\text{Montre}\\ &\text{centrale électrique}&\text{de voiture}&\text{ de cuisson}&\text{halogène}&\text{à quartz}\\ \hline \text{Jusqu'à }200KA&5KA&50A&2\text{ à }20A&1\text{ à }2A&\text{Quelques }nA\\ \hline \end{array}$$
2. Mesure de l'intensité du courant électrique
2.1 Représentation des ampèremètres
L'ampèremètre est un appareil qui permet de mesurer l'intensité du courant électrique
On distingue deux types d'ampèremètres :
$-\ $les ampèremètres à aiguilles
$-\ $les ampèremètres numériques (ou digitaux)
Pour mesurer des courants d'intensité très faible ou déceler simplement le passage du courant électrique on utilise le galvanomètre
L'ampèremètre est schématisé par le symbole :
L'ampèremètre comporte deux parties essentielles :
$-\ $un cadran
$-\ $des calibres $(3A.$ $1A...$etc$)$
Le calibre d'un ampèremètre indique l'intensité maximale pour laquelle l'aiguille est en fin de course
$-\ $des divisions
2.2 Branchement et précautions
2.2.1 Branchement
Pour mesurer l'intensité du courant électrique qui traverse un dipôle $D$ placé dans un circuit
On ouvre :
$-\ $le circuit immédiatement avant (ou après) $D$ et on intercale l'ampèremètre
$-\ $l'ampèremètre et le dipôle $D$ sont en série.
De nombreux appareils ampèremètres sont polarisés. Le courant électrique doit entrer dans l'ampèremètre par la borne positive et sortir par la borne négative
2.2.2 Précaution
Lors d'une mesure il est important pour ne pas détériorer l'ampèremètre d'essayer d'abord les calibres les plus élevés, on effectuera ensuite la mesure avec le calibre qui donne la déviation la plus nette.
2.3 Lecture et intensité de mesure
2.3.1 Lecture
Les grandeurs déviation $n$ et l'intensité I sont proportionnelles et on associe
$\text{Calibre}\ \longrightarrow\ N\text{ avec }N\ :\ \text{nombre total de division}$
$I\ \longrightarrow\ n\text{ avec }n\ :\ \text{nombre de divisions lues}$
$$I=\text{Calibre}\times\dfrac{n}{N}$$
Exemple
Le cadran d'ampèremètre comporte $100$ décisions équidistantes on l'utilise sur le calibre $300\,mA.$
Quelle est la valeur de l'intensité du courant quand l'aiguille s'arrête sur la division $80.$
Solution
La valeur de l'intensité du courant
\begin{eqnarray} I&=&\text{Calibre}\times\dfrac{n}{N}\nonumber\\\\ &=&300\times\dfrac{80}{100}\nonumber\\\\\Rightarrow\,I&=&240mA \end{eqnarray}
Remarque
Dans le cas des ampèremètres digitaux la valeur de l'intensité du courant est affichée directement Incertitude de mesure
2.3.2 Classe
La classe de l'ampèremètre est une donnée technique du constructeur permettant d'évaluer l'incertitude absolue sur la mesure de l'intensité
$$\Delta I=\text{Classe}\times\dfrac{\text{Calibre}}{100}$$
2.4 Présentation du résultat de la mesure de l'intensité
Par définition :
$I=I_{0}\pm\Delta I$ ou
$I=I_{0}-\Delta I\leq\,I\leq\,I_{0}+\Delta I$
3. Propriétés de l'intensité du courant électrique
3.1 Unicité de l'intensité du courant électrique dans un circuit en série
3.1.1 Observation
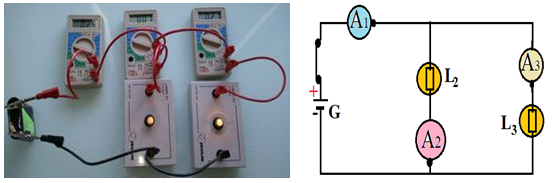
Les ampèremètres $A_{1}$, $A_{2}$ et $A_{3}$ montrent les intensités $I_{1}$, $I_{2}$ et $I_{3}$ on constate que les ampèremètres indiquent la même valeur $I_{1}=I_{2}=I_{3}=I$
Mettre un dipôle supplémentaire en série dans le circuit produit une diminution de l'intensité
3.1.2 Conclusion
$-\ $Dans un circuit en série l'intensité du courant électrique est la même en tout point du circuit : c'est la loi de l'unicité de l'intensité du courant électrique.
$-\ $Quand on ajoute un récepteur en série dans le circuit l'intensité du courant électrique diminue
3.2 Loi des nœuds dans un circuit en dérivation
3.2.1 Observation
L'ampèremètre $A_{1}$ mesure l'intensité du courant dans la branche principale $A_{2}$ mesure l'intensité $I_{2}$ du courant dans une branche en dérivation et $A_{3}$ L'intensité $I_{3}$ du courant dans une autre branche en dérivation
Nous constatons que $I_{2}+I_{3}=I_{1}$
Si l'on devise un dipôle il ne fonctionne pas et l'autre continue à fonctionner
3.2.2 Conclusion
Dans un circuit en dérivation l'intensité du courant de la branche principale est égale à la somme des intensités des courants dans les branches en dérivation
Ce résultat ne généralise également au cas où plusieurs courant arrivent au nœud et ou plusieurs courants partent.
La somme des intensités des courants qui arrivent à un nœud est égale à la somme des intensités des courants qui partent c'est la loi des nœuds
II. Tension électrique
1. Notion de tension électrique
1.1 Observations
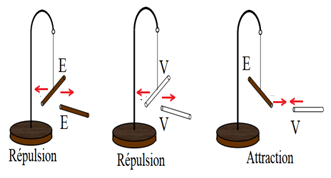
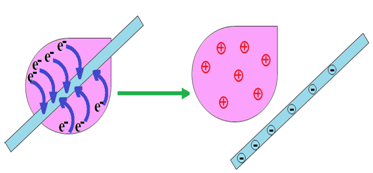
Dans une pile neuve il existe une importante dissymétrie entre les bornes plus et moins.
Sur la borne $-$ se trouve un excès d'électrons et la borne $+$ un déficit d'électrons
En revanche dans une pile usagée (utilisée) cette dissymétrie est très faible.
On dit que la tension entre les bornes de la pile neuve est supérieure à celle qui existe entre les bornes de la pile usagée
1.2 Définition
La tension électrique caractérise la dissymétrie électrique de deux points d'un circuit :
Elle est nécessaire pour qu'un courant circule enterre ces deux points
1.3 Tension électrique grandeur algébrique
Relions deux points $A$ et $B$ par un fil conducteur.
Si le courant circule de $A$ vers $B$ à travers ce conducteur nous dirons la tension $U_{AB}$ entre $A$ et $B$ à travers ce conducteur est positive $\left(U_{AB}>0\right)$
Si au contraire le courant circule de $B$ vers $A$ nous dirons que la tension $U_{BA}$ entre $A$ et $B$ est négative $\left(U_{AB}<0\right)$
S'il ne circule aucun courant, la tension est nulle $(UAB=0)$
Conclusion :
La tension électrique entre deux points $A$ et $B$ d'un circuit est une grandeur algébrique
1.4 Tension représentée par une fléchée
Par convention on note $U_{AB}$ la tension entre les points $A$ et $B$ et on le représente par un segment fléché vers $A$
Cette flèche est dessinée à côté du symbole
Remarque :
Cette flèche n'est pas vecteur mais seulement une représentation conventionnelle
1.5 Unités
Dans le Système International la tension s'exprime en volt $(V)$
On utilise également les multiples et les sous-multiples du volt
Quelques multiples et sous-multiples du volt
$$\begin{array}{|l|l|} \hline \text{Multiples}&\text{Sous-multiples}\\ \hline \text{Mégavolt : }1MV=10^{6}V&\text{Déci volt : }1dV=10^{-1}V\\ \text{Kilovolt : }1kV=10^{3}V&\text{Centi volt : }1cV=10^{-2}V\\ \text{Hecto volt : }1hV=10^{2}V&\text{Millivolt : }1mV=10^{-3}V\\ \text{décavolt : }1daV=10^{1}V&\text{Microvolt : }1\mu V=10^{-6}V\\ \hline \end{array}$$
1.6 Ordre de Grandeurs de quelques tensions
$$\begin{array}{|l|l|l|l|} \hline \text{Tensions aux bornes}&\text{Réseau d'éclairage}&\text{Ligne de transmission}&\text{Tension entre les nuages}\\ \text{d'une pile}&\text{urbain}&\text{électrique}&\text{pendant l'orage}\\ \hline 4.5V&110V\text{ à }220V&500000V&100.000.000V\\ \hline \end{array}$$
2. Mesure de tension électrique
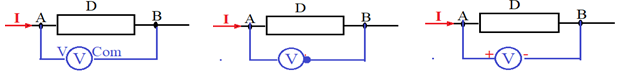
2.1 Utilisation du voltmètre
On distingue deux types de voltmètres pour la mesure des tensions électriques
$-\ $les voltmètres à aiguille
$-\ $les voltmètres numériques (digitaux)
Le voltmètre est schématisé par le symbole :
2.1.1 Le branchement du voltmètre
Le principe d'utilisation du voltmètre est la même que celui de l'ampèremètre a la différence que le voltmètre est branché en dérivation ou en parallèle
2.1.2 Lecture de la tension électrique
La tension mesurée aux bornes d'un dipôle à l'aide d'un voltmètre à aiguille a pour expression
$$I=\text{Calibre}\times\dfrac{n}{N}$$
$n$ : nombre de divisions devant lesquels s'immobilise l'aiguille
$N$ : nombre total de divisions sur le cadran
2.1.3 Incertitude de mesure
Tout comme l'intensité du courant électrique l'incertitude des classes que l'on commet en mesurant une tension électrique est définie par la relation suivante
$$\boxed{\Delta U=\dfrac{\text{Calibre}\times\text{Clase}}{100}}$$
La précision de la mesure est donnée par $\dfrac{\Delta U}{U}$
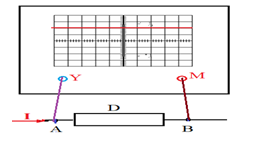
2.2 Utilisation l'oscilloscope
On peut mesurer la tension entre deux points $A$ et $B$ a l'aide de l'oscilloscope
Mesure
Soit un dipôle de borne $A$ et $B$ relions $A$ à une borne $Y$ et $B$ a la masse $M$ : Le spot initialement en $0$ subit une déviation $Y$
Nous poserons : $U_{AB}=Ky$
$K$ est la sensibilité verticale en $V/div$
Si $U_{AB}$ supérieur à $0$, $y$ supérieur a aussi à $0$
La lecture de la déviation $y$ permet de calculer $U_{AB}$ la valeur de $k$ lue directement
Remarque
On peut vérifier facilement la tension entre deux points d'un même fil de connexion est nul
3. Propriétés des tensions
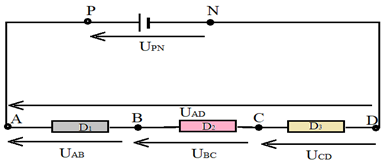
3.1 Loi d'additivité des tensions
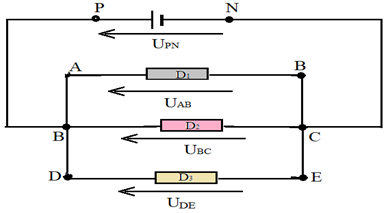
Mesurons les tensions $U_{PN}$, $U_{AD}$, $U_{AB}$, $U_{BC}$ et $U_{CD}$
On constate :
$$U_{PN}=U_{AD}=U_{AB}+U_{BC}+U_{CD}$$
La tension aux bornes d'une association de dipôles montés en série est égale à la somme des tensions aux bornes de chacun des dipôles
3.2 Unicité de la tension entre deux points
Mesurons les tensions $U_{PN}$, $U_{AB}$, $U_{BC}$ et $U_{DE}$
On constate :
$$U_{PN}=U_{AB}=U_{BC}=U_{DE}$$
La tension est la même aux bornes de plusieurs dipôles montés en dérivation ou parallèle
4. Tensions variables
4.1 Tension continue et tension variable
Une tension qui ne varie pas au cours du temps ni en grandeur ni en signe est dite continue
En revanche quand le signe ou la valeur de la tension change elle est variable
Exemples de tensions variables
Certains générateurs sont conçus pour fournir des tensions variables particulaires dont la trace sur l'eau a la forme
Remarque
Certaines Tensions variables reprennent la même valeur a un intervalle de temps régulier elles sont dites périodiques
4.2 Tension alternative
Une Tension alternative est une tension qui prend alternativement des valeurs positives et négatives
Exemples :
tension créneau, tension triangulaire et tension sinusoïdale
4.3 Tension sinusoïdale
4.3.1 Définition
Une tension est dite sinusoïdale si la courbe représentant la tension $U$ en fonction du temps est une courbe régulière appelé sinusoïde
4.3.2 Caractéristiques d une tension sinusoïdale
La tension sinusoïdale est caractérisée par :
La période $T$ ou la fréquence $N$
La période $T$ est plus petit intervalle de temps au bout duquel la tension se reproduit identique à elle-même
La fréquence $N$ est le nombre de périodes par unité de temps
$$N=\dfrac{1}{T}$$
Elle s'exprime en Hertz $(Hz)$
La tension maximale ou la tension efficace
La tension maximale se déduit de la déviation maximale
$$M_{\text{MAX}}=Ky_{\text{MAX}}$$
La tension maximale est liée à la tension efficace par la relation :
$$U_{\text{MAX}}=U\sqrt{2}$$
$U_{\text{MAX}}$ et $U$ étant respectivement la tension maximale et la tension efficace
5. Convention récepteur et mesure de sécurité
5.1 Convention Récepteur
Considérons un dipôle $D$ parcouru par un courant
Soient $A$ et $B$ les deux bornes du dipôle
Orientons arbitrairement le dipôle de $A$ vers $B$ pour algébriser l'intensité du courant traversant le dipôle que nous noterons alors $U_{AB}$
Dans la convention récepteur la flèche qui symbolise l'orientation du dipôle pour l'intensité et celle qui représente la tension à considérer sont de sens contraire
5.2 Mesure de Sécurité
5.2.1 Le danger du courant électrique de la tension électrique
Dans une installation domestique la tension aux bornes de la prise est de $220V$ à $380V$
Le seuil de tension dangereuse (mortelle) est de $50V$ et de $24V$ dans un local humide.
La tension dans les branchements domestiques étant de $220V$ à $380V$, il y'a un danger réel à toucher un fil de phase
L'électrocution se produit lorsqu'on touche un fil de phase.
N'étant pas soi-même isolé du sol. Les risques d'électrocution sont plus grands lorsque l'on est mouillé ou quand le sol est mouillé
5.2.2 Les règles de sécurité
$-\ $L'isolation des conducteurs doit être rigoureuse
$-\ $S'abstenir de manipuler des appareils électriques quand on est mouillé.
Pour changer une ampoule de salle de bain prendre soin de très isoles du sol de manière qu'entre les pieds et le sol aucun corps ne puisse conduire des charges électriques.
$-\ $Débrancher tout appareil électrique avant démontage
$-\ $vérifier que la fiche de terre des appareils qui en comportent est bien mise à la terre
III. Loi d'ohm
1. Caractéristique d'un résistor ou d'un conducteur ohmique
1.1 Définition
On appelle caractéristique d'un dipôle la représentation (très souvent expérimentale) d'une relation fonctionnelle entre deux grandeurs physiques
En électricité quand les grandeurs sont la tension $U$ et l'intensité $I$
$-\ $La caractéristique tension-intensité d'un dipôle est la courbe représentant les variations de l'intensité $I$ dans le dipôle en fonction de la tension $U$ à ses bornes $I=f(u)$
$-\ $La caractéristique intensité-tension d'un dipôle est la courbe représentant les variations de la tension $U$ à ses bornes en fonction de l'intensité $I$ du courant qui le traverse
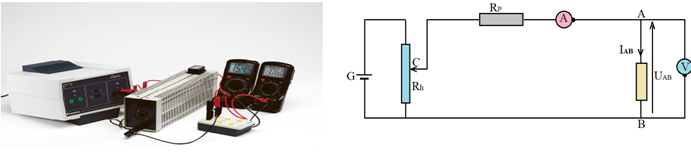
1.2 Expérience
Montage
Considérons le montage suivant
le rhéostat $R_{h}$ on fait varier $I_{AB}$ lue sur l'ampèremètre pour chaque valeur de $I_{AB}$ on lit $U_{AB}$ sur le voltmètre Tracé de la caractéristique
En agissant sur
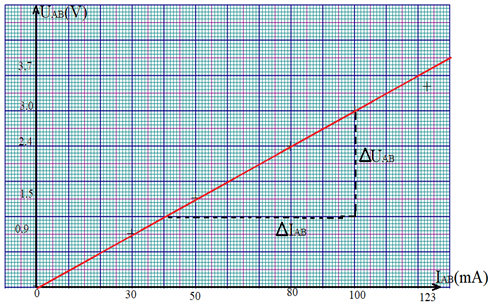
Une expérience permet d'obtenir le tableau de valeurs suivantes
$$\begin{array}{|l|c|c|c|c|c|c|} \hline U_{AB}(V)&0&0.9&1.5&2.4&3.0&3.7\\ \hline I_{AB}(mA)&0&30&50&80&100&123\\ \hline \end{array}$$
Ce tableau nous permet de tracer la caractéristique intensité-tension
La caractéristique intensité-tension d'un résistor ou conducteur ohmique est une droite passant par l'origine limitée à la valeur maximale de $I_{AB}$ supportable par le résistor le résistor est un dipôle passif linéaire
On obtiendrait la même courbe en intervertissant les bornes du résistor $U_{AB}=f\left(I_{AB}\right)$ le résistor est un dipôle symétrique
Le coefficient directeur de la droite représente une caractéristique du conducteur ohmique : la résistance notée $R$
La résistance électrique traduit la propriété des matériaux à s'opposer au déplacement des électrons
Dans l'expérience décrite :
\begin{eqnarray} R&=&\dfrac{\Delta U_{AB}}{\Delta I_{AB}}\nonumber\\\\ &=&\dfrac{3-1.2}{(100-40)\cdot 10^{-3}}\nonumber\\\\\Rightarrow\,R&=&30\Omega \end{eqnarray}
2. Loi d'ohm
Énoncé :
La tension appliquée aux bornes d'un conducteur ohmique est une fonction linéaire de l'intensité qui le traverse
$$\boxed{U=RI}$$