I. Quelques modes d'électrisation :
1. Électrisation par frottement
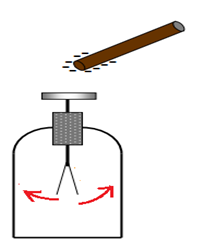
1.1. Expérience
$-\ $ Un bâton en verre bien sèche, frotté à l'aide d'un morceau de drap en soie ou en laine, tenue à la main, attire de petits morceaux de papier.
$-\ $ On obtient le même résultat si on remplace le bâton en verre par un bâton d'ébonite 3 et si on répète la même opération.
Les corps frottés sont également capables d'attirer des cheveux ou un mince filet d'eau qui coule d'un robinet.
Les corps frottés sont également capables d'attirer des cheveux ou un mince filet d'eau qui coule d'un robinet.
1.2. Conclusion
Il est possible d'électriser ou de charger d'électricité la matière en la frottant.
Ce phénomène s'appelle l'électrisation par frottement.
Des corps électrisés peuvent attirer d'autres corps plus légers.
2. Électrisation par contact
2.1. Expérience
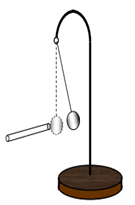
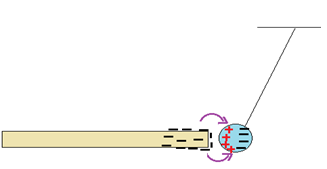
On constitue, à présent, un pendule électrostatique en suspendant au fil de soie une boule de polystyrène recouverte d'une matière conductrice.
Celle-ci est initialement neutre.
Approchons un bâton en verre, électrisée par frottement, de la boule jusqu'au contact.
On constate que la boule est repoussée sous l'effet de son interaction avec la partie électrisée de la tige
2.2. Conclusion
Un corps qui, après contact avec un autre corps électrique, acquiert la propriété d'attirer des corps légers a été électrisé par contact.
3. Électrisation par influence
3.1. Expérience
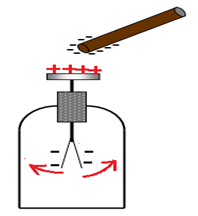
L'électroscope est constitué d'une tige métallique qui comporte à son extrémité inférieure deux feuilles d'or très minces qui tombent librement.
Un plateau ou une boule métallique sont fixés à l'extrémité supérieure et
l'ensemble est enfermé dans une cage métallique vitrée.
Le bâton d'ébonite, chargé négativement, est approché du plateau.
On constate les feuilles d'or du pendule se repoussent.
Si on éloigne l'ébonite, l'ensemble (plateau, tige, feuilles) retrouve sa neutralité ; les feuilles de l'électroscope reprennent leur position verticale initiale.
3.2. Conclusion
Les deux feuilles se repoussent parce qu'elles sont électrisées sous l'influence du bâton.
Un corps peut être électrisé par influence en rapprochant un autre corps électrique.
II. Charges électriques :
1. Les deux espèces d'électricité
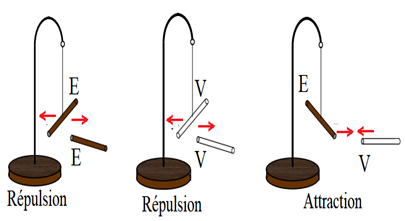
1.1. Expérience
Les pendules sont constitués d'une potence, fixée sur un socle en bois, à laquelle est relié un fil de soie sans torsion.
Suspendons, en son milieu, un bâton d'ébonite dont une extrémité a été électrisée par frottement.
Approchons de cette extrémité la partie électrisée, par la même méthode, d'un second bâton d'ébonite.
L'interaction de ces parties électrisées se traduit par une répulsion.
Répétons la même expérience, en remplaçant les bâtons d'ébonite par des tiges de verre électrisées comme précédemment.
Là encore l'interaction se traduit par une répulsion.
Dans une troisième expérience, on met en présence l'extrémité électrisée du bâton d'ébonite et celle de la tige de verre électrisée.
Il en résulte, à présent, une attraction
1.2. Interprétation
Ces expériences mettent en évidence deux types d'électricité :
La première apparait dans le verre : c'est l'électricité vitreuse à laquelle on a attribué arbitrairement un signe positif.
La seconde se manifeste dans l'ébonite et d'autres résines : c'est l'électricité résineuse ; on lui a attribué un signe négatif.
En outre, ces expériences montrent que :
$-\; $ deux corps chargés d'une électricité de même signe, positive ou négative, se repoussent ;
$-\ $ deux corps chargés de signes contraires s'attirent
Un corps qui n'est pas chargé est neutre.
2. La quantité de charge électrique
La quantité de charge électrique est mesurée en coulomb $(C).$
Comme un atome est électriquement neutre, la valeur absolue de la charge d'un électron est égale à celle d'un proton.
Cette charge élémentaire, notée $e$, $$\text{vaut }e=1.602\cdot10^{-19}C.$$
Toute autre charge électrique $Q$ est un multiple entier de la charge élémentaire :
$$Q=ne\;,\ n\in\mathbb{Z}$$
III. Interprétation électronique de l'électrisation
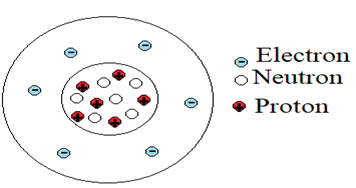
1. Structure de la matière
La matière est constituée d'atomes
Un atome peut être considéré comme se composant de deux parties :
$-\ $ un noyau, constitué de protons chargés positivement et de neutrons électriquement neutres ;
$-\ $ une enveloppe, appelée nuage électronique, constituée d'électrons chargés négativement
Remarque :
Un atome électriquement neutre contient autant d'électrons que de protons, la charge des protons et des électrons étant la même en valeur absolue.
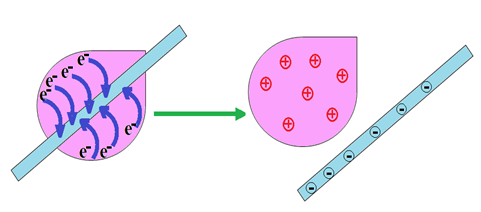
2. Électrisation par frottement
Avant le frottement les corps sont électriquement neutres.
En les frottant on agit sur les atomes situés à la surface des corps.
Les électrons les moins liés sont arrachés d'un des corps et sont transférés sur l'autre.
L'un des corps a un défaut d'électrons : il est chargé positivement.
L'autre présente un excès d'électrons et est chargé négativement.
Un bâton d'ébonite par exemple arrache des électrons au chiffon de laine et se charge négativement.
Il est important de remarquer que la charge électrique ne peut être ni créée, ni détruite.
Les corps s'électrisent uniquement par transfert d'électrons.
Lorsqu'on corps est électrisé par frottement, il y a lieu un transfert de charges : les électrons les plus faiblement liés sont transférés d'un corps à l'autre.
Ainsi :
$-\ $ un corps chargé positivement présente un défaut d'électrons ;
$-\ $ un corps chargé négativement présente un excès d'électrons.
3. Électrisation par contact
Lors d'une électrisation par contact, il y a aussi un transfert de charges :
$-\ $ un corps chargé négativement transmet des électrons au corps initialement neutre ;
$-\ $ un corps chargé positivement arrache des électrons au corps initialement neutre
4. Électrisation par influence
Lorsqu'on approche un corps chargé du corps neutre, les électrons libres sont attirés.
Il s'établit un déséquilibre des charges dans le corps neutre : les électrons sont en excès du côté du corps positif, ils sont en défaut du côté opposé.
Il y a donc séparation des charges à l'intérieur du corps neutre.
La région plus près du corps chargé sera chargée négativement, le côté opposé sera chargé positivement.
Dès qu'on éloigne le corps chargé, les électrons se répartissent de nouveau de façon uniforme dans le corps neutre.
L'électroscope est électrisé par influence, les électrons sont repoussés vers la partie inférieure de l'électroscope.
L'électroscope reste neutre et les électrons retrouvent leur disposition initiale si on éloigne la baguette.
Remarque :
Cette observation permet d'expliquer pourquoi des petits bouts de papier sont attirés par un corps chargé.
VI. Conducteurs et isolants électriques
1. Conducteurs
1.1. Expérience
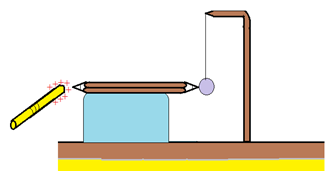
Électrisons par frottement (ou par contact) une règle en plexiglas.
Intercalons entre la règle et la boule une tige en carbone (crayon taillé des deux bouts), posée sur un support isolant.
Remplaçons la tige en carbone par une tige en cuivre puis, par une tige en aluminium
1.1.1. Observation
La boule est repoussée dans le cas du cuivre, de l'aluminium et du carbone.
La boule s'électrise positivement par contact avec les tiges en cuivre, en aluminium et en carbone.
1.1.2. Interprétation
Par contact avec la règle en plexiglas, la tige en cuivre (ou en aluminium ou en carbone) s'électrise positivement en cédant des électrons à la règle.
Ces électrons ayant quitté la tige font apparaitre une charge positive sur toute la tige.
La charge positive qui apparaît sur le cuivre (ou l'aluminium ou le carbone) n'est pas localisée à la zone touchée par la règle.
L'extrémité de la tige, en contact avec la boule, arrache des électrons à cette dernière, l'amenant ainsi à devenir chargée positivement ce qui explique la répulsion.
Le cuivre, l'aluminium et le carbone sont des matériaux qui laissent circuler les électrons ; ils sont appelés des conducteurs.
1.2. Conclusion
Les conducteurs sont des matériaux dont les charges électriques internes (électrons libres) se déplacent librement.
Exemples de conducteurs : tous les métaux, le carbone
2. Isolants électriques
2.1. Expérience
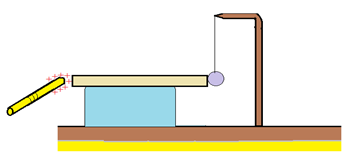
Reprenons la même expérience en remplaçant la tige en carbone par une autre en verre, puis en bois, puis en $P.V.C$, enfin plexiglas, $e$
2.1.1. Observation
La boule garde sa position dans le cas du bois, du verre, du $P.V.C$ et du plexiglas.
La boule ne s'électrise pas, malgré le contact avec les autres tiges.
2.1.2. Interprétation
Le bois, le plexiglas, le verre et le $P.V.C$ sont des matériaux qui ne permettent pas une circulation des électrons (la charge électrique reste localisée au bout des tiges du côté de la règle en plexiglas) ils sont appelés des isolants.
2.2. Conclusion
Les isolants électriques sont des matériaux dont les charges électriques internes (électrons libres) ne se déplacent pas librement.
Exemples d'isolants : le verre, l'ébonite, le Plexiglas, le caoutchouc, la porcelaine