Série d'exercices : Mouvement d'une particule chargée dans un champ magnétique uniforme - Ts
Classe:
Terminale
Exercice 1
1) On considère les ions de deux isotopes de mercure $_{80}^{200}Hg^{2+}$ et $_{80}^{202}Hg^{2+}$ de masses respectives $m_{1}=3.32\cdot10^{-25}kg$ et $m_{2}=3.35\cdot10^{-25}kg$ et de même charge $q=2e.$
Ils sont ensuite émis sans vitesse par la source $S$, puis accélérés par un champ électrostatique uniforme qui règne entre $S$ et $P$ tel que $U_{SP}=U=600V.$
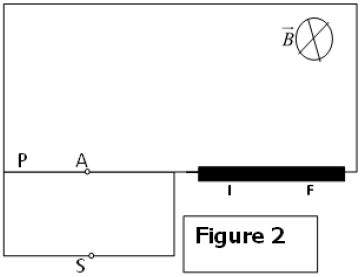
a) Déterminer l'expression littérale de la vitesse $\|\overrightarrow{V}\|$ en $A$ d'un ion de masse $m$ et de charge $q$ en fonction de $m$, $e$ et $U.$
b) Montrer que les deux ions $_{80}^{200}Hg^{2+}$ et $_{80}^{202}Hg^{2+}$ émis par $S$ arrivent en $A$ avec des vitesses différentes.
2) Ces deux ions pénètrent en $A$ dans une région où règne un champ magnétique uniforme $\overrightarrow{B}$ perpendiculaire au plan de la figure et tel que $\|\overrightarrow{B}\|=0.2T$ qui leur impose une trajectoire circulaire de rayon $R$, puis ils impressionnent une plaque photographique en deux points $I$ et $F.$
a) Établir l'expression de $R$ en fonction de $m$, $e$, $\|\overrightarrow{B}\|$ et $\|\overrightarrow{V}\|$ puis en fonction de $m$, $e$, $\|\overrightarrow{B}\|$ et $U.$
b) Calculer $R_{1}$ et $R_{2}$ et déduire la distance $IF$ entre les deux points d'impact, sur la plaque photo des ions des deux isotopes de mercure $Hg^{2+}$
Exercice 2
Un cyclotron est un instrument qui sert à accélérer des particules chargées, permettant ensuite de réaliser des expériences de physique nucléaire.
Dans ce problème les particules chargées sont des protons de masse $m_{p}=1.67\cdot10^{-27}kg$ et de charge électrique $q_{p}=+1.6\cdot10^{-19}C$
Le cyclotron est formé de deux demi-cylindres conducteurs creux appelés « dees » et séparés par un intervalle étroit.
Un champ magnétique uniforme $B$ règne à l'intérieur de chaque « dee », sa direction est parallèle à l'axe de ces demi-cylindres, sa valeur est $1.0T.$
Un champ électrique $E$ variable dans le temps, peut être établi dans l'intervalle étroit qui sépare les « dees ».
Il permet d'augmenter la vitesse des protons chaque fois qu'ils pénètrent dans cet intervalle.
Ce champ électrique variable est obtenu en appliquant une tension sinusoïdale de valeur maximale $U_{M}$ et de fréquence $f$ entre les deux « dees »: $U_{M}=2\cdot10^{3}V$
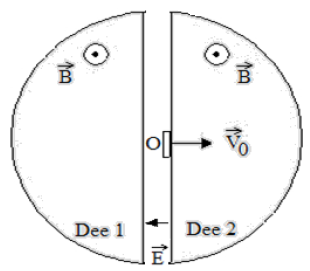
1. Le proton entre dans le « dee » $1$ avec une vitesse initiale d'injection $V_{0}$ perpendiculaire à l'axe des demi-cylindres.
On négligera le poids du proton devant la force magnétique.
1.1 Donner l'expression de la force agissant sur le proton en $O$ ; la représenter sur un schéma
1.2 Le mouvement du proton étant plan, montrer que la valeur de la vitesse est constante.
1.3 Montrer que la trajectoire est circulaire de rayon $R_{0}=\dfrac{m_{p}}{q_{pB}}V_{0}$
2.1 Exprimer la longueur parcourue par un proton sur le demi-tour de rayon $R_{0}.$
2.2 En déduire l'expression du temps $t$ mis par ce proton pour effectuer ce demi-tour.
2.3 Ce temps dépend-il de la vitesse d'entrée du proton dans le « dee » ?
Calculer la valeur de $t.$
3. Le proton, après avoir fait un demi-cercle dans un « dee », entre dans l'intervalle étroit où il est accéléré par le champ électrique considéré comme constant, maximum et colinéaire au vecteur vitesse du proton durant son passage.
Calculer la fréquence $f$ de la tension alternative appliquée entre les « dees » pour que les protons subissent une accélération maximale à chaque traversée de l'intervalle.
On suppose que le temps de traversée de l'intervalle est négligeable devant le temps passé dans les « dees ».
4.1 Exprimer littéralement, puis calculer la variation d'énergie cinétique $\Delta\,Ec$ du proton lorsqu'il traverse l'intervalle étroit.
Le résultat sera exprimé en joule puis en électron-volt.
4.2 Préciser si le rayon de la trajectoire du proton augmente ou diminue à chaque fois qu'il traverse l'intervalle étroit (justifier la réponse)
5. La vitesse d'injection du proton étant supposée pratiquement nulle, on désire que sa vitesse atteigne $2\cdot10^{4}km\cdot s^{-1}$
Calculer le nombre de tours que le proton devra décrire dans le cyclotron.
6. Calculer la valeur du rayon à partir duquel les protons ayant acquis une vitesse de $2\cdot10^{4}km\cdot s^{-1}$ seront extraits, en admettant qu'ils sont injectés à proximité immédiate du centre $O$ du cyclotron
Exercice 3 : Utilisation d'un spectrographe de masse
Sur le schéma ci-dessous, on retrouve la même zone $I$ d'ionisation fournissant les ions $X^{+}.$
On a ensuite la zone $II$ où on applique une tension accélératrice : $U'=8.00\,kV$ entre les plaques $P_{1}$ et $P_{2}$ permettant de donner aux ions $X^{+}$ une vitesse $v'.$
Dans la zone $III$ un dispositif de filtrage permet d'éliminer les éventuelles particules parasites qui auraient pu être obtenues par fragmentation des molécules $X$ lors de l'ionisation par choc électronique.
Enfin dans la zone $IV$ existe un champ magnétique de direction orthogonale au plan de figure et de norme : $B=1.80T.$
L'ion $X^{+}$, animé de la vitesse $v'$ pénètre en $O_{3}$ dans cette zone suivant l'axe $O_{3}x.$
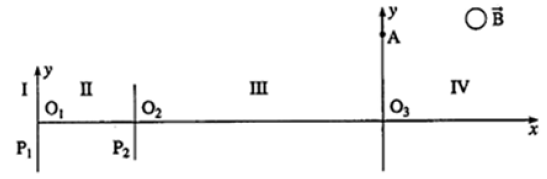
1) Rappeler l'expression de la force magnétique s'exerçant sur l'ion $X^{+}.$
Représenter sur un schéma le vecteur force pour que la déviation à partir de $O_{3}$ se fasse du côté positif de l'axe $O_{3}y.$
En déduire le sens du vecteur champ magnétique.
2) Démontrer que le mouvement de l'ion $X^{+}$ dans la zone $IV$ est plan et uniforme.
3) Montrer que l'ion $X^{+}$ décrit dans cette zone un arc de cercle, dont on établira l'expression littérale du rayon en fonction de $m$, $e$, $v'$ et $B.$
4) Exprimer le rayon du cercle trajectoire en fonction de $U'$, $m$, $e$ et $B.$
5) L'ion $X^{+}$ est recueilli au point $A$ tel que : $O_{3}A=0.069\,m.$
Trouver la masse de l'ion $X^{+}$ et identifier la substance $X.$
Exercice 4 : spectromètre de masse
Une source radioactive ponctuelle émet, suivant un axe $Ox$, un faisceau de particules passant entre les plaques horizontales d'un condensateur plan.
L'action de la pesanteur est négligeable devant celle de la force de Lorentz.
En l'absence de tout champ, les particules frappent en $O$ un écran situé à la distance a de la sortie du condensateur.
On soumet alors le faisceau à un champ électrique uniforme et vertical $\overrightarrow{E}$, créé par le condensateur, et à un champ magnétique, uniforme, horizontal, perpendiculaire à l'axe $Ox$ et dirigé d'avant $\overrightarrow{B}$ en arrière.
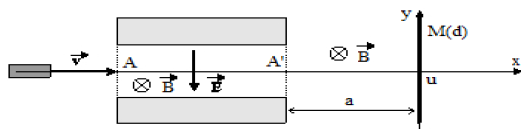
a) Les particules entrent en $A$ dans le condensateur avec une vitesse parallèle à $Ox.$
Quelle doit être la valeur du champ $\overrightarrow{E}$ pour que les particules ne soient pas déviées ?
Que se passe-t-il si $q$ change de signe ?
b) Le faisceau horizontal et monocinétique sortant en $A'$ du condensateur, est ensuite soumis à la seule action du champ magnétique et vient frapper l'écran au point $M$ tel que $OM=d.$
i) Montrer que les particules de même rapport $q/m$ décrivent des trajectoires circulaires uniformes de même rayon $R.$
Calculer $R.$
Quel effet a le signe de $q$ sur la déviation ?
ii) Montrer que $R=(d^{2}+a^{2})/2d.$
En déduire la valeur de $q/m.$
c) A.N. : on détecte des particules pour la valeur suivante des champs et de la déviation $d$ : $B=0$, $32T$ $E=6.4\cdot10^{6}Vm^{-1}$ ; $a=50\,cm$, $d=10\,cm$ vers le haut.
Identifier ces particules sachant que pour l'électron $e=1.6\cdot10^{-19}C$, $m_{e}=9.1\cdot10^{-31}Kg$ et pour le proton et le neutron $m_{p}=m_{n}=1830\,m_{e}$
Exercice 5
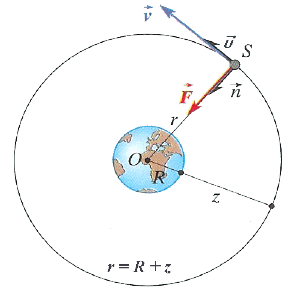
Une particule de charge $q$, de masse $m$ traverse une chambre de Wilson dans laquelle règne un champ magnétique $B$ uniforme perpendiculaire au plan de la figure et orienté vers l'avant de ce plan.
La particule ralentit en franchissant la surface $AB.$
Le cliché matérialisant la trajectoire permet de dire que la particule décrit des arcs de cercles de rayons $r_{1}$ et $r_{2}$ respectivement dans les parties $I$ et $II.$
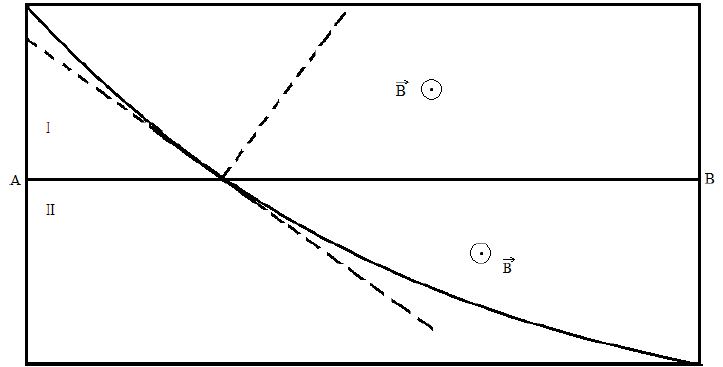
1. Établir l'expression de $r_{1}$ et $r_{2}$ en fonction de $q$, $m$, $B$ et des vitesses respectives $v_{1}$ et $v_{2}$ de la particule.
Dans quel sens se déplace la particule $($de $I$ vers $II$ ou de $II$ vers $I)$ ?
On donne : $r_{1}=\dfrac{r_{2}}{3}=14\,cm$
2. Quel est le signe de la particule ?
Justifier la réponse
3. Calculer la charge massique $\dfrac{q}{m}$ et identifier la particule
On donne :
$B=0.50T$ ;
$v=2.0\cdot10^{7}m\cdot s^{-1}$ ;
$m_{e}=9.1\cdot10^{-31}Kg$ ;
$m_{p}=1.67\cdot10^{-27}Kg$ ;
$e=1.6\cdot10^{-19}C$
Exercice 6
Dans tout le problème, on négligera le poids de la particule devant les autres forces et on appliquera les lois de la mécanique classique
On envisage la séparation d'isotopes du Xénon $(Xe)$ au moyen d'un spectrographe de masse
Une chambre d'ionisation produit des ions positifs $_{54}^{129}Xe^{+}$ et $_{54}^{x}Xe^{+}.$
Ces ions sont ensuite accélérés entre deux plaques métalliques parallèles $P_{1}$ et $P_{2}$, puis à l'action d'un champ magnétique permet de les séparer
On donne :
$e=1.6\cdot10^{-19}C$,
$m_{n}=m_{p}=1.67\cdot10^{27}Kg$
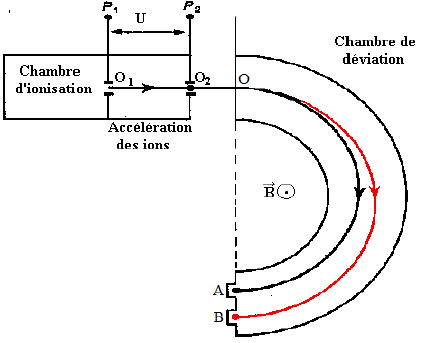
1. Accélération des ions
Les ions traversent la plaque $P_{1}$ en $O_{1}$ sans vitesse initiale.
Ils sont alors soumis entre $P_{1}$ et $P_{2}$ à une accélératrice $U=1000V$
a) Dans quel sens cette tension doit-elle être établie
b) Montrer que l'énergie cinétique, acquise par les ions lorsqu'ils traversent la plaque $P_{1}$ en $O_{1}$, est indépendante de l'isotope envisagé et cette valeur en joules
c) Calculer la vitesse acquise par les ions $_{54}^{129}Xe^{+}$ en $O_{2}.$
On assimilera la masse de l'ion à la somme des masses de ses nucléons
d) Exprimer en fonction de $x$ et $v$, la vitesse $v'$ acquise par les ions $_{54}^{x}Xe^{+}$ en $O_{2}$
2. Séparation des ions
Les ions, animés des vitesses $v$ et $v'$, pénètrent en $O$ dans une région où règne un champ magnétique $\overrightarrow{B}$ uniforme perpendiculaire au plan de la figure
a) On s'intéresse au mouvement des ions $_{54}^{129}Xe^{+}.$
Montrer que celui-ci est plan, circulaire et uniforme.
Donner l'expression du rayon de courbure $R.$
Calculer $R$ pour $B=0.1T$
Les ions $_{54}^{129}Xe^{+}$ et $_{54}^{x}Xe^{+}$ décrivent un demi-cercle avant de tomber sur plaque photographique, respectivement en $A$ et $B$
b) On mesure la distance $AB=8\,cm.$
En déduire la valeur de $x\ (B=0.1T)$
Exercice 7
Pour identifier des ions désignés par $X_{1}$ ; $X_{2}$ ; $X_{3}$ et $X_{4}$, portant chacun une charge de valeur absolue $|q|=e$ on les introduit successivement dans une région où règne un champ magnétique $B$ uniforme avec la même vitesse $v_{0}.$
Les trajectoires obtenues sont représentées sur la figure suivante
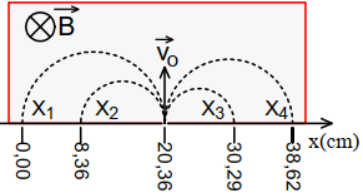
1. Montrer que le mouvement d'une particule de masse $m$ et de charge $q$ de vitesse initiale $v_{0}$ perpendiculaire au vecteur champ magnétique uniforme $B$ est un mouvement uniforme circulaire.
Puis montrer que : $$R=\dfrac{mV_{0}}{|q|B}$$
Donnée :
la masse de l'ion d'un élément $^{A}X$ est : $m=Au$
2. En exploitant la figure :
2.1 Identifier le signe de la charge portée par chacun des ions $X_{1}$ ; $X_{2}$ ; $X_{3}$ et $X_{4}$ ?
2.2 Déterminer les rayons $R_{1}$ ; $R_{2}$ ; $R_{3}$ et $R_{4}$ de ces ions.
3. Identifier les ions $X_{1}$ ; $X_{2}$ ; $X_{3}$ et $X_{4}$ dans la liste suivante :
$^{39}K^{+}$ ; $^{23}Na^{+}$ ; $^{35}Cl^{-}$ ; $^{19}F^{-}.$
Exercice 8
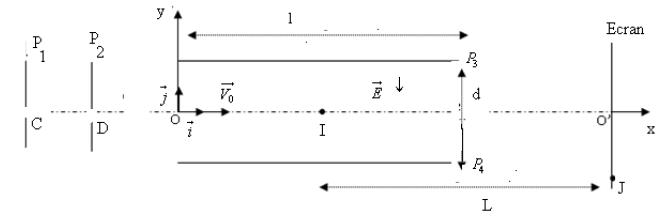
Un faisceau d'électrons émis par une cathode pénètre par le point $A$ de coordonnées $x_{A}=-0.20(m)$ ; $y_{A}=0$ avec une vitesse $\overrightarrow{V}_{0}=V_{0}\vec{j}$ dans une région où règne un champ magnétique uniforme $\overrightarrow{B}$ normal au plan $(Oxy)$ ou s'effectue le mouvement.
L'électron quitte le champ magnétique en $C$ avec une vitesse $\overrightarrow{V_{C}}$ pour aborder une zone où règne un champ électrostatique uniforme $\overrightarrow{E}$ pour en sortir au point $D$ de coordonnées $x_D=+0.20(m)$ ; $y_{D}=0$ avec une vitesse $\overrightarrow{V_{D}}$
1. Étude du mouvement de l'électron dans le champ $\overrightarrow{B}$
1.1 En appliquant la deuxième loi de Newton montrer que :
$-\ $ Le mouvement de l'électron est uniforme
$-\ $ Le mouvement de l'électron est circulaire
1.2 Donner l'expression du rayon $R$ de la trajectoire de l'électron
1.3 Calculer la valeur de l'intensité de $\overrightarrow{B}$
1.4 Déterminer la durée du mouvement de l'électron dans cette zone
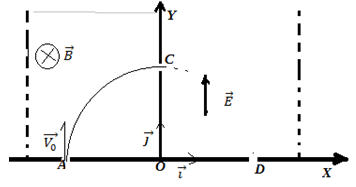
2. Étude du mouvement de l'électron dans le champ $\overrightarrow{B}$
On prend comme origine des dates $(t=0)$ l'instant d'arrivée de l'électron au point $C$
2.1 En appliquant la deuxième loi de Newton :
$-\ $ Établir les équations horaires du mouvement de l'électron
$-\ $ En déduire l'équation de la trajectoire dans le repère $(O\;,\ \vec{i}\;,\ \vec{j})$
2.2 Calculer la valeur de l'intensité de $\overrightarrow{E}$
2.3 Déterminer la durée du mouvement de l'électron dans cette zone
Les données : on néglige l'effet du champ de pesanteur sur l'électron ; la charge de l'électron
$-e=-1.6\cdot10^{-19}C$ ; $V_{0}=10^{7}m\cdot s^{-1}$ ;
la masse de l'électron : $m=9.1\cdot10^{-31}kg$ ; les directions de $\overrightarrow{V_{0}}$ et celle de $\overrightarrow{V_{C}}$ font un angle de $\dfrac{\pi}{2}$ radian ; le repère $(O\;,\ \vec{i}\;,\ \vec{j})$ est orthonormé
Exercice 9
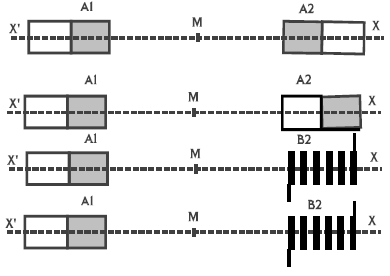
Le spectrographe de masse est un dispositif utilisé pour la séparation des isotopes.
Il est constitué :
$-\ $ d'une chambre (1) d'ionisation dans laquelle sont ionisés les isotopes à séparer,
$-\ $ d'une chambre (2) d'accélération des ions dans laquelle règne un champ électrique uniforme $\overrightarrow{E}$ créé par une tension $U_{0}$ appliquée entre deux plaques $(P_{1})$ et $(P_{2})$,
$-\ $ d'une chambre (3) hémicylindrique dans laquelle règne un champ magnétique uniforme $\overrightarrow{B}$,
$-\ $ d'un détecteur d'ions.
On se propose de séparer des isotopes de l'élément chlore.
On négligera dans tout l'exercice, le poids de l'ion chlorure devant les autres forces qui interviennent
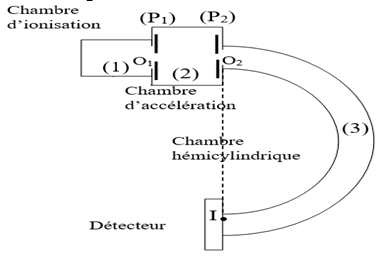
1) a) Préciser le sens de pour que des ions négatifs, sortant de la chambre d'ionisation en $O_{1}$ avec une vitesse nulle, aient, dans la chambre d'accélération, un mouvement rectiligne accéléré suivant la direction $O_{1}O_{2}$ ?
Justifier la réponse.
b) Montrer qu'au point $O_{2}$, l'énergie cinétique est la même pour les différents types d'ions accélérés qui correspondent au même élément chimique et qui portent la même charge électrique.
En est-il de même pour les vitesses ?
Justifier la réponse.
2) Dans la chambre (3) règne un champ magnétique $\overrightarrow{B}$ normal au plan contenant $O_{1}$, $O_{2}$ et $I.$
Préciser son sens pour que des ions négatifs soient déviés vers un point d'impact $I$ du détecteur.
3) Préciser la nature du mouvement d'une particule chargée dans chacune des chambres (2) et (3).
4) Des ions chlorure $Cl^{-}$ sont accélérés sous une tension $U_{0}=500V.$
a) Déterminer l'intensité du champ magnétique $\overrightarrow{B}$ qui doit régner dans la chambre (3) pour que des ions $^{35}Cl^{-}$ viennent frapper le détecteur au point d'impact $I$ situé à $19cm$ de $O_{2}.$
b) Au niveau du détecteur et en un point $I'$ situé plus loin que $I$ du point $O_{2}$, on reçoit des ions négatifs désigné par $^{A}Cl^{-}.$
Sachant que la distance qui sépare le point $I$ du point $I'$ est $0.6cm$, déterminer le nombre de masse de l'ion $^{A}Cl^{-}$ considéré.
c) Répondre par vrai ou faux aux propositions suivantes :
Dans un champ électrique uniforme, une particule chargée mobile suit toujours une trajectoire rectiligne.
Dans un champ magnétique uniforme, une particule chargée mobile suit toujours une trajectoire circulaire.
Développer, dans chaque cas, ce qui justifie la réponse.
On donne :
Charge électrique élémentaire : $e=1.6\cdot10^{-19}C$ ; Unité de masse atomique : $u=1.66\cdot10^{-27}kg$
Exercice 10
Une particule injectée au cœur du cyclotron va être accélérée par le champ électrique alternatif de haute fréquence entre les « dés ».
Puis, elle entre dans le « dé » suivant lorsque le champ électrique change de sens et elle est donc à nouveau accélérée, et ainsi de suite
Sa trajectoire devient plus périphérique du fait de son augmentation d'énergie.
Elle sera éjectée de l'accélérateur avec l'énergie adéquate à partir de cette dernière trajectoire, puis guidée et focalisée jusqu'à sa cible.
1. Représenter, en justifiant, au point $A$ de la trajectoire de l'ion injecté dans le cyclotron, le vecteur vitesse $\overrightarrow{v}$ de l'ion et la force magnétique $\overrightarrow{F_{m}}$ qui s'exerce sur l'ion.
Représenter le champ magnétique, $\overrightarrow{B}$ dans l'hypothèse où la charge $q$ de l'ion est positive.
2. Montrer que l'action du champ $\overrightarrow{B}$ ne permet pas d'accroître l'énergie cinétique de l'ion.
3. Démontrer que dans un $« D »$, dans l'hypothèse où le champ magnétique est uniforme et constant, le mouvement de l'ion est circulaire uniforme et exprimer le rayon de la trajectoire en fonction de $m$ (masse de l'ion), $v$ (module de la vitesse de l'ion), $q$ et $B.$
4. Montrer que la durée de passage dans un demi-cylindre, notée $t_{p}$ ne dépend pas de $v.$
Pour accroître l'énergie cinétique de l'ion, on utilise l'action du champ électrique $\overrightarrow{E}$ résultant de la tension $u$ appliquée entre les deux $« D ».$
On considère que pendant la durée très courte de passage de l'ion d'un $« D »$ à l'autre, la tension $u$ reste constante.
5. Déterminer, en fonction de $q$ et $u$ les expressions des variations de l'énergie cinétique de l'ion lors de la traversée de l'espace entre les deux $« D ».$
6. Un ion est injecté dans la zone d'accélération avec une vitesse nulle.
Quelle est sa vitesse $v_{1}$ au moment de la pénétration dans le premier $« D »$ et quel est le rayon $R_{1}$ de la première trajectoire semi-circulaire ?
7. On peut négliger la durée de passage de l'ion dans l'intervalle entre les deux $« D »$ devant la durée de passage de l'ion dans un demi-cylindre.
La tension $u$ est une fonction sinusoïdale du temps qui doit être synchronisée avec le mouvement des particules chargées de telle sorte que le champ électrique soit inversé à chaque demi-tour.
Quelle doit être la fréquence d'oscillation de cette tension $u(t)$ permettant d'obtenir une accélération de l'ion à chaque passage dans l'intervalle entre les deux $« D ».$
8. Après chaque passage dans l'intervalle entre les deux $« D »$, la vitesse de la particule ainsi que le rayon $R$ de sa trajectoire dans un $« D »$ augmentent.
Déterminer les suites $v_{k}$ et $R_{k}$, l'indice $k$ étant incrémenté d'une unité à chaque demi-tour.
9. Lorsque ce rayon finit par atteindre le rayon $R_{D}$ d'un $« D »$, l'ion est alors éjecté du cyclotron.
Exprimer en fonction de $m$, $q$, $B$ et $R_{D}$ l'énergie cinétique $E_{k}$ de l'ion lors de son éjection.
10. Application numérique.
Calculer, en joule, puis en $MeV$, l'énergie cinétique $E_{k}$ d'un ion zinc $Zn^{11+}$ sachant que :
$B=1.67T$ ; $m=1.06\cdot10^{-25}kg$ ; $R_{D}=0.465m$ ; $e=1.60\cdot10^{-19}C$